新风胶囊调控巨噬细胞M1/M2型极化对DBA/1小鼠胶原诱导型关节炎的影响
陶艳红 ,刘健,徐昌萍,陈君洁,周娜,王泽,曹云祥,黄传兵
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎为特征的自身免疫性疾病,其特征是由浸润性的滑膜炎症导致的关节损伤,进而产生软骨和骨质侵蚀,最终引起关节畸形,对病人的日常活动有着严重不良影响[1]。虽然RA的确切发病机制尚不清楚,前期多项研究发现巨噬细胞是引起RA 的关键性因素之一。巨噬细胞是机体的免疫细胞,被发现可趋化至关节滑膜处,参与机体炎症反应[2-5]。现代研究表明,巨噬细胞能够发挥免疫应答作用,进而维持机体内环境的稳态,当这种动态平衡被打破时,在特定环境下,巨噬细胞可极化为M1和M2型,M1型分泌大量的炎性因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1等,同时TNF-α 还可活化免疫细胞中的核转录因子-κB(NF-κB)信号通路,放大炎症效应,从而引起并加剧组织细胞损伤,M2型释放抑炎因子,可降低人体的炎症反应,在组织修复中发挥作用[6-7]。通过建立RA动物模型,研究人员发现促进滑膜组织的巨噬细胞凋亡或抑制M1型极化,可达到缓解RA的目的[8-9]。由此可见,调控巨噬细胞M1/M2型极化可有效干预滑膜组织中炎症的发展。
目前,西医在临床治疗上采用非甾体抗炎药、抗风湿药物、糖皮质激素和生物制剂等虽然能够有效地改善RA的长期治疗预后,但同时也伴随着对人体肝、肾脏各项机能的损害、胃肠道反应和白细胞数量的减少等多种情况导致的不良反应[10]。因此,寻找一条新的辅助治疗思路极为迫切,近年来,随着中医中药的发展与崛起,传统中医药具有成本低、毒副作用小、整体调理等优势,其在RA中的推广与使用引起了人们越来越广泛的关注。新风胶囊(Xinfengcapsule,XFC)是安徽中医药大学第一附属医院生产的中药复方制剂,由黄芪、薏苡仁、雷公藤、蜈蚣四种中药材组成,具有益气健脾、通络止痛之功。课题组前期研究证实,XFC被发现可以减轻实验动物RA症状,并具有抗炎功能,但其缓解RA潜在的调控机制尚需深入研究[11-12]。本研究自2020年6月至2021年5月以胶原诱导型关节炎(collageninduced arthritis,CIA)小鼠为模型,巨噬细胞极化为主线,通过动物体内外实验来探讨XFC调控巨噬细胞极化对改善RA的影响。
1 材料与方法
1.1 实验动物SPF级雄性DBA/1小鼠购自北京华阜康,许可证号SCXK(京)2019-0008。饲养于安徽中医药大学动物实验中心,实验光照时间为7点至19点,研究人员将饲养环境设置为室温20~26 ℃、相对湿度40%~70%,在该条件下对小鼠实施适应性喂养。最后取18只7~8周龄,体质量18~22 g的雄性小鼠开展实验。
1.2 试剂与仪器
1.2.1 实验药品与试剂 牛源性Ⅱ型胶原购于美国Chondrex;HE染色试剂盒、蛋白质印迹(Western blotting)试剂盒购于碧云天,二甲苯购于上海化学试剂有限公司;全蛋白提取试剂盒购于上海源叶生物科技有限公司;二辛可宁酸(BCA)蛋白检测试剂盒购自江苏凯基生物公司;增强化学发光法(ECL)发光液购自Millipore;聚偏二氟乙烯膜(PVDF)购自Bio-Rad。
1.2.2 主要仪器 冰冻切片机购自日本 Olympus公司;电泳仪购自福禄克国际;凝胶成像仪购自SIM公司;4 ℃冰箱购于北京福意电器有限公司;转膜仪购自Bio-Rad。
1.3 方法
1.3.1 CIA模型的建立、分组和给药 小鼠适应性饲养1周后,按体质量随机分为三组,分别为NC组、M组和XFC组,每组6只。选用 M 组和XFC组开始造模。将2 g/L 牛源性Ⅱ型胶原(bovine collagen Ⅱ,BⅡ)在等量Freund’s complete adjuvant中进行乳化,在小鼠尾根部皮下注射100 μL乳化BⅡ。第21天将BⅡ在等量Freund不完全佐剂中进行乳化并以同样的方式加强免疫。第二次免疫当天,XFC组每天灌胃一定浓度的实验药物治疗。鉴于课题组前期研究基础,NC组及M组予生理盐水灌胃,1 mL/100 g,每天1次。XFC组:新风胶囊混悬液1.5 mL/100 g灌胃,每天1次[13]。持续给药至二个时间节点(42 d)处死小鼠取材,第42天处死小鼠进行关节滑膜组织检测。
1.3.2 记录关节炎指数(arthritis index,AI)评分首次免疫后,研究人员每3 d记录各组小鼠发生关节炎的爪数,并对每只关节炎爪的关节严重程度进行评分。计算平均值并连续记录至第42天。AI评分最高为16分,按照AI评分标准将四肢红肿程度评为1~4分。0分:无红肿;1分:轻微发红;2分:中度发红;3分:全足明显红肿;4分:全足红肿,伴关节变形和运动障碍。AI评分≥ 1分即为造模成功[14]
1.3.3 HE染色法观察滑膜组织病理学变化 取小鼠右后肢,4%多聚甲醛固定,乙醇分步脱水,二甲苯透明后石蜡浸渍,包埋,制成蜡块后切成4 μm薄片;将蜡块组织依次浸入二甲苯(Ⅰ)及二甲苯(Ⅱ)各10 min,随后将乙醇分步脱水,用蒸馏水洗涤2 min;苏木素染色5 min,清水冲洗1 min,盐酸乙醇分化 20 s,酸水、氨水反蓝 20 s,伊红染色 5 min,再次使用乙醇分步脱水,经二甲苯使切片透明,将透明的切片滴上树胶,然后用盖玻片密封,制成中性树胶封片,显微镜下观察小鼠关节的形态和结构。
1.3.4 Western blotting检测蛋白表达水平 用预冷的PBS 缓冲液洗涤关节滑膜组织,加入50 μL裂解液,并与 100 mol/L PMSF 以100∶1混合制备,处理25 min至完全裂解,然后将蛋白吸于EP 管,在4 ℃,12 000 r/min下离心 5 min,吸取上清置于-80 ℃环境中,分装保存。用BCA试剂盒测量OD值,计算蛋白量,配制SDS-PAGE 凝胶,加入样品,使样品在100 V电泳条件下分离,恒定电流转移至预先准备的PVDF膜上1 h。使用5%的脱脂奶粉封闭2 h,加入稀释后的CD68抗体、INOS抗体、GAPDH抗体,摇床4 ℃孵育过夜。将一抗回收,用Western液洗涤5~10 min,共3次,二抗同样孵育1 h,用Western液洗涤,ECL试剂检测蛋白。
1.4 统计学方法使用 SPSS 21.0软件进行统计学分析,数据以±s表示,多组间比较采用单因素方差分析,两两比较使用 LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 CIA造模成功及关节炎严重程度评分M组、XFC组小鼠造模后足爪均充血红肿,关节开始出现畸形,小鼠活动受限,NC组四肢无红肿、畸形,AI评分为0。第二次免疫开始,每3 d记录发生关节炎的爪数、右后爪关节炎严重程度评分和四肢关节炎评分均值。实验结果表明:
①首次免疫后21 d~42 d,NC组小鼠四肢发生关节炎的次数为0,M组和XFC组发病的关节数量均高于NC组,随着时间延长,两组的关节炎爪数也相应升高,M组于致炎30 d发病至最高峰,后保持不变;与M组比较,XFC组上升速度明显减缓,发病爪数明显减少(表1)。
表1 新风胶囊(XFC)对免疫后不同时间胶原诱导型关节炎(CIA)小鼠发生关节炎爪数的影响/± s

表1 新风胶囊(XFC)对免疫后不同时间胶原诱导型关节炎(CIA)小鼠发生关节炎爪数的影响/± s
注:①与NC组比较,P<0.05。②与 M组比较,P<0.05。
组别NC M XFC 1.5 mL/100 g F值P值鼠数6 6 6 21 d 0 0 0 24 d 0 0.83 ± 0.75①0.50 ± 0.55①②3.65 0.051 27 d 0 2.17 ± 0.41①1.00 ± 0.63①②37.35<0.001 30 d 0 3.83 ± 0.41①1.50 ± 0.55①②143.93<0.001 33 d 0 3.83 ± 0.41①1.67 ± 0.52①②153.46<0.001 36 d 0 3.83 ± 0.41①1.83 ± 0.41①②198.50<0.001 39 d 0 3.83 ± 0.41①2.00 ± 0.63①②116.77<0.001 42 d 0 3.83 ± 0.41①2.17 ± 0.41①②199.50<0.001
②首次免疫后21~42 d,NC组右后爪关节炎严重程度评分为0,M组评分随时间延长明显上升后缓慢下降,XFC组评分缓慢上升后缓慢下降,且上升幅度始终低于M组(表2)。
表2 新风胶囊(XFC)对免疫后不同时间胶原诱导型关节炎(CIA)小鼠右后爪关节炎严重程度评分的影响/(分,± s)

表2 新风胶囊(XFC)对免疫后不同时间胶原诱导型关节炎(CIA)小鼠右后爪关节炎严重程度评分的影响/(分,± s)
注:①与NC组比较,P<0.05。②与 M组比较,P<0.05。
组别NC M XFC 1.5 mL/100 g F值P值鼠数6 6 6 21 d 0 0 0 24 d 0 0.50 ± 0.84①0.33 ± 0.52①②1.21 0.327 27 d 0 1.17 ± 0.75①0.50 ± 0.84①②4.87 0.023 30 d 0 2.83 ± 0.75①1.00 ± 1.10①②21.04<0.001 33 d 0 2.67 ± 0.52①1.33 ± 1.03①②24.000<0.001 36 d 0 2.67 ± 0.52①1.33 ± 0.82①②34.29<0.001 39 d 0 2.67 ± 0.52①1.17 ± 0.75①②38.60<0.001 42 d 0 2.50 ± 0.55①1.17 ± 0.75①②32.50<0.001
③首次免疫后21~42 d,NC组四肢评分均值为0,随着造模时间延长,M组四肢评分均值缓慢上升,XFC组先缓慢上升,于致炎第39天至最高峰,后出现逐渐下降趋势,且XFC组评分均值始终低于M组(表3)。
表3 新风胶囊(XFC)对免疫后不同时间胶原诱导型关节炎(CIA)小鼠四肢关节炎评分均值的影响/(分,± s)

表3 新风胶囊(XFC)对免疫后不同时间胶原诱导型关节炎(CIA)小鼠四肢关节炎评分均值的影响/(分,± s)
注:①与NC组比较,P<0.05。②与 M组比较,P<0.05。
组别NC M XFC 1.5 mL/100 g F值P值鼠数6 6 6 21 d 0 0 0 24 d 0 0.25 ± 0.27①0.13 ± 0.14①②3.00 0.080 27 d 0 0.92 ± 0.47①0.33 ± 0.20①②15.00<0.001 30 d 0 2.17 ± 0.38①0.75 ± 0.27①②100.58<0.001 33 d 0 2.17 ± 0.34①0.75 ± 0.25①②130.75<0.001 36 d 0 2.25 ± 0.27①0.79 ± 0.19①②212.36<0.001 39 d 0 2.21 ± 0.25①0.83 ± 0.26①②176.15<0.001 42 d 0 2.29 ± 0.33①0.79 ± 0.19①②167.21<0.001
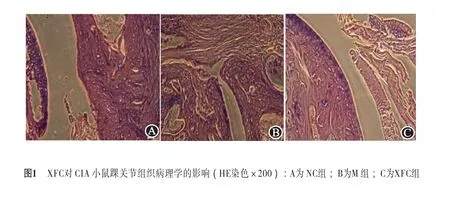
2.2 CIA 小鼠踝关节组织HE染色结果NC组关节组织形态结构正常,滑膜腔内未见明显炎性细胞浸润,M组滑膜腔内可见炎性细胞浸润及血管翳形成,软骨表面被侵蚀,增生滑膜侵入皮下。与M组相比,XFC组滑膜腔内血管翳减少,关节组织结构基本正常(图1)。
2.3 XFC降低CIA小鼠滑膜组织CD68、iNOS的蛋白表达水平蛋白质印迹法结果表明:与NC组比较,M组与XFC组小鼠滑膜组织中CD68、iNOS蛋白表达均增加;与M组相比,XFC组小鼠滑膜组织中CD68和iNOS蛋白表达降低(P<0.05)。见图2。
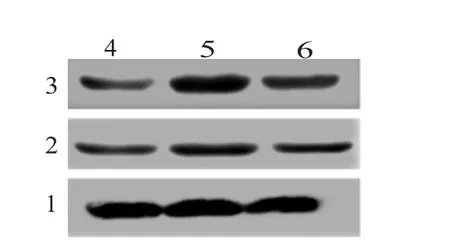
图2 XFC对CIA小鼠滑膜组织CD68、iNOS的蛋白表达的影响
3 讨论
RA属于中医“痹证”范畴,因其病程长而难以治愈,后人称之为“尪痹”,是风湿免疫科的常见病症之一[15]。临床上RA多表现为关节肿痛,严重者可导致关节变形。RA的病理基础为滑膜炎症。本研究结果发现,XFC具有降低CIA小鼠模型AI评分、血管翳形成和滑膜炎症细胞浸润数量,降低关节滑膜组织中CD68、iNOS的蛋白表达水平的作用。表明XFC具有改善CIA小鼠体内炎症诱导的关节滑膜损伤的功能。
作为公认研究人类RA的经典动物模型,CIA 小鼠易感且成本较低,能够模拟RA的治疗作用,目前是人类较为理想的动物模型[16]。由于该动物模型造模成熟和发病稳定,而被广泛应用于RA治疗的多个研究和探索的领域,因此,选用CIA模型突出了XFC治疗作用的靶点。中药复方XFC遵循中医整体调节的原则,方中黄芪益气健脾;薏苡仁可达健脾利湿、舒筋除痹之功;雷公藤消肿止痛;蜈蚣祛风通络止痛,根据现代药理学研究成果,方中选用的中草药具有抗风湿、调节免疫、抗炎等药理作用[17]。课题组初步发现,使用XFC治疗AA大鼠后,血清中IL-10显著升高,IL-17 水平显著降低,前期已发现IL-17 是参与自身免疫性疾病发生、发展的重要炎症介质,由此推测XFC具有抗炎作用[18-19]。实验结果显示与M组相比,治疗后小鼠AI评分、滑膜中血管翳形成数量和炎性细胞浸润明显减少,提示XFC能够显著改善CIA小鼠的关节肿胀情况,抑制血管翳的生成,抑制炎症发展,这与之前的研究结果保持一致。
现代研究认为,巨噬细胞参与机体固有免疫系统,具有吞噬、杀灭病原微生物、炎症防御等功能,在人体非特异性免疫中发挥了重要作用。在人体被外界因素刺激时,巨噬细胞会表现为活化状态,从而清除异物,来保护人体不被伤害。然而,当巨噬细胞清除异物时,也随之会释放TNF-α、IL-1等炎性因子,导致人体产生炎症反应,进而对机体某些组织造成损伤。通常巨噬细胞不会大量增多,当其受到某种信号,如巨噬细胞集落刺激因子(GM-CSF) 、表皮生长因子(EGF)的诱导时,会在机体内大量增殖。GM-CS是一种在造血细胞产生及活性表达的过程中发挥调节作用的细胞因子。GMCSF 在正常生理条件下的表达水平较低。当人体发生感染或炎症时,GM-CSF可短时间内急剧增加。在自身免疫炎症小鼠模型中,GM-CSF 阻断剂减少了中性粒细胞和单核细胞的聚集,从而降低疾病的严重性[20]。此外,GM-CSF还能将巨噬细胞极化为M1型巨噬细胞,产生并分泌TNF-α、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等致炎因子[21]。CD68是巨噬细胞的通用标志物,可以同时识别M1和M2两种表型[22]。iNOS的表达和活性可用于M1型和M2型巨噬细胞的鉴别,在巨噬细胞中,M1型则以高度表达 MCP-1和iNOS 等促炎细胞因子为标志[23-24]IA动物模型中,XFC组CD68、iNOS的蛋白表达水平显著低于模型组,由此推测XFC可能通过下调滑膜组织中中M1型巨噬细胞的表达抑制促炎细胞的释放,以减轻关节炎症。
综上所述,新风胶囊可缓解因滑膜炎症导致的关节红肿疼痛,并可能通过下调滑膜组织中M1型巨噬细胞表达,抑制炎性因子的产生和分泌,从而对CIA小鼠模型产生保护作用。

