糖肝煎对2型糖尿病大鼠摄食及摄食抑制因子1、饥饿素的影响
陶毅,徐乃佳,胡爱民
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以胰岛细胞损伤及胰岛素抵抗(insulin resistance,IR)为临床特征的代谢性疾病[1]。T2DM慢性高血糖会对机体脏器产生长期损害,从而严重影响患者的生活质量[2]。研究发现,摄食过盛造成的能量代谢紊乱与糖尿病的发生密切相关,摄食抑制因子1(Nesfatin-1)是一种由核连蛋白 2(nucleobindin 2,NUCB2)水解产生的摄食抑制因子,而最近研究表明,其还具有抗高血糖的作用[3]。饥饿素(Ghrelin)作为生长激素释放肽不仅可通过激活机体下丘脑神经回路来刺激食物的摄取,其缺失还可降低血糖并促使胰岛素(insulin,INS)分泌[4]。Nesfatin-1与Ghrelin作为机体能量代谢的调控因子,可通过调控食物摄取能力来改变摄食量,从而调控机体的能量代谢,已得到多项研究证实,但关于中草药在此方面的研究甚少[3-4]。糖肝煎是临床中用于治疗糖尿病等慢性代谢性疾病的常用药,对T2DM的糖脂代谢具有良好的改善作用[5],不断深入了解其治疗机制对T2DM的治疗具有重要意义[1-2]。因此本研究自2021年12月至2022年2月以T2DM大鼠为对象,通过探究糖肝煎对T2DM大鼠摄食及血浆Nesfatin-1、Ghrelin水平的影响,为糖肝煎在T2DM中的治疗机制研究提供依据。
1 材料
1.1 实验动物将由辽宁长生生物技术股份有限公司[许可证SCXK(辽)2020-0001]购买的50只SPF级SD大鼠(180±10)g与明暗交替12 h的环境中适应性饲养1周。本研究中对于大鼠的处理符合动物实验伦理学相关标准。
1.2 主要试剂糖肝煎中所含药材由武汉市中医医院中药房提供;链脲佐菌素(STZ,常州贝源鑫生物科技有限公司,批号BYX455A);利格列汀(5 mg,扬子江药业集团上海海尼药业有限公司,批号H20213378);INS、Ghrelin试剂盒(E-EL-R2466c、EEL-R0842c,伊莱瑞特);低密度脂蛋白胆固醇(LDLC)、三酰甘油(TG)高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)(长春汇力生物技术有限公司,批号C047-a、C019-a、C046-a、C048-a);NUCB2 试剂盒(MM-70231R2,酶免);Nesfatin-1 ELISA试剂盒(无锡云萃生物科技有限公司YRX302227R);Chemray240全自动生化分析仪(Rayto);FlexStation 3多功能酶标仪(Molecular Devices)。
2 方法
2.1 糖肝煎提取浓缩糖肝煎由茯苓、白芍、茵陈、当归、柴胡等中药组成,其中白芍、茯苓、茵陈用水煎煮,其余打粉,混合成浸膏后0.9%氯化钠溶液稀释为含生药量为0.28 g/mL及0.56 g/mL的悬浊液。
2.2 分组与T2DM模型构建将50只所购SD大鼠采用随机数字表法随机分成正常组(10只)、模型组(40只),构建T2DM模型大鼠:模型组大鼠连续8周给予高脂饲料喂养后,禁食12 h,尾静脉一次性注射STZ(0.15 g/kg,由柠檬酸缓冲盐溶液溶解),正常组大鼠饲喂基础饲料,并注射柠檬酸钠缓冲盐溶液;1周后若大鼠空腹血糖(FBG)≥11.1 mmol/L,且出现三多一少(多食、多尿、多饮、体质量减轻)症状则造模成功[6],成功后正常组大鼠继续饲喂基础饲料,模型组大鼠饲喂高脂饲料,将模型组分为T2DM组、利格列汀组(50 mg/kg利格列汀)[7]、低剂量组(2.8 g/kg糖肝煎)、高剂量组(5.6 g/kg糖肝煎)[8],10只/组;利格列汀组、低剂量组及高剂量组连续4周分别给予相应药物灌胃,正常组及T2DM组给予等量生理盐水,1次/天,于实验结束后观察大鼠一般情况,并称取大鼠体质量,称量大鼠实验结束后12 h进食量并量取实验结束后12 h耗水量和尿量,计算各组大鼠的摄食量、摄水量、尿量。
2.3 大鼠一般指标测定于造模结束1周后抽取所有大鼠3 mL的腹主动脉血,经离心(3 000 r/min)10 min后检测血清中FBG水平;实验结束后再次抽取大鼠8 mL的腹主动脉血,其中3 mL经Chemray240全自动生化分析仪检测各组大鼠血清中FBG、LDL-C、HDL-C、TG及TC水平(n=10),剩余5 mL用于后续ELISA实验及qRT-PCR实验。
2.4 大鼠口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)待取血后所有大鼠给予葡萄糖溶液(2 g/kg)灌胃,分别于15 min、0.5 h、1 h、2 h检测大鼠各时间点的血糖水平,根据梯形公式计算OGTT曲线下区域面积(AUC)。
2.5 ELISA法检测血清INS水平及血浆NUCB2、Ghrelin、Nesfatin-1水平将2.2所得3 mL静脉血样本一部分静置、离心(3 000 r/min)10 min后取上清液,使用ELISA检测试剂盒测定血清INS水平,另一部分进行枸橼酸钠抗凝,离心、取上清液,使用NUCB2、Ghrelin、Nesfatin-1 ELISA检测试剂盒测定血浆中各指标水平(n=10)。
2.6 qRT-PCR检测血浆Nesfatin-1、GHRL表达水平按照RNA提取试剂盒实验方法提取血浆样本中总RNA,以其为模板,按照50 μL的反应体系反转录成cDNA,根据NCBI网址中Nesfatin-1、Ghrelin序列设计引物(表1),以95 ℃、3 s,60 ℃、30 s,50次循环作为反应程序进行qRT-PCR扩增,Nesfatin-1、Ghrelin 均以 GAPDH 为内参,使用 2-ΔΔCt计算 Nesfatin-1、Ghrelin表达水平(重复5次)。

表1 实时荧光定量逆转录聚合酶链式反应(qRT-PCR)引物
2.7 统计学方法经SPSS 20.0分析,采用Shapiro-Wilk test(S-W检验)判定数据符合正态分布,使用±s描述,多组间比较使用单因素方差分析,多组间多时点比较采用重复测量方差分析,进一步两两比较采用SNK-q检验,P<0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠一般情况观察正常组大鼠粪便正常,皮毛光泽顺滑,行动灵活、精神状态良好;T2DM组大鼠出现便溏,精神不振、皮毛发黄粗糙;相较于T2DM组,利格列汀组、低剂量组、高剂量组大鼠上述症状存在不同程度改善。
3.2 糖肝煎对大鼠血清FBG、INS水平及OGTT曲线下区域面积(AUC)的影响相较于正常组,T2DM组大鼠灌胃前血清FBG水平显著增加(P<0.05),灌胃后血清FBG水平、OGTT AUC显著增加,INS水平显著降低(P<0.05);相较于T2DM组,利格列汀组、低剂量组、高剂量组FBG水平、OGTT AUC显著降低,INS水平显著增加;相较于低剂量组,高剂量组血清FBG水平、OGTT AUC显著降低,INS水平显著增加(P<0.05),见表2。
表2 糖肝煎对大鼠血清FBG、INS水平及OGTT AUC的影响/± s

表2 糖肝煎对大鼠血清FBG、INS水平及OGTT AUC的影响/± s
注:FBG为空腹血糖,INS为胰岛素,OGTT为口服葡萄糖耐量试验。①相较于正常组,P<0.05。②相较于T2DM组,P<0.05。③相较于低剂量组,P<0.05。
组别正常组T2DM组低剂量组高剂量组利格列汀组F值P值鼠数10 10 10 10 10 FBG/(mmol/L)灌胃前5.02±0.49 16.73±3.41①16.57±3.86①17.29±4.16①17.03±3.50①100.17(时间) ,56.69(组间),20.07(交互)<0.001(时间),<0.001(组间),<0.001(交互)灌胃后4.76±0.30 17.01±3.22①11.27±1.15①②7.04±0.48①②③6.30±0.71②③OGTT曲线下区域面积19.40±1.48 49.28±5.03①36.17±4.05①②23.80±2.73②③21.40±3.75②③121.27<0.001 INS/(pmol/L)26.04±1.58 5.60±1.11①10.43±1.23①②14.75±1.29①②③19.81±1.23①②③376.84<0.001
3.3 糖肝煎对大鼠摄食量、摄水量、尿量及体质量的影响相较于正常组,T2DM组大鼠摄食量、摄水量、尿量显著增加,体质量显著降低(P<0.05);相较于T2DM组,利格列汀组、低剂量组、高剂量组摄食量、摄水量、尿量显著降低,体质量显著增加(P<0.05);相较于低剂量组,高剂量组摄食量、摄水量、尿量显著降低,体质量显著增加(P<0.05),见表3。
表3 糖肝煎对大鼠摄食量、摄水量、尿量及体质量的影响/± s

表3 糖肝煎对大鼠摄食量、摄水量、尿量及体质量的影响/± s
注:①相较于正常组,P<0.05。②相较于T2DM组,P<0.05。③相较于低剂量组,P<0.05。
组别正常组T2DM组低剂量组高剂量组利格列汀组F值P值鼠数10 10 10 10 10摄食量/(g/12h)20.59±2.53 50.70±4.22①38.97±3.22①②27.25±4.01①②③25.20±3.43①②③119.31<0.001摄水量/(g/12h)34.03±2.75 240.92±28.34①201.20±10.12①②170.04±7.41①②③164.52±5.37①②③303.60<0.001尿量/(mL/12h)17.40±1.52 204.33±15.03①173.99±7.22①②148.10±6.27①②③140.05±8.24①②③655.98<0.001体质量/g 327.10±5.66 269.50±12.02①293.40±0.71①②310.50±10.02①②③307.35±1.04①②③83.49<0.001
3.4 糖肝煎对大鼠血脂水平的影响相较于正常组,T2DM组大鼠LDL-C、TG及TC水平显著增加,HDL-C水平显著降低(P<0.05);相较于T2DM组,利格列汀组、低剂量组、高剂量组LDL-C、TG及TC水平显著降低,HDL-C水平显著增加(P<0.05);相较于低剂量组,高剂量组LDL-C、TG及TC水平显著降低,HDL-C水平显著增加(P<0.05),见表4。
表4 糖肝煎对大鼠血脂水平的影响/(mmol/L,± s)

表4 糖肝煎对大鼠血脂水平的影响/(mmol/L,± s)
注:LDL-C为低密度脂蛋白胆固醇,TG为三酰甘油,TC为总胆固醇,HDL-C为高密度脂蛋白胆固醇。①相较于正常组,P<0.05。②相较于T2DM组,P<0.05。③相较于低剂量组,P<0.05。
组别正常组T2DM组低剂量组高剂量组利格列汀组F值P值鼠数10 10 10 10 10 LDL-C 0.71±0.02 2.39±0.04①1.94±0.22①②1.60±0.04①②③1.13±0.14①②③304.14<0.001 TG 0.78±0.08 2.14±0.11①1.71±0.12①②1.49±0.06①②③1.23±0.02①②③352.51<0.001 TC 1.21±0.05 4.01±0.40①3.11±0.31①②2.14±0.10①②③1.73±0.09①②③226.82<0.001 HDL-C 2.01±0.09 0.34±0.04①0.90±0.01①②1.27±0.12①②③1.73±0.04①②③852.23<0.001
3.5 糖肝煎对大鼠血浆NUCB2、Ghrelin、Nesfatin-1水平的影响相较于正常组,T2DM组大鼠血浆NUCB2、Nesfatin-1水平显著降低,Ghrelin水平显著增加(P<0.05);相较于T2DM组,利格列汀组、低剂量组、高剂量组血浆NUCB2、Nesfatin-1水平显著增加,Ghrelin水平显著降低(P<0.05);相较于低剂量组,高剂量组血浆NUCB2、Ghrelin、Nesfatin-1水平显著增加,Ghrelin水平显著降低(P<0.05),见表5。
表5 糖肝煎对大鼠血浆NUCB2、Ghrelin、Nesfatin-1水平的影响/(μg/L,± s)
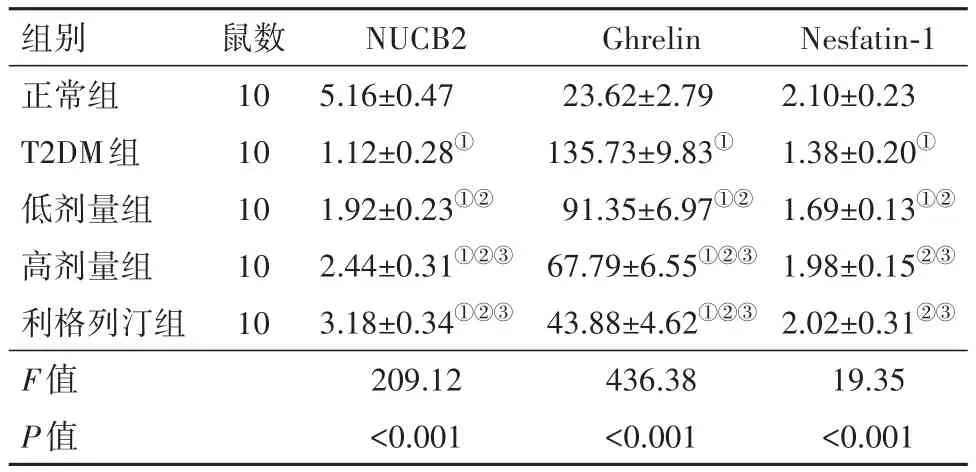
表5 糖肝煎对大鼠血浆NUCB2、Ghrelin、Nesfatin-1水平的影响/(μg/L,± s)
注:NUCB2为核连蛋白2,Nesfatin-1为摄食抑制因子1,Ghrelin为饥饿素。①相较于正常组,P<0.05。②相较于T2DM组,P<0.05。③相较于低剂量组,P<0.05。
组别正常组T2DM组低剂量组高剂量组利格列汀组F值P值鼠数10 10 10 10 10 NUCB2 5.16±0.47 1.12±0.28①1.92±0.23①②2.44±0.31①②③3.18±0.34①②③209.12<0.001 Ghrelin 23.62±2.79 135.73±9.83①91.35±6.97①②67.79±6.55①②③43.88±4.62①②③436.38<0.001 Nesfatin-1 2.10±0.23 1.38±0.20①1.69±0.13①②1.98±0.15②③2.02±0.31②③19.35<0.001
3.6 糖肝煎对大鼠血浆Nesfatin-1、Ghrelin mRNA水平的影响相较于正常组,T2DM组大鼠血浆Nesfatin-1表达水平显著降低,Ghrelin水平表达显著增加(P<0.05);相较于T2DM组,利格列汀组、低剂量组、高剂量组Nesfatin-1表达水平显著增加,Ghrelin表达水平显著降低(P<0.05);相较于低剂量组,高剂量组Nesfatin-1表达水平显著增加,Ghrelin表达水平显著降低(P<0.05),见表6。
表6 糖肝煎对大鼠血浆Ghrelin、Nesfatin-1 mRNA表达水平的影响/± s
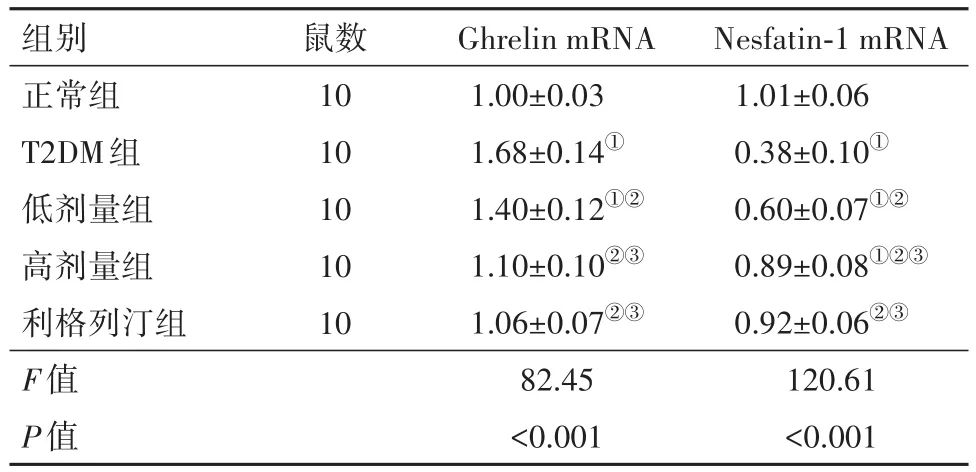
表6 糖肝煎对大鼠血浆Ghrelin、Nesfatin-1 mRNA表达水平的影响/± s
注:Ghrelin为饥饿素,Nesfatin-1为摄食抑制因子1。①相较于正常组,P<0.05。②相较于T2DM组,P<0.05。③相较于低剂量组,P<0.05。
组别正常组T2DM组低剂量组高剂量组利格列汀组F值P值鼠数10 10 10 10 10 Ghrelin mRNA 1.00±0.03 1.68±0.14①1.40±0.12①②1.10±0.10②③1.06±0.07②③82.45<0.001 Nesfatin-1 mRNA 1.01±0.06 0.38±0.10①0.60±0.07①②0.89±0.08①②③0.92±0.06②③120.61<0.001
4 讨论
T2DM作为一种由INS分泌受损或IR引起的慢性代谢性疾病,会导致体内脂肪、葡萄糖、蛋白质的代谢紊乱,而长期处于高血糖水平,会造成血管、心脏、肾脏、眼等器官或组织损伤[9-10]。随着人类生活方式及饮食的改变,由于高热量食物的大量摄入及运动的缺乏,导致T2DM的发病率逐渐增加[11],因此,深入了解其治疗机制意义重大。
在中医理论中,T2DM属消渴范畴,其发病特点为:燥热为标、阴虚为本,气虚、阴虚、阴阳均衰、脏腑虚损[5]。糖肝煎是一种由茯苓、白芍、茵陈、当归、柴胡等中草药组成的中药方剂,白芍及当归可活血养血,茯苓可健脾,柴胡可疏肝解郁,茵陈可清热利湿,合用具有清热利湿、疏肝健脾的功效[12-13]。糖肝煎已在临床上用于治疗慢性代谢性疾病,其对中医辨证为肝郁脾虚、湿热蕴结的T2DM合并脂肪肝患者具有较好的疗效[13]。有研究发现其可通过促进胰岛素受体底物(insulin receptor substrate,IRS)/磷脂 酰 肌 醇 3-激 酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路激活来改善T2DM合并非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)大鼠糖脂代谢[14]。糖肝煎可通过抑制氧化应激及炎症反应来改善T2DM大鼠NAFLD[12]。本研究造模后,模型大鼠FBG≥11.1 mmol/L,且出现三多一少症状表明造模成功,且低、高剂量糖肝煎可显著降低T2DM大鼠FBG水平、OGTT AUC、摄食量、摄水量、尿量、LDL-C、TG及TC水平,增加INS水平、体质量、HDL-C水平,并且随糖肝煎剂量的增加效果更加显著,该结果表明糖肝煎能够有效调节T2DM大鼠糖脂代谢及改善三多一少症状。
Nesfatin-1是由NUCB2水解所产生的具有82个氨基酸的肽,表达于下丘脑的特定区域,而分泌到胰岛β细胞、脂肪细胞等外周组织细胞中,具有调节摄食、葡萄糖代谢等功能[15]。研究发现,妊娠期糖尿病患者血清中Nesfatin-1水平显著降低,有作为预测妊娠期糖尿病生物标志物的潜能[16]。在糖尿病患者中Nesfatin-1循环水平显著降低,而注射Nesfatin-1可抑制肝脏葡萄糖形成,促进葡萄糖摄取。由于Nesfatin-1具有抗高血糖及抑制食欲的作用,可有效促进糖尿病及肥胖的治疗[17]。Ghrelin作为一种促食欲激素,可被存在于下丘脑、胰岛、垂体等组织中的生长激素促分泌素受体-1a(growth hormone secretagogue receptor,GHSR-1a)所识别,通过相互作用来刺激机体摄入食物[18]。Ghrelin与糖尿病等代谢疾病有关,其在糖尿病大鼠血浆中水平高于正常大鼠[18-20]。本研究发现,T2DM 大鼠血浆 NUCB2、Nesfatin-1水平显著降低,Ghrelin水平显著增加,与前人研究结果相似[17,20],而低、高剂量糖肝煎可显著增加T2DM大鼠血浆NUCB2、Nesfatin-1水平,降低Ghrelin水平,并且随糖肝煎剂量的增加效果更加显著,该结果表明,糖肝煎抑制T2DM大鼠摄食及调节糖脂代谢的作用可能与其促进Nesfatin-1表达及降低Ghrelin表达有关。
综上所述,糖肝煎可抑制T2DM大鼠摄食,增加其体质量及血浆Nesfatin-1水平,降低Ghrelin水平。本研究对糖肝煎在T2DM中详细作用机制的探究具有重要意义,但由于样本受限,目前未对其详细的通路机制进行探究,这将成为接下来的研究重点。

