胰高血糖素样肽1受体激动剂对阿霉素诱导大鼠心肌纤维化的作用
程晓洪,李家富,宋昕雨,陈俞瑾,王欢
心力衰竭(heart failure,HF)是各种心血管疾病的晚期阶段,其病死率、患病率逐年升高,严重威胁人类健康[1]。研究表明,心室重构引起的心肌结构和功能的改变是慢性心力衰竭发生发展的核心机制[2],其中心肌纤维化是心肌重塑过程中心功能由代偿转变为失代偿的重要环节[3],因此,深入研究心肌纤维化机制,寻找治疗心力衰竭的新靶点对保护心功能至关重要。胰高血糖素样肽1(GLP-1)是结肠和小肠远端的L细胞分泌的胃肠激素,通过刺激胰岛素分泌,抑制胰高血糖素的分泌和胃排空,从而降低餐后血糖[4]。GLP-1受体激动剂(GLP-1RA)是GLP-1的同源性近似物,不会被体内的二肽酰肽酶-4(DDP-4)快速降解,弥补了GLP-1的不足。除降糖效应,GLP-1还因能降低糖尿病患者的心血管事件风险而被广泛关注[5-7],且这种心血管的获益,在非糖尿病患者中也得到了证实[8]。度拉糖肽是美国礼来公司研发的新型长效GLP-1受体激动剂,其安全性和有效性已在随机对照研究中得到证实[9]。
阿霉素(doxorubicin,DOX)是一种高效的广谱抗癌药物,但是其可引起时间及剂量依赖性的心脏毒性,限制其在临床上的应用[10]。报道表明DOX致心力衰竭机制与其氧化应激损伤、心肌细胞代谢障碍、钙稳态紊乱和活化线粒体凋亡途径等有关[11],因此DOX致大鼠心力衰竭模型已经成为基础研究中方便可行的常用模型。本研究于2021年1—8月通过比较此模型从而探究GLP-1R激动剂改善阿霉素诱导心肌纤维化大鼠心室结构重构的保护作用及机制,且目前国内鲜见此类报道。
1 材料与方法
1.1 动物与主要试剂健康雄性SD大鼠40只,购自西南医科大学实验动物中心,动物许可证号SCXK(川)2018-0017,实验中充分保证动物福利、给予动物人道关怀,动物处置也符合伦理学原则。盐酸阿霉素(货号SD9280)、凝胶制备试剂盒(货号AS1012)、RIPA总蛋白裂解液(货号AS1004)、BCA蛋白质浓度测定试剂盒(货号AS1086)、ECL化学发光检测试剂盒(货号 AS1086)、Exendin(9-39)(货号 HY-P0264)均购自ASPEN公司,General cGMP ELISA Kit(货号ELK8144)、Rat GLP1 ELISA Kit(货号ELK8502)、Rat INS ELISA Kit(货号ELK2370)、Rat NT-ProBNP ELISA Kit(货号ELK8211)购自ELK Biotechnology公司,葡萄糖(Glu)测试盒说明书(货号F006-1-1)购自南京建成公司,GLP-1(货号D381211)购自vetter pharmafertigung Gmbh&co.KG公司。
1.2 主要仪器DYY-6C型电泳仪购自北京市六一仪器厂,TGL-16型冷冻离心机购自湖南湘仪实验室仪器开发有限公司,DR-200BS型酶标仪购自Diatek公司,GNP9160型恒温培养箱购自上海精宏实验设备有限公司,HH-W-600型水浴锅购自金坛市江南仪器厂,JT-12K型脱水机、JB-P5型包埋机购自武汉俊杰电子有限公司,RM2016型病理切片机购自上海徕卡仪器有限公司。
1.3 模型建立40只 SD大鼠适应性喂养1周后,按随机数字表法分为正常组(10只)和心肌纤维化模型组(30只),造模组用阿霉素3 mg/kg,每周3次,连续2周,累积18 mg/kg腹腔注射,4周后超声观察心脏结构与功能评估是否造模成功。成模后将心肌纤维化组采用随机数字表法分为阿霉素组(DOX组)、阿霉素+度拉糖肽组(GLP-1RA组)、阿霉素+度拉糖肽+Exendin(9-39)组(EX-9-39组),每组10只。随后GLP-1RA组予以度拉糖肽1 mg·kg-1·w-1皮下注射,连续 4周, EX-9-39组予以度拉糖肽 1 mg·kg-1·w-1皮下注射及 Ex9-39 200 μg·kg-1·d-1腹腔注射,连续4周,N组及DOX组予以等体积生理盐水皮下注射。记录末次体质量,予以5%水合氯醛 300 mg/kg腹腔注射麻醉大鼠,完善心脏超声后处死大鼠,取标本检测。
1.4 主要方法
1.4.1 心脏超声 将大鼠称重后用5%水合氯醛300 mg/kg腹腔注射,待大鼠进入麻醉状态后左侧胸前区备皮,取仰卧位,固定在鼠板上,由心脏超声科专科医师利用超声诊断系统,选取胸骨旁左室乳头肌短轴切面采集左室收缩末期内径(LVDs),左室舒张末期内径(LVDd),左心室缩短分数(FS)和左室射血分数(LVEF)。
1.4.2 组织标本检测 将取出的新鲜心肌组织固定于4%多聚甲醛中,脱水后包埋,修整好后制作成4 μm石蜡切片。HE染色观察心脏组织形态学变化,Masson染色观察心肌纤维化程度并计算心肌胶原容积分数(collagen volume fraction,CVF)。
1.4.3 蛋白质印迹法(Western blotting)测定蛋白水平 首先提取组织总蛋白;然后使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度,用SDS-PAGE分离蛋白后转PVDF膜;根据抗体说明书加入稀释后的一抗,4 ℃过夜;TBST洗膜3次,每次5 min;加入稀释好的二抗,室温孵育,摇床上洗4次,滴加新鲜配制的ECL混合溶液(A∶B=1∶1),暗室中曝光;将胶片进行扫描存档,AlphaEaseFC软件处理系统分析目标带的光密度值。
1.4.4 酶联免疫吸附试验(ELISA) 取血清后用离心机3 000 r/min离心15 min,收集上清液于1.5 mL EP管中,存于-80 ℃超低温冰箱,按照Elisa试剂盒检测NT-proBNP、GLP-1、血糖、胰岛素等指标,心肌组织取材后,速冻于-80 ℃保存,按照Elisa试剂盒检测cGMP。
1.5 统计学方法所有资料使用SPSS 17.0统计软件进行处理,所得到的数值以±s表示,多样本均数间的比较采用单因素方差分析,两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 GLP-1R激动剂对血糖及胰岛素的影响各组间血糖及胰岛素的浓度比较,均差异无统计学意义(P>0.05),见表1。
表1 胰高血糖素样肽1受体(GLP-1R)激动剂对大鼠血糖及胰岛素变化/± s

表1 胰高血糖素样肽1受体(GLP-1R)激动剂对大鼠血糖及胰岛素变化/± s
组别N组DOX组GLP-1RA组EX9-39组F值P值鼠数10 10 10 10血糖/(mmol/L)5.04±0.39 4.84±0.33 4.78±0.61 4.67±0.55 0.30 0.823胰岛素/(pmol/L)1 436.18±30.06 1 483.91±68.97 1 503.54±42.26 511.71±44.60 1.46 0.297
2.2 GLP-1R激动剂对心肌纤维化的影响
2.2.1 HE染色 N组心肌纤维染色均匀,排列整齐,走行正常,轮廓清晰,细胞核位于细胞中央,细胞间隙正常;DOX组心肌纤维着色不均,排列紊乱,轮廓不清,细胞核散乱分布;GLP-1RA组心肌排列较整齐,轮廓大致清晰;EX9-39组细胞排列、轮廓清晰程度介于DOX组与GLP-1RA组之间。见图1。
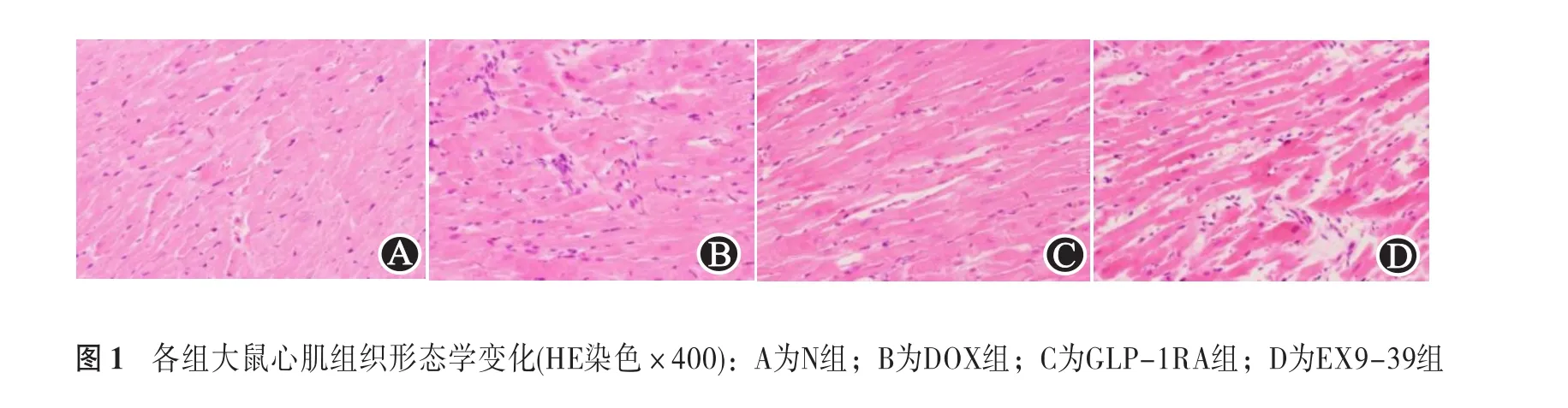
2.2.2 Masson染色 N组见极少胶原纤维沉积;DOX组可见大量胶原纤维沉积;GLP-1RA组胶原沉积较DOX组少;EX9-39组胶原沉积介于DOX组与DOX+GLP-1RA组之间。进一步行CVF分析,与N组[(0.3±0.05%)]相比,DOX组[(5.88±0.13)%]CVF明显升高(P<0.05);给予度拉糖肽治疗后,GLP-1RA组[(0.83±0.14)%]CVF下降(P<0.05);予以GLP-1RA拮抗剂后,exendin9-39组CVF升高(P<0.05)。见图2。

2.3 Western blotting测定大鼠心肌组织GLP-1R、SERCA2a、PLB、p-PLB、PKG、CaMKⅡ、p-RyR蛋白水平Western blotting结果显示与N组相比,DOX组 GLP-1R、PKG、SERCA2a、p-PLB 水平降低(P<0.05),PLB、p-RYR、CaMKⅡ水平升高(P<0.05);与DOX组相比,GLP-1RA组GLP-1R、PKG、SERCA2a、p-PLB水平升高(P<0.05),PLB、p-RYR、CaMKⅡ水平降低(P<0.05);与GLP-1RA组相比,EX9-39组GLP-IR、PKG、SERCA2a、p-PLB水平部分降低(P<0.05),PLB、p-RYR、CaMKⅡ水平升高(P<0.05),见表2;图3。

图3 大鼠心肌组织GLP-1R、SERCA2a、PLB、p-PLB、PKG、CaMKⅡ、p-RyR蛋白表达
表2 各组大鼠心肌组织GLP-1R、SERCA2a、PLB、p-PLB结果/± s

表2 各组大鼠心肌组织GLP-1R、SERCA2a、PLB、p-PLB结果/± s
注:GLP-1R为胰高血糖素样肽-1受体,SERCA2a为肌质网钙泵,PLB为受磷蛋白,p-PLB为磷酸化受磷蛋白,PKG为蛋白激酶G,CaMKⅡ为钙调蛋白激酶Ⅱ,p-RyR为磷酸化兰尼碱受体。①与N组比较,P<0.05。②与DOX组比较,P<0.05。③与GLP-1RA组比较,P<0.05。
组别N组DOX组GLP-1RA组EX9-39组F值P值鼠数10 10 10 10 GLP-1R 0.61±0.05 0.29±0.01①0.49±0.01②0.10±0.01③229.73<0.001 SERCA2 ATPase 0.72±0.06 0.06±0.01①0.41±0.04②0.20±0.16③193.81<0.001 P-PLB 0.42±0.05 0.06±0.01①0.32±0.08②0.19±0.02③31.58<0.001 PLB 0.10±0.01 0.66±0.04①0.17±0.03②0.37±0.04③187.08<0.001 PKG 0.70±0.07 0.10±0.02①0.40±0.01②0.20±0.02③162.36<0.001 p-CaMKⅡ0.05±0.01 0.60±0.04①0.16±0.05②0.29±0.01③161.99<0.001 p-RyR2 0.08±0.01 0.03±0.02①0.01±0.00②0.19±0.01③184.52<0.001
2.4 Elisa检测cGMP、GLP-1水平Elisa结果显示,与N组相比,DOX组cGMP、GLP-1有所下降(P<0.05);与DOX组相比,GLP-1RA组cGMP、GLP-1升高(P<0.05);与GLP-1RA组相比,EX9-39组cGMP、GLP-1部分下降(P<0.05)。见表3。
表3 各组大鼠环单磷酸鸟苷(cGMP)、胰高血糖素样肽-1(GLP-1)水平/± s

表3 各组大鼠环单磷酸鸟苷(cGMP)、胰高血糖素样肽-1(GLP-1)水平/± s
注:①与N组比较,P<0.05。②与DOX组比较,P<0.05。③与GLP-1RA组比较,P<0.05。
组别N组DOX组GLP-1RA组EX9-39组F值P值鼠数10 10 10 10 cGMP 3 011.70±279.34 1 281.95±110.86①2 247.14±231.04②1 721.72±109.05③42.69<0.001 GLP-1 357.64±50.89 194.67±24.58①691.97±77.99②269.18±37.64③54.03<0.001
2.5 对心功能的影响心脏超声结果显示,与N组相比,DOX组LVDs、LVDd、NT-proBNP明显上升,LVEF、FS降低(P<0.05);与DOX组相比,GLP-1RA组LVDs、LVDd、NT-proBNP降低 ,LVEF、FS升高(P<0.05);与GLP-1RA组相比,EX9-39组LVDs、LVDd、NT-proBNP上升,LVEF、FS值降低(P<0.05)。见表4;图4。
表4 各组大鼠心脏左室收缩末期内径(LVDs),左室舒张末期内径(LVDd)、左室射血分数(LVEF)及N端脑钠肽前体(NT-proBNP)比较/± s

表4 各组大鼠心脏左室收缩末期内径(LVDs),左室舒张末期内径(LVDd)、左室射血分数(LVEF)及N端脑钠肽前体(NT-proBNP)比较/± s
注:①与N组比较,P<0.05。②与DOX组比较,P<0.05。③与GLP-1RA组比较,P<0.05。
组别N组DOX组GLP-1RA组EX9-39组F值P值鼠数10 10 10 10 LVDd/mm 3.82±0.29 6.00±0.52①4.60±0.21②5.53±0.12③27.77<0.001 LVDs/mm 2.45±0.34 4.00±0.34①2.99±0.06②3.55±0.66③22.76<0.001 LVEF 84.33±4.04 68.33±1.53①81.00±3.61②74.00±2.00③17.26 0.001 NT-proBNP/(ng/L)0.13±0.03 0.99±0.07①0.34±0.06②0.60±0.05③144.44<0.001
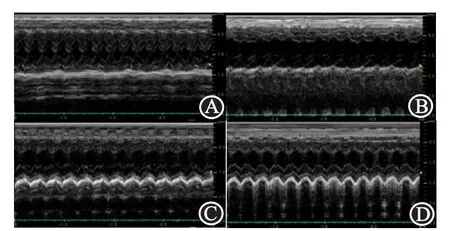
图4 各组大鼠心脏超声图:A为N组;B为DOX组;C为GLP-1RA组;D为EX9-39组
2.6 GLP-IR对各组心质量/体质量(HW/BW)的影响结果显示,与N组相比,DOX组HW/BW明显上升(P<0.05);与DOX组相比,GLP-1RA组HW/BW降低(P<0.05);与GLP-1RA组相比,EX9-39组HW/BW有所上升(P<0.05),见表5。
表5 各组大鼠心质量(BW)、体质量(HW)、心质量/体质量(HW/BW)比较/± s

表5 各组大鼠心质量(BW)、体质量(HW)、心质量/体质量(HW/BW)比较/± s
注:①与N组比较,P<0.05。②与DOX组比较,P<0.05。③与GLP-1RA组比较,P<0.05。
组别N组DOX组GLP-1RA组EX9-39组F值P值鼠数10 10 10 10 BW/g 433.00±29.31 295.33±44.66 348.67±20.84 326.33±20.26 11.29 0.003 HW/mg 1 091.67±242.41 1 172.67±101.30 1 122.33±93.04 1 222.33±98.56 0.45 0.722 HW/BW/(mg/g)2.50±0.40 4.00±0.34①3.22±0.11②3.74±0.68③17.69 0.001
3 讨论
本研究采用超声评估心脏结构及功能,结果表明,度拉糖肽治疗后可使大鼠心室腔缩小、心功能改善、NT-proBNP有所下降,Exendin9-39作为一级竞争性GLP-1受体拮抗剂,部分抑制了度拉糖肽的保护作用,这表明GLP-1R激动剂可在一定程度上通过改善射血功能、心脏收缩及舒张功能参与心室重构,结合度拉糖肽治疗后可上GLP-1及GLP-1R,而同时予以度拉糖肽及Exendin9-39则降低了GLP-1、GLP-1R的表达,这更加进一步表明GLP-1R激动剂可能通过GLP-1R参与了心室重构的过程。
研究表明,正常情况下,GLP-1刺激胰岛素分泌是依赖血糖浓度的,随着血糖浓度降低,GLP-1促胰岛素分泌作用降低,当该作用降低到一定阈值时GLP-1不显示活性[12],而本实验中,各组间血糖及胰岛素未见明显改变,这也表明GLP-1R的降糖效应具有葡萄糖依赖性,符合既往研究规律。
心肌重构是指心脏为适应各种负荷增加,在结构及功能上发生适应性代偿改变,长期持续高负荷最终失代偿引起心力衰竭,表现为心肌肥厚、心肌纤维化、间质细胞增生等改变[13]。生理情况下,Ⅰ、Ⅲ型胶原纤维构成心肌胶原网络支架,在保护心肌细胞、维持心脏几何构型和僵硬度等方面起着十分重要的作用[14],心肌纤维化是指Ⅰ、Ⅲ型胶原纤维沉积,导致心室壁僵硬度增加从而影响心脏功能。本研究中,与正常组相比,阿霉素组心质量/体质量比明显升高,Masson染色显示阿霉素组大量胶原纤维沉积,CVF高,心肌纤维化严重,予以度拉糖肽治疗后可改善心肌细胞肥厚以及心肌纤维化程度,这表明GLP-1R激动剂一定程度上能改善心室重构,而同时予以度拉糖肽和Exendin9-39则部分拮抗了度拉糖肽作用,这更加说明了GLP-1R激动剂至少部分是通过GLP-1R发挥作用的。
钙循环紊乱是心衰后的主要特征,可同时降低心脏收缩及舒张功能,同样影响心脏重构,增加心律失常的风险[15]。心衰时兴奋收缩偶联受损,特别是SERCA2a表达降低,导致钙离子增高,肌质网钙容量降低,同时CaMKⅡ磷酸化增加,钙渗漏的增加[16],上述变化综合使钙瞬变幅值降低,降低心肌收缩力。Western blotting结果显示度拉糖肽可上调PKG、SERCA2a、p-PLB水平,而降低PLB、p-RYR、p-CaMKⅡ,结合Elisa结果,度拉糖肽可使cGMP升高,可以推测GLP-1R激动剂可能通过增加SERCA2a表达,增加PLB的磷酸化而减少PLB对SERCA2a功能的抑制作用,同时减少磷酸化的CaMKⅡ蛋白表达,参与细胞钙循环的调节。且既往研究表明,GLP-1R激动剂可在大鼠肺动脉平滑肌细胞中可激cGMPPKG[17],提示 cGMP-PKG 是 GLP-1R 的下游信号通路,而PKG信号通路通过调节SERCA2a表达与钙循环密切相关,同时,PKG信号通路通过降低CaMKⅡ的磷酸化水平,影响下游的调节位点,降低RYR磷酸化,结合本研究各组PKG、cGMP变化,我们可以合理推测GLP-1R激动剂可参与钙循环的调节可能与cGMP-PKG信号通路有关。
综上所述,GLP-1R激动剂在不影响血糖情况下,可以改善心肌纤维化、缓解心肌肥厚,从而逆转心室重构,其保护作用可能与cGMP-PKG通路有关,这为心衰的治疗提供了新思路。

