反式和顺式二苯乙烯苷在大鼠体内的药代动力学比较研究*
柴士伟,高建,厍立鹤,于俏,庞旭,韩立峰
(1.天津中医药大学第一附属医院,天津 300193;2.国家中医针灸临床医学研究中心,天津 300193;3.天津市中药化学与分析重点实验室,天津 301617)
何首乌为蓼科植物何首乌(Polygonum multiflorum Thunb.)的干燥块根,味苦,归肝、心和肾经[1]。现代研究表明,2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(二苯乙烯苷,TSG)是何首乌的主要活性成分[2],中国药典在2000年将其作为何首乌的定量指标,一直沿用至今[3]。现代药理研究发现:该化合物具有抗炎[4-5]、抗衰老[6]、抗氧化[7]、抗动脉粥样硬化[8]、保肝[9-10]和抗肿瘤[11]等多种生物活性。由结构可知,TSG具有反式和顺式两种构型[12],反式二苯乙烯苷(trans-TSG)可以在光异构的作用下转变为顺式二苯乙烯苷(cis-TSG)。有文献报道cis-TSG可能是何首乌造成肝损伤的潜在毒性成分[13],而trans-TSG目前为止未见任何肝毒性报道。由于trans-/cis-TSG的结构可以相互转变,而体内安全性差异显著,因此它们是否会表现出不同的体内药代动力学行为,值得进一步研究。前期已有文献报道trans-/cis-TSG的药代动力学参数,但主要是以中药制剂和提取物为主[14-15],而这些制剂中的其他成分可能会对trans-/cis-TSG的体内药代动力学行为产生影响。因此,本实验以trans-/cis-TSG单体化合物为研究对象,建立了超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法,考察了单次给药后,trans-/cis-TSG在大鼠体内的药代动力学行为,为后续何首乌致肝损伤物质基础及作用机制研究提供参考依据。
1 实验材料
1.1 实验动物 12只雄性SD大鼠(200±20)g,购自北京维通利华生物科技股份有限公司,实验动物许可证号为SCXK(京)2016-0011,实验已通过天津中医药大学伦理委员会批准,伦理审批编号为TCM-LAEC2021151。
1.2 药品与试剂 trans-TSG(纯度,HPLC面积归一化法:99.13%),cis-TSG(纯度,HPLC 面积归一化法:100%)为实验室自制,虎杖苷(上海源叶生物科技有限公司,ZM0530LA14,HPLC≥98%)。色谱乙腈、色谱甲醇(Thermo Fisher Scientific,美国),色谱甲酸(Anaqua Chemicals Supply,美国)。
1.3 仪器 Acquity H-Class UPLC超高效液相色谱系统和Xevo TQ-S质谱系统联用仪(Waters,美国);KQ-1000DE数控超声波清洗器(昆山市超声仪器有限公司);XW-80A型涡旋混合器(上海沪西分析仪器厂);微量移液器(Eppendorf,德国);Centrifuge冷冻台式高速离心机(Eppendorf,德国);BP121S型天平(Sartorius,德国);Millipore纯水器(Millipore,美国)。
2 实验方法
2.1 色谱条件 色谱柱为ACQUITY UPLC BEH C18Column(2.1 mm×50 mm,1.7 μm,Waters,美国)。乙腈(A)和 0.1%甲酸水(B)作为流动相,梯度洗脱,0~8 min,5%~45%B。柱温设置为30℃,进样体积为3 μL,流速为 0.3 mL/min。
2.2 质谱条件 负离子模式下,仪器方法的毛细管电压、锥孔电压和去溶剂化温度分别设置为2.5 kV,30 V和650℃;氮气作为去溶剂气体,流速设置为800 L/h;多反应监测(MRM)模式和其他关键参数设置如表1所示,基于Masslynx 4.1和TargetLynx软件,同时采集和分析大鼠血浆中trans-TSG和cis-TSG的定量信息。

表1 目标化合物的MRM参数Tab.1 MRM parameters of the target compounds
2.3 动物分组和给药 12只大鼠随机分为两组,trans-TSG组和cis-TSG组,每组6只。严格按照天津中医药大学动物中心管理规范饲养,在室温(20±5)℃,相对湿度55%~65%,通风良好,环境安静,定期消毒的环境下适应性饲养一周,期间自由饮水和饮食。分别单次给药60 mg/kg的trans-TSG和cis-TSG[16],在给药后按照时间点:0,0.033,0.083,0.17,0.25,0.33,0.5,1,2,4,8,10,24 h,眼眶内眦取血,取至预先加入 10 μL肝素钠(100单位)的 1.5 mL离心管中,4 ℃离心 10 min(6 600×g),取上层血浆于-80℃冰箱冷冻保存。
2.4 血浆样本的处理 取出-80℃冰箱冷冻保存的大鼠血浆样品各100 μL,于4℃环境下解冻,分别加入600 μL冰甲醇和10 μL的内标溶液,涡旋震荡5 min,4 ℃下离心 20 min(13 200×g),取出上清,氮吹干。加入100 μL 50%的甲醇水溶液复溶,涡旋震荡 5 min,4 ℃下离心 20 min(13 200×g),取出上清,待测。
2.5 对照品溶液的配制 精确称量trans-TSG、cis-TSG和虎杖苷(内标)各1 mg分别溶解于1 mL的甲醇溶液中得1 mg/mL的溶液,然后用甲醇分别进行稀释得10 μg/mL的trans-TSG、cis-TSG和虎杖苷储备液。
2.6 统计学方法 trans-TSG、cis-TSG的药代动力学参数使用DAS药代动力学软件(版本1.0,中国药理学会,中国)进行计算。将数据导入graphpad prism 8.0进行分析,计算结果使用均数±标准差(±s)表示,组间比较采用独立样本t检验,相关分析采用线性相关与回归分析,P<0.05为差异有统计学意义。
2.7 方法学考察
2.7.1 专属性 按照“1.2.4血浆样本的处理”项下的实验方法对空白血浆(A)、空白血浆加入对照品溶液及内标溶液(B)和血浆样品加入内标溶液(C)进行分析。分别得到空白血浆色谱图、血浆对照品色谱图和血浆样品色谱图。
2.7.2 线性关系 精密吸取适量浓度为10 μg/mL的trans-TSG、cis-TSG储备液,加入适量甲醇,cis-TSG 分别稀释为 3.90,7.81,15.62,31.25,62.5,125,250,500,1 000和2 000 ng/mL一系列对照品溶液;trans-TSG 稀释浓度为 1.95,3.90,7.81,15.62,31.25,62.5,125,250,500 和 1 000 ng/mL 一系列对照品溶液。分别吸取上述对照品溶液100 μL,氮气吹干溶剂,加入 100 μL 空白血浆,按“1.2.4 血浆样本的处理”项下操作,然后进样分析。纵坐标表示标准品峰面积与内标峰峰面积比值,横坐标表示标准品浓度,绘制回归曲线,计算得线性回归方程。
2.7.3 日内和日间精密度 各取空白血浆100 μL按照“1.2.4 血浆样本的处理”项下的制备方法,配制“表3”中低、中、高3个浓度水平的混合标准品血浆样品。日内精密度即测定低、中、高3个浓度水平的混合标准品血浆样品,水平重复6次。日间精密度即连续3 d测定“日内精密度的样品”,根据随行标准曲线来确定浓度。计算相对标准偏差(RSD),并用测定浓度和已知浓度的百分比来评价准确度。
2.7.4 提取回收率和基质效应 配制低、中、高质量浓度的 trans-TSG(10、100和 1600 ng/mL)和 cis-TSG(5、50 和 800 ng/mL)的标准溶液,各取 100 μL,平行6份,分别加入10 μL内标溶液和100 μL空白血浆,样品预处理后测定,所得峰面积结果记为A;另取同样份数的空白血浆,加入10 μL内标溶液,经样品前处理后测定,所得峰面积结果记为B;准备高、中、低3个浓度的标准溶液各100 μL,平行6份,分别加入10 μL内标溶液,氮吹干后,用100 μL 50%甲醇复溶,所得峰面积结果记为C。A/B×100%为提取回收率,A/C×100%为基质效应。
2.7.5 稳定性 按照“1.2.4血浆样本的处理”项下制备方法,制备的低、中、高3个浓度水平的标准品血浆样品,分别考察其稳定性。稳定性评价包括样品盘内24 h稳定性、3次冻融循环稳定性。
3 结果
3.1 方法学验证
3.1.1 专属性 空白血浆色谱图(A),血浆对照品色谱图(B),血浆样品色谱图(C),如图1所示,结果表明样品色谱峰不受溶剂和内标的干扰,专属性良好。

图1 MRM模式下大鼠血浆中目标化合物的专属性色谱图Fig.1 Specificity chromatogram of the target compounds in rat plasma with the MRM mode
3.1.2 线性关系 目标分析化合物的线性回归方程、相关系数和线性范围如表2所示。结果表明,大鼠血浆中trans-TSG在3.90~2 000 ng/mL的范围内线性关系良好,cis-TSG在1.95~1 000 ng/mL的范围内线性关系良好。

表2 目标化合物的线性回归方程、相关系数和线性范围Tab.2 Linear regression equation,correlation coefficient and linear range of the target compounds
3.1.3 精密度和准确度 trans-TSG和cis-TSG的低、中、高3个浓度的日内精密度和日间精密度结果如表3所示,RSD值均小于12%,准确度在87.3~101.2,表明所建方法的精密度和准确度良好。

表3 目标化合物的精密度和准确度Tab.3 Precision and accuracy of the target compounds
3.1.4 提取回收率和基质效应 实验结果如表4所示,trans-TSG低、中、高3个浓度的平均回收率分别为91.7%、94.1%和92.2%;cis-TSG的低、中、高3个浓度的平均回收率分别为97.1%、90.1%和95.3%。两者的各个浓度的平均提取回收率均大于91%,且RSD均小于4.7%,表明trans-TSG和cis-TSG的回收率较高。

表4 提取回收率和基质效应Tab.4 Recovery and matrix effect
3.1.5 稳定性 trans-TSG和cis-TSG在样品盘放置24 h后以及3次冻融循环之后进行处理的状态下,低、中、高3个浓度的测定结果如图表5所示,显示出良好的稳定性。

表5 稳定性考察Tab.5 Study on the stability of the target compounds
3.2 血药浓度-时间曲线 如图2所示,大鼠单次灌胃60 mg/kg的trans-TSG和cis-TSG后,cis-TSG的血药浓度高于trans-TSG。
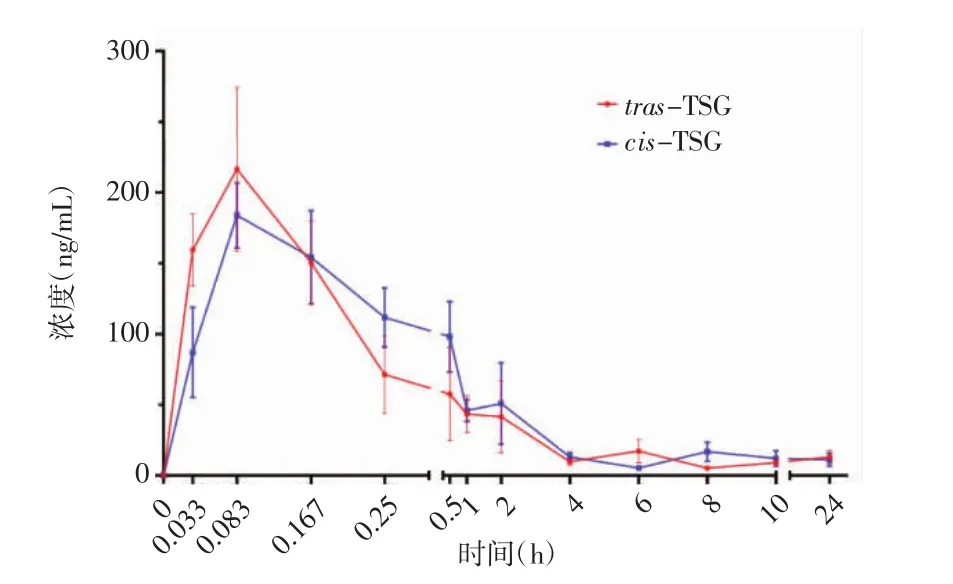
图2 trans-TSG和cis-TSG的血药浓度-时间曲线Fig.2 Plasma concentration time curves of trans-TSG and cis-TSG
3.3 药代动力学参数 trans-TSG和cis-TSG药代动力学参数使用DAS药代动力学软件进行计算,符合一室模型,分析所得的药-时曲线如图2所示,药代动力学参数如表6所示,单次给药trans-TSG和cis-TSG 后,cis-TSG 在大鼠体内的 AUC0-t、AUC0-∞和Tmax均大于trans-TSG,但无统计学差异。cis-TSG在大鼠体内的半衰期(T1/2)显著大于trans-TSG(P<0.05)。而 trans-TSG 在大鼠体内的达峰浓度(Cmax)和清除率(CLz/F)则显著高于 cis-TSG(P<0.05)。

表6 大鼠单次灌胃trans-TSG和cis-TSG的药代动力学参数(n=6)Tab.6 Pharmacokinetic parameters of trans-TSG and cis-TSG(n=6)
4 讨论
具有顺反结构的化合物,在一定条件下可以实现相互转化。顺反异构化过程及其机制,通常包括光异构化[17]、热致异构化[18]和催化异构化[19]。而何首乌中trans-TSG向cis-TSG的转化属于光致异构化。一般来说,对于热力学稳定的二苯乙烯类的反式结构,通过加热条件是难以实现构型转换,但在光照射下,反式异构体易转变为顺式异构体[20]。同时,二苯乙烯苷是多酚类化合物,意味着很容易发生氧化反应,因此二苯乙烯苷的降解除了可以通过光和热的条件而引发之外,氧气和碱性pH条件也应该格外注意[21]。因此,本研究在实验操作过程中全程避光,所配制的溶液也存放在低温避光环境,避免了trans-TSG和cis-TSG的相互转化。同时,由于trans-TSG和cis-TSG的质谱碎裂方式相同,因此,在提取离子流色谱图时,如果发生体内转化,将会同时出现trans-/cis-TSG的色谱峰,但在本研究中,未发现有转化现象(图1C)。
单次灌胃给药相同剂量的trans-TSG和cis-TSG后,cis-TSG在大鼠的AUC0-t大于trans-TSG,但未发现显著性差异(P>0.05)。trans-TSG 在大鼠体内的 Cmax和 CLz/F 均显著高于 cis-TSG(P<0.05),同时cis-TSG在大鼠体内的达峰时间(Tmax)和半衰期(T1/2)均大于trans-TSG,其中T1/2约为trans-TSG的4.4 倍,具有统计学差异(P<0.05)。以上结果表明,cis-TSG在大鼠体内的暴露量高于trans-TSG,并且具有更低的清除率和较长的半衰期(P<0.05),这表明cis-TSG在大鼠体内更容易出现蓄积,而有研究发现cis-TSG可能是何首乌中潜在的肝损伤风险成分[22],这是否与cis-TSG在体内的蓄积有关,值得进一步的研究。
综上所述,本研究建立了UPLC-MS/MS分析方法,研究比较了何首乌中trans-TSG和cis-TSG在大鼠体内的药代动力学行为,为后续trans-/cis-TSG的进一步研究提供参考依据。

