TEVAR后移植物感染合并主动脉食管瘘的外科治疗
刘彬,冯海,李晨宇,高翔,刘明远,陈学明
(首都医科大学附属北京友谊医院 血管外科,北京 100050)
主动脉食管瘘(aortoesophageal fistulas,AEF)是一种相对罕见的疾病,通常危及生命[1-3]。原发性AEF 的病因包括胸主动脉瘤、异物损伤、食管恶性肿瘤等[4-5],而继发性AEF 的病因包括主动脉弓置换术、胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)和食管手术等[6-7]。TEVAR 作为对胸主动脉瘤和夹层患者的一种微创治疗方法,近年来已在临床中广泛开展。TEVAR 后继发性AEF 的确切机制尚不清楚,一些报道[8-10]认为其发病机制与支架压迫继发的食管缺血、覆盖营养血管以及支架移植物感染有关。而由于纵隔感染、粘连以及患者的一般状况较差,TEVAR 后继发性AEF 的治疗更具挑战性[11-12]。由于该疾病的罕见性,目前尚无大型的多中心研究报告各种治疗策略对继发性AEF 的疗效,其最佳治疗策略仍然存在争议。本研究的目的是分享笔者在该疾病的治疗方式和结果,尝试建立一种包括解剖外主动脉转流、移植物去除和食管瘘旷置在内的手术策略。
1 资料与方法
1.1 临床资料
回顾性分析2018—2021 年间在首都医科大学附属北京友谊医院接受治疗的7 例TEVAR 术后继发性AEF 合并移植物感染患者的临床资料。诊断基于增强CT、电子胃镜检查和PET-CT。入院即给予肠外营养支持、经验性使用抗生素,并依据血培养及分泌物培养结果作出相关调整。患者均为男性,平均年龄51.7 岁(36~67 岁)。7 例患者既往均接受过TEVAR 治疗,距前次TEVAR 平均间隔6.3 年(3 个月至11 年)。所有患者否认食管肿瘤或食管手术史,均合并发热症状。2 例(28.6%)检出致病菌,1 例检出屎肠球菌、嗜麦芽假单胞菌,1 例检出肺炎克雷伯菌。入院即经验性应用抗生素至出院,抗感染治疗随细菌学检查及治疗进程调整,出院后继续口服抗生素12 周。所有7 例患者增强CT 均显示主动脉和食管之间有气体影。4 例患者(57.1%)行消化内镜检查以进一步明确诊断,均可见瘘口,1 例可于瘘口内见金属样异物。2 例患者行PET-CT 检查提示:胸主动脉及降主动脉支架术后,管壁周围代谢异常增高,考虑感染灶可能(图1)。
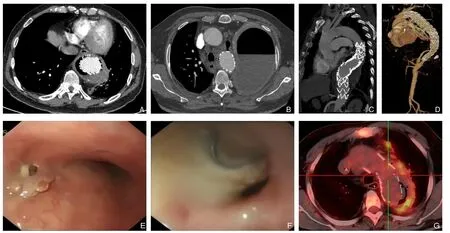
图1 术前检查资料 A-B:增强CT显示支架移植物周围与食管间气体影;C-D:术前CTA;E-F:消化内镜检查显示支架及感染灶;G:术前PET-CT显示主动脉与食管间代谢异常增高Figure 1 Data of preoperative examinations A-B: The enhanced CT scan demonstrating air bubbles between the stent-graft and the esophagus;C-D: Preoperative CTA;E-F: Endoscopic view showing exposure of the stent and infection lesion;G: Preoperative PET-CT demonstrating an abnormal enhancement between the aorta and esophagus
1.2 治疗策略
因患者移植物感染合并食管瘘,手术方案不考虑单纯行TEVAR 治疗,而采取非体外循环下升主动脉-腹主动脉解剖外人工血管旁路术、感染移植物及感染灶切除术、食管瘘口旷置引流术。部分血流动力学不稳定的患者急诊行TEVAR,待调整患者一般状态后择期施行开放手术。手术方式:全麻非体外循环下分步手术,第1 步:平卧位,取胸部正中切口显露升主动脉近端,后取腹部正中切口显露腹主动脉远端,全身肝素化后(1 mg/kg),以阻断钳钳夹升主动脉及腹主动脉侧壁,选取16 mm×35 cm 涤纶人造血管(BARD,德国),将人工血管近端与升主动脉行端侧吻合,远端与腹主动脉行端侧吻合(图2A)。第2 步:取右侧卧位,选取左胸前外侧第四肋间切口,剪断第5、6、7 肋骨,探查可见主动脉周围脓性分泌物(图2B),肺表面脓性纤维条索,主动脉表面灰白色改变,与周围粘连紧密。阻断钳分别阻断近、远端后,切开主动脉,取出近端支架移植物(图2C),依次缝扎胸主动脉近端与远端。第3 步:将食管周围粘连主动脉瘤腔剖开,于食管瘘附近,将主动脉壁缝合成袋状,并置入“蘑菇头”引流管1 根于环缩处(图2D),另于纵隔病灶感染处留置引流管1 根。急诊行TEVAR 的3 例患者,目的为控制呕血以获得血流动力学稳定,择期施行开放手术治疗。
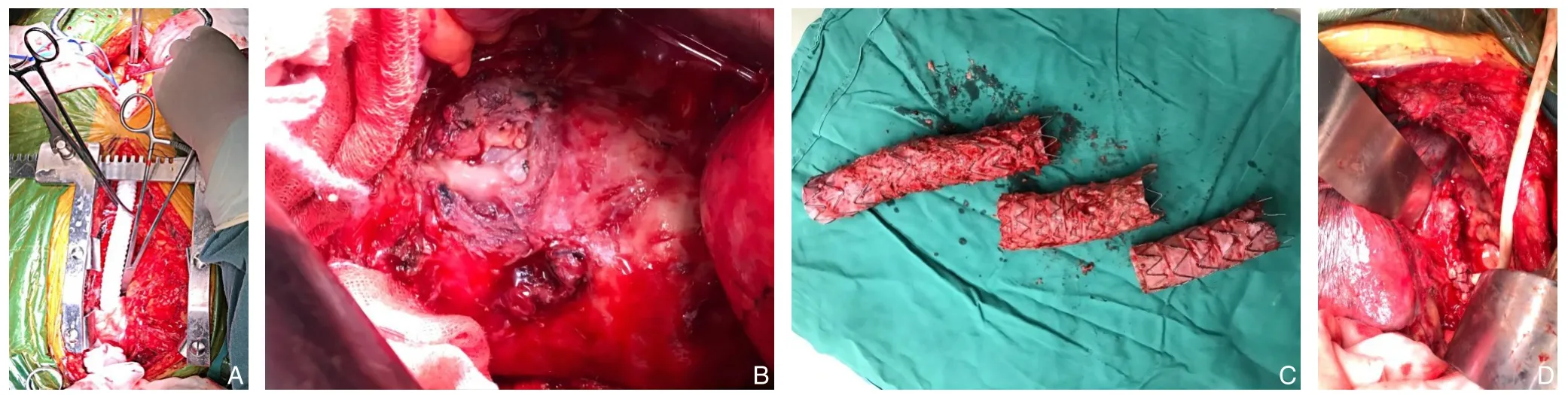
图2 术中照片 A:升主动脉-腹主动脉解剖外人工血管旁路术;B:主动脉周围脓性分泌物;C:取出感染支架移植物;D:食管瘘周围引流Figure 2 Intraoperative pictures A: Extra-anatomical bypass from ascending aorta to abdominal aorta;B: Periaortic purulent secretions;C: The removed infected stent-graft;D: Drainage of the oesophageal fistula
1.3 随访及转归
评估了围术期和晚期病死率、死亡原因、主要不良主动脉事件和感染复发。根据这些结果考虑开放手术治疗策略的可行性。
2 结果
病例1、病例2 接受了开放手术治疗,即:升主动脉-腹主动脉解剖外人工血管旁路术、感染移植物及感染灶切除术、食管瘘口旷置引流术。术后1 周复查胃镜并放置空肠营养管,分别于术后39 d 及67 d 复查胃镜示原瘘口闭合(图3A-B),后进食流食。出院前复查主动脉CTA(图3C-D),住院时间79 d、97 d。病例3 行开放手术治疗,术后80 d 左侧胸腔引流管红色血性液约800 mL,行主动脉造影及食管造影,未见主动脉残端及原食管瘘口造影剂外渗(图3E-F),术后95 d 咯血200 mL、胸引600 mL,抢救无效死亡。考虑患者胸腔感染严重侵蚀左肺组织,致血管破裂死亡。病例4 亦接受了手术治疗,因左侧胸腔严重粘连而无法有效切除感染灶,术后病情严重恶化,围术期死于感染中毒性休克。病例5 入院后血流动力学不稳定,急诊行TEVAR,后于第5 天行开放手术治疗,围术期死于弥散性血管内凝血。病例6、病例7 入院均病情危重,血流动力学不稳定,急诊行TEVAR,后1 例围术期再次呕血后死亡,1 例术后第2 天死于感染中毒性休克。此7 例患者,施行开放手术的患者病死率为60%,施行TEVAR 的患者病死率为100%。表1 总结了患者特征、手术策略和转归。
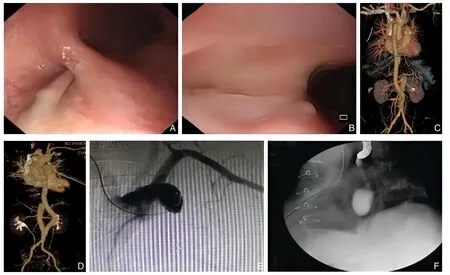
图3 术后资料 A-B:术后复查胃镜示瘘口愈合;C-D:术后复查CTA;E-F:主动脉及食管造影Figure 3 Postoperative data A-B: Postoperative review of gastroscopy showing the healing of the fistula;C-D: Postoperative CTA;E-F: Aortic and esophageal angiography
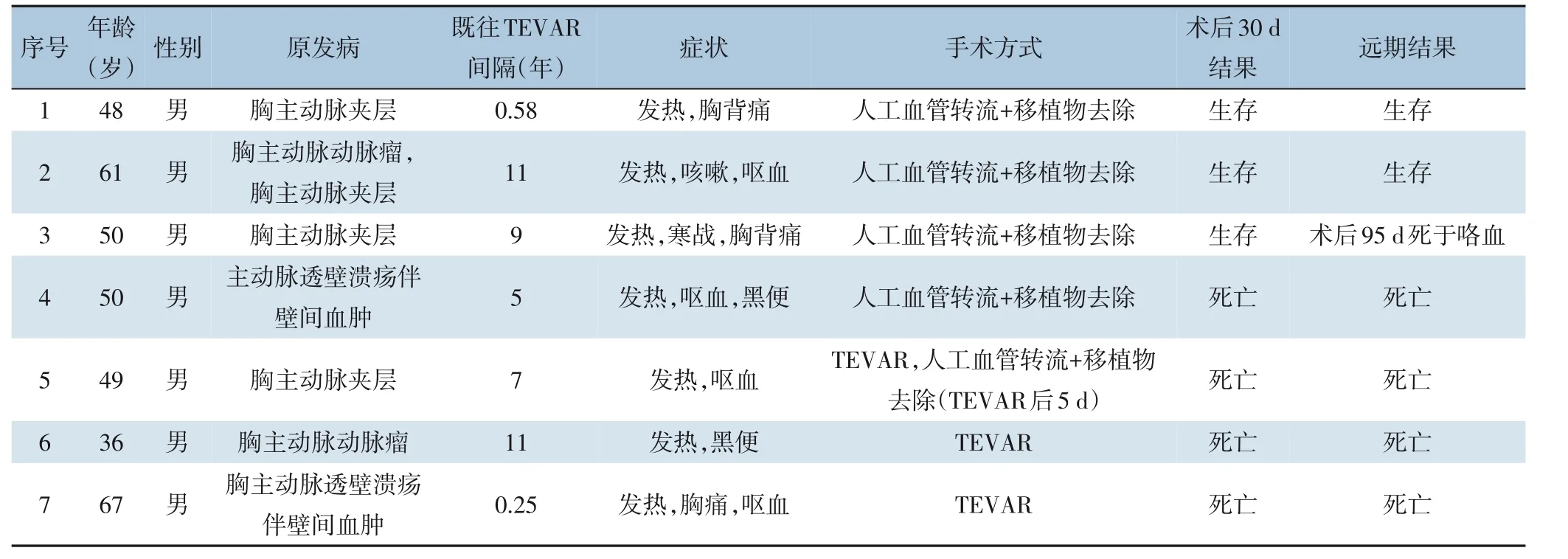
表1 7例患者的特征、手术策略和转归Table 1 Clinical characteristics,surgical strategies and outcomes of the 7 patients
3 讨论
AEF 合并移植物感染是TEVAR 术后极为严重的并发症,主要症状是呕血、发热或休克(败血症或出血性),延误治疗会产生灾难性的后果。TEVAR 后继发性AEF 较罕见,发生率为1.5%~5%[6,8,10,12-13],因此目前还没有既定的和普遍接受的治疗策略。在以往的研究[6,8]中,单纯给予抗感染治疗,患者1 年病死率为100%,即使有充分的手术治疗,围手术期的病死率也在57%~64%之间。
综合文献[14-19]复习,手术治疗方案大致分为4 类,即:TEVAR,食管支架治疗,孤立的食管切除术以及主动脉重建联合二期食管重建术。
TEVAR 的创伤性较小,对AEF 的处理在紧急情况下是可行的,然而它不能修复食管的瘘口。使用覆膜支架隔绝感染瘘口会导致覆膜支架感染,导致感染灶范围增加或患者感染加重[20-21]。Antoniou 等[22]对41 例AEF 患者的系统评价指出,TEVAR 治疗的AEF 患者中有44%出现复发或新发感染,并发症发生率明显增高,总生存期缩短。在本研究患者中,有2 例患者因病情危重单纯施行了TEVAR 治疗,拟待病情好转后施行手术。后其中1 例患者死于呕血,1 例死于感染中毒性休克。虽然以上2 例患者都进行了积极的抗感染、营养支持治疗,病情仍加重最终死亡。这在一定程度上佐证,单纯行TEVAR 无法使该疾病患者获得良好的预后。笔者认为可以将其作为一种桥接治疗,尝试以微创方式控制出血,为之后的开放手术争取纠正患者一般状况的时间。也有学者尝试通过内镜下钳夹及放置自膨式食管支架以促进食管的愈合和防止再出血,但最终所有患者仍死于再次出血[23]。而对于采用孤立的食管切除术治疗AEF,有报道[6,24]称1 年生存率为25%和0%。
已发表的报告[25]证实,通过置入主动脉或食管内支架,控制再出血的治疗并不能获得满意的结果,这表面有必要采取更积极的手术策略以改善预后,包括食管切除和移植物置换。有个案报道[26]通过一期行部分食管、感染假体切除,二期再进行食管重建的成功案例。也有报道[27-28]建议分阶段手术治疗AEF,将TEVAR 作为第一阶段的“过渡疗法”,待患者病情稳定后,施行食管次全切除术和纵隔清创术,第二阶段进行主动脉原位重建,然后在几个月后进行第三阶段的食管重建。
到目前为止,继发于TEVAR 的AEF 形成的确切病理生理学机制尚不清楚,多数学者认为可能与支架压迫、覆盖营养血管以及支架移植物感染有关。而食管重建手术增加了手术创伤,如果术前患者病情不稳定,应避免食管重建与主动脉重建手术同时进行[5]。笔者中心进行开放手术治疗的患者,考虑患者一般状况差,未行食管切除、重建术,以减小手术创伤对患者的打击。但去除感染移植物,解除支架所致局部食管压迫,并对感染灶进行充分引流后,2 例存活患者均经胃镜证实,获得了食管瘘口的愈合。这在一定程度上表明,在充分清创、引流、解除压迫的基础上,联合十二指肠营养管置入,食管可以获得愈合,保留食管是可行的。
这7 例患者中,2 例患者的血培养结果呈阳性,整个治疗过程中,笔者团队给予广谱的抗感染治疗,并建议延长抗感染治疗疗程。Canaud等[29]在综述中指出,在>40%的TEVAR 后AEF 患者中,细菌学检查呈阳性,而长时间的抗生素治疗与病死率有很强的负相关性。
这项研究有以下局限性。首先,由于TEVAR术后移植物感染合并AEF 罕见,本研究纳入患者的数量有限,尚无法获得有说服力的结果。其次,这是一项回顾性研究,且数据来自单一机构,研究结果不能反映患者的一般特征。
综上所述,继发于TEVAR 且合并感染的AEF,其治疗极具挑战性,具有较高的病死率。保守治疗或单纯行TEVAR 往往无法使患者获得救治。同期进行非体外循环下升主动脉-腹主动脉解剖外人工血管旁路术、感染移植物及感染灶切除术、食管瘘口旷置引流术,对于治疗TEVAR 术后继发AEF 合并移植物感染是一种可行的策略,术后抗感染治疗应延长疗程。未来尚需更大规模的临床研究以评估此种治疗方法的安全性及有效性。
利益冲突:所有作者均声明不存在利益冲突。

