基于TGF-β/Smad信号通路研究NF-κB在电针抗慢性疲劳综合征中的作用及机制
韩玲 颜志浪 胡美凤
(1宜春学院,江西 宜春 336000;2江西中医药大学科技学院;3南昌市洪都中医院)
慢性疲劳综合征(CFS)是以极度疲劳为特征的一种证候群,持续或反复发作,且在运动后加重,经充分休息不能缓解,严重影响人们的学习、工作和生活。现有研究显示炎症反应和氧化应激可能与 CFS 的发病有关,而核转录因子(NF)-κB可以调节细胞内炎症反应和氧化应激,有可能参与CFS的发病过程〔1,2〕。针刺作为传统的特色医疗手法,临床用于治疗CFS已显示出较好的疗效,有研究显示针刺治疗CFS的机制可能是通过抑制脑组织炎性反应〔3,4〕。本研究观察电针干预对CFS大鼠的改善作用,并基于转化生长因子(TGF)-β/Smad信号通路探索其作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 36只SPF级健康雄性SD大鼠,体重200~220 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0011。
1.1.2实验试剂 褪黑素ELISA试剂盒,美国ADL公司生产;二喹啉甲酸(BCA)蛋白浓度测定试剂盒,碧云天生物技术研究所;兔抗 TGF-β、Smad、NF-κB p65 抗体,武汉博士德生物科技有限公司生产;多辣根过氧化物酶(HRP)标记山羊抗兔免疫球蛋白(Ig)G,北京中杉金桥生物科技有限公司生产;电化学发光(ECL)试剂盒,北京索莱宝生物科技有限公司。
1.1.3实验仪器 华佗牌一次性针灸针,苏州医疗用品有限公司生产,规格0.3 mm×25 mm;G6805-2电针治疗仪,常州市武进长城医疗器械有限公司;EPS300 型电泳仪,上海天能科技有限公司;MT-20水迷宫图像跟踪系统,成都泰能科技有限公司生产;TES-1350A 型噪音计,台湾泰仕公司;PCR 反应扩增仪,美国 Bio-Rad 公司;Tanon-4200SF型数码凝胶图像分析系统,上海天能科技有限公司。
1.2方法
1.2.1造模 36只大鼠随机分为正常组、模型组、电针组,模型组、电针组采用力竭游泳加慢性复合应激刺激多重因素制备CFS模型。正式造模前,先将大鼠置于水温(25±2)℃,深 35 cm 的水池中适应性游泳 3 d,每次游泳 20 min,1次/d;适应后大鼠尾部负重体重5%的铅块,在水池中游泳至力竭;大鼠负重游泳后,按照随机数字表法进行两种慢性刺激,包括:禁水12 h,禁食12 h,夹尾1 min,通宵照明和噪声刺激(110 dB,1 h)。
1.2.2电针治疗方法 于造模14 d后对大鼠进行针刺治疗,穴位:双侧感觉区、百会穴、宁神穴,用0.35 mm×25 mm毫针快速刺入皮下15 mm,连接电针仪并调节为连续波,每次30 min,1次/d,连续治疗14 d。对照组不给予任何干预,模型组每天给予电针组相同时间的捆绑,不予治疗。
1.3观察指标
1.3.1鼠尾悬挂实验 大鼠呈倒挂状,尾端1 cm处固定于一水平木板上,两侧用木板隔开动物视线。记录大鼠在6 min内的静止时间(大鼠完全静止不动状态的总时间)及挣扎次数(大鼠向上翻转的总次数)。
1.3.2力竭游泳实验 将大鼠置入游泳池,水温(20±1)℃,记录大鼠从入水至游泳力竭的时间(头部沉入水中10 s未浮出水面)。
1.3.3水迷宫实验 使用水迷宫跟踪系统,记录大鼠从入水到爬上平台所需时间(超过120 s按120 s记录)、有效区停留时间。
1.3.4采用酶联免疫吸附试验(ELISA)检测血浆褪黑素含量 治疗结束第2天进行,腹腔注射10%水合氯醛(350 mg/kg)麻醉,从0∶00起每4 h采样1次(0∶00、4∶00、8∶00、12∶00、16∶00、20∶00),取股动脉血样,置于抗凝管中,静置20 min,离心15 min(4℃,3 000 r/min),取上清液,按试剂盒说明书采用ELISA进行检测。
1.3.5免疫组化法(IHC)检测NF-κB p65蛋白表达 大鼠麻醉,生理盐水灌注后冰上迅速取出脑海马组织,4%多聚甲醛固定,石蜡包埋切片,二甲苯和梯度乙醇脱蜡,柠檬酸盐缓冲液修复,3%过氧化氢(H2O2)浸泡10 min,封闭,加入一抗,4℃孵育过夜,加入二抗,室温孵育 30 min,加适量二氨基联苯胺(DAB),苏木素复染 1.5~2.0 min,乙醇梯度脱水,二甲苯浸泡,中性树胶封片,光镜下观察结果,每组重复测量 3 次。
1.3.6荧光定量PCR(qPCR)技术检测TGF-β1、Smad mRNA表达 取大脑海马组织,提取组织总RNA,按照逆转录试剂盒说明书进行操作。反应条件:95℃,45 s,95℃ 15 s,60℃,40 s,进行45个循环。引物序列:TGF-β1正向引物:5′-GGTCACCTGTCCCCTCTCCT-3′,反向:5′-CTGGAGTGTCCATGGGACAG-3′;Smad4正向引物:5′-CAACATCCACCAAGTAATCGC-3′,反向:5′-CTCTCAATAGCTTCTGTCCTG-3′;GAPDH正向引物:5′-GGTTGTCTCCTGCGACTTCA-3′,反向:5′-TGGTCCAGGGTTTCTTACCC-3′。每组进行3次测定,取平均值,图像分析仪扫描凝胶密度,采用2-△△CT法进行数据的相对定量分析。
1.3.7Western印迹检测TGF-β、Smad蛋白表达 取大脑海马组织,加入放射免疫沉淀(RIPA)裂解液,在低温环境下进行研磨、充分裂解,离心15 min(4℃、12 000 r/min),取上清液。用 BCA 法进行蛋白定量,通过电泳、转膜、脱脂、封闭、剪膜,加入一抗TGF-β、Smad、GAPDH,4℃ 孵育过夜,TBST洗涤,加入二抗,室温孵育 2 h,TBST 洗涤,用ECL试剂显色后,化学发光仪成像。
1.4统计学方法 采用SPSS17.0软件进行χ2、t检验。
2 结 果
2.1电针对CFS大鼠鼠尾悬挂静止时间及挣扎次数、力竭游泳时间影响 与对照组比较,模型组静止时间明显延长、挣扎次数明显减少,力竭游泳时间明显缩短(P<0.01);与模型组比较,电针组静止时间明显缩短,挣扎次数明显增多,力竭游泳时间明显延长(P<0.01)。见表1。
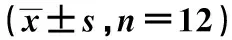
表1 电针对CFS大鼠鼠尾悬挂静止时间及挣扎次数、力竭游泳时间影响
2.2电针对CFS大鼠水迷宫用时及有效区停留时间影响 与对照组比较,模型组水迷宫用时明显延长,有效区停留时间明显缩短(P<0.01);与模型组比较,电针组大鼠水迷宫用时明显缩短,有效区停留时间明显延长(P<0.01)。见表2。
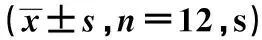
表2 电针对CFS大鼠水迷宫用时及有效区停留时间影响
2.3电针对CFS大鼠褪黑素含量的影响 与对照组比较,模型组褪黑素含量变化趋势明显不同,其中4∶00 褪黑素含量明显高于对照组,日间含量明显低于对照组,昼夜波动程度明显减弱;与模型组比较,电针组褪黑素含量昼夜波动程度增大,变化趋势与空白组基本一致,下半夜含量降低,4∶00降低明显,而白天褪黑素含量升高。见表3。
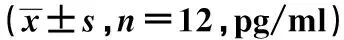
表3 不同时间电针对CFS大鼠褪黑素含量的影响
2.4电针对CFS大鼠海马区可见NF-κB p65蛋白表达的影响 与对照组比较,模型组海马区NF-κB p65阳性表达细胞数量明显增加,颜色较深(P<0.01);与模型组比较,电针组海马区 NF-κB p65阳性细胞表达明显减少,颜色较浅(P<0.01)。见表4。
2.5电针对CFS大鼠海马区TGF-β1、Smad4 mRNA及蛋白表达的影响 与对照组比较,模型组海马区TGF-β1、Smad4 mRNA及蛋白表达明显增加(P<0.01),与模型组比较,电针组海马区TGF-β1、Smad4 mRNA及蛋白表达水平明显降低(P<0.01)。见表4、图1。
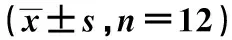
表4 电针对CFS大鼠蛋白及mRNA表达的影响

图1 电针对CFS大鼠TGF-β1、Smad4 蛋白表达的影响
3 讨 论
头针作为一种常见的针刺疗法,可以调神益智、醒脑开窍、改善肢体功能,头针结合电刺激可以加强刺作用,更有效的改善大脑功能〔5,6〕。鼠尾悬挂实验挣扎次数可反映大鼠的体力状况,静止时间可反映大鼠的绝望情绪〔7〕,常用以评价动物的心理抑郁程度。力竭游泳实验可以判断大鼠的体力情况,用以评价动物体力及是否疲劳。水迷宫实验是目前最常用于评价动物学习和记忆能力的方法。3个实验结合可以全面评价大鼠的躯体和心理疲劳状态。本研究说明大鼠出现心理、体力不同程度的疲劳;力竭游泳时间缩短,说明慢性疲劳大鼠出现了体力疲劳症状,水迷宫用时延长,有效区停留时间缩短,说明大鼠出现了学习、记忆能力的下降;3个实验反映了大鼠体力、学习记忆力的下降和情绪反应的改变,即“躯体疲劳”和“心理疲劳”状态,经过电针双侧感觉区、百会穴、宁神穴治疗后,大鼠鼠尾悬挂实验静止时间缩短,挣扎次数增加,力竭游泳时间延长,水迷宫平台潜伏期缩短,穿越平台次数增加,说明电针可显著改善CFS大鼠的躯体疲劳和学习记忆能力。
褪黑素的昼夜分泌节律是维持人体睡眠-觉醒节律的生理基础,可通过调节睡眠状态改善认知功能,维持正常的神经心理状态〔8,9〕。褪黑素昼夜分泌节律异常与CFS睡眠障碍、认知功能下降、情绪障碍等临床表现较为相似,所以临床常用外源性的褪黑激素治疗CFS〔10〕。本研究说明电针可以恢复CFS大鼠褪黑素的昼夜节律紊乱,改善大鼠的睡眠障碍。
NF-κB信号通路可在各阶段介导炎性反应,是机体炎性反应的关键指标〔11〕。NF-κB主要以 p50/p65 二聚体形式存在,其中NF-κB p65含转录活化区,参与基因转录的起始调节。当机体受到刺激,NF-κB 便移位于细胞核,并促进多种炎症因子如TNF、IL-1β 及TGF-β1 的释放〔12,13〕。本研究结果提示海马区炎性改变可能与CFS的发病相关,电针治疗可降低海马区的NF-κB p65蛋白表达,说明电针治疗可以抑制CFS大鼠海马区的炎性反应。TGF-β 对细胞具有双向调节作用,同时参与体内生理生化、信号转导与调控,对神经系统具有一定的保护作用〔14,15〕。有研究表明,脑内 TGF-β 水平升高可产生疲劳感觉,在 CFS患者的脑脊液中发现TGF-β 水平的增加,所以推测CFS发病与TGF-β 水平升高相关。Smad是TGF-β超家族信号传导成员,负责将TGF-β超家族信号从细胞内传递到细胞核。有研究表明 CFS 海马中 Smad4呈现高表达〔16〕,在 TGF-β 当作配体的受体复合物激活下 Smads 进入核内,共同调节靶基因的转录。本研究提示电针对 CFS 模型大鼠治疗作用机制可能与 TGF-β/Smad 信号通路有关。

