鹅去氧胆酸对HepG2细胞胆汁酸靶基因的影响及其联合姜黄素的细胞毒性
曾 伟,牛永东,张俏忻
(1.汕头大学医学院第一附属医院药学部,广东 汕头 515041;2.汕头大学医学院药理学教研室,广东 汕头 515041;3.汕头大学医学院第一附属医院检验科,广东 汕头 515041)
肝细胞癌是全球癌症相关死亡的第四大常见原因,造成了沉重的疾病负担[1]。法尼醇X受体(farnesoid X receptor,FXR)在机体内参与胆汁酸合成、代谢、转运,并能够调节重要的靶基因[2]。研究推测其与原发性肝癌的发生发展有密切的关系,还可能在肝癌细胞中信号通路异常表达方面发挥着不可或缺的作用[3]。小异二聚体伴侣(small heterodimer partner,SHP)在许多代谢通路中起调节作用;胆汁酸盐输出泵(bile salt export pump,BSEP)和钠离子—牛磺胆酸共转运蛋白(Na+-taurocholate cotransporting polypeptide,NTCP)影响肝细胞内外的胆汁酸平衡;胆固醇7α羟化酶(cholesterol 7α-hydroxylase,CYP7A1) 和胆固醇12α羟化酶(sterol-12α-hydroxylase,CYP8B1)参与鹅去氧胆酸和胆酸的合成。鹅去氧胆酸为FXR最强有力的配体。肝细胞癌患者、肝硬化患者和健康人血浆中的鹅去氧胆酸水平存在明显差异[4],血浆中的鹅去氧胆酸变化水平可作为诊断鉴别肝硬化和肝细胞癌的生物标志物[5]。姜黄素可以有效抑制多种癌细胞的生长和转移,且无明显毒副作用,为潜在的抗肝细胞癌治疗药物[6]。本研究用鹅去氧胆酸处理HepG2细胞,考察其对FXR、BSEP、SHP、CYP7A1、CYP8B1、NTCP以 及β-catenin等胆汁酸靶基因mRNA的影响,并观察鹅去氧胆酸和姜黄素对HepG2和SMMC-7721细胞的毒性。
1 材料与方法
1.1 材料
1.1.1 主要试剂和药物配制MTT、二甲基亚砜(dimethyl sulfoxide,DMSO)、胎牛血清、DMEM高糖培养基购于北京索莱宝科技有限公司,胰酶、结晶紫、4%的多聚甲醛购于上海吉至生化科技有限公司。鹅去氧胆酸购于美国MedChemExpress公司,纯度≥98.0%,使用DMSO配制成15 mmol/L储备液,采用DMEM完全培养基稀释至终浓度分别为1、3.3、10、20、30 μmol/L的药液;姜黄素购于美国MedChemExpress公司,纯度≥98.0%,使用DMSO配制成30 mmol/L储备液,采用DMEM完全培养基稀释至终浓度分别为5、15、30、45、60 μmol/L的药液。
1.1.2 肝癌细胞株和细胞培养HepG2细胞和SMMC-7721细胞均来自中国科学院上海细胞库,分别由汕头大学医学院罗文鸿和牛永东课题组冻存保种。在超净工作台内,先将3 mL DMEM高糖完全培养基加入15 mL的无菌离心管。从-80℃冰箱内取出冻存的肝癌细胞株,在37℃的恒温水浴箱摇晃至完全溶解,随后将细胞悬液移入离心管,1 000 r/min离心5 min,弃上清,用DMEM高糖完全培养基吹打混匀后,移入培养皿,在37℃、5% CO2细胞培养箱内培养至对数期,传代,留样冻存备用。
1.2 方法
1.2.1 实时荧光定量PCR测定mRNA的表达水平取对数生长期的HepG2细胞,接种于6孔板并按浓度梯度加入鹅去氧胆酸,设置对照组。用Trizol法提取RNA,测定RNA质量并调整RNA浓度,进行逆转录反应合成cDNA。使用ABI QS5实时荧光定量PCR仪进行实时荧光定量PCR(每个样品设置3个复孔),反应条件为95℃30 s;95℃5 s,60℃34 s,循 环40次;95℃15 s,60℃1 min,95℃15 s;4℃保存。采用2-ΔΔCT相对定量法比较各浓度药物实验组和对照组mRNA的表达差异。引物序列见表1,内参为cyclin。

表1 基因及引物序列
1.2.2 MTT法测定细胞存活率将细胞接种至96孔板(2×103个/孔),在37℃、5%CO2的细胞培养箱内孵育过夜至细胞完全贴壁,吸弃培养基,设置空白组、对照组和实验组(每组5个复孔),按浓度梯度加入配制好的药液,放入培养箱,分别孵育24、48、72 h后取出,按20 μL/孔加入0.5%MTT,继续培养4 h,吸弃孔中液体,按150 μL/孔加入DMSO,低速振荡10 min后用酶联免疫检测仪在490 nm处测量各孔的OD值。细胞存活率=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.2.3 克隆形成实验将HepG2细胞均匀接种至6孔板(200个/孔),孵育过夜待细胞完全贴壁,吸弃培养基,分别使用含0.2%DMSO完全培养基(对照组)、15 μmol/L姜黄素、10 μmol/L鹅去氧胆酸、15 μmol/L姜黄素+10 μmol/L鹅去氧胆酸处理48 h后,更换新鲜培养基连续培养10 d。用4%的多聚甲醛固定和结晶紫染色,计算克隆成团的细胞群。
1.3 统计学方法
运用统计软件SPSS 19.0对实验数据进行分析,符合正态分布的计量资料以表示。多组间比较采用单因素方差分析,组间两两比较采用SNK法。P≤0.05表示差异具统计学意义。每组实验均设置至少3个平行样本,每个实验重复3次以上。
2 结果
2.1 鹅去氧胆酸对HepG2细胞胆汁酸靶基因的mRNA表达影响
随着鹅去氧胆酸浓度的提高,BSEP和SHP基因的mRNA表达逐步升高,而CYP7A1、CYP8B1、NTCP和β-catenin基因的mRNA则降低(P值均≤0.05),然而FXR基因mRNA表达量在不同药物浓度的影响下无明显差异变化(P>0.05)。鹅去氧胆酸可能通过激活核受体FXR而调节关联基因BSEP、SHP、CYP7A1、CYP8B1、NTCP和β-catenin的表达。见图1。

图1 鹅去氧胆酸对HepG2细胞胆汁酸靶基因的mRNA表达影响
2.2 姜黄素和鹅去氧胆酸对肝癌细胞存活率的影响
按浓度从低到高分别单独使用姜黄素和鹅去氧胆酸处理HepG2细胞24、48、72 h,用MTT法检测细胞存活率。姜黄素组和鹅去氧胆酸组细胞存活率都随剂量的加大和时间的推移有明显的下降(P≤0.05)。提示姜黄素可以抑制细胞HepG2增殖;鹅去氧胆酸激活FXR后同样抑制了HepG2细胞的增殖。采用10 μmol/L的鹅去氧胆酸激活细胞FXR后再用各浓度姜黄素处理HepG2细胞,细胞存活率均较两者单独使用更低,差异有统计学意义(P≤0.05)。见图2。
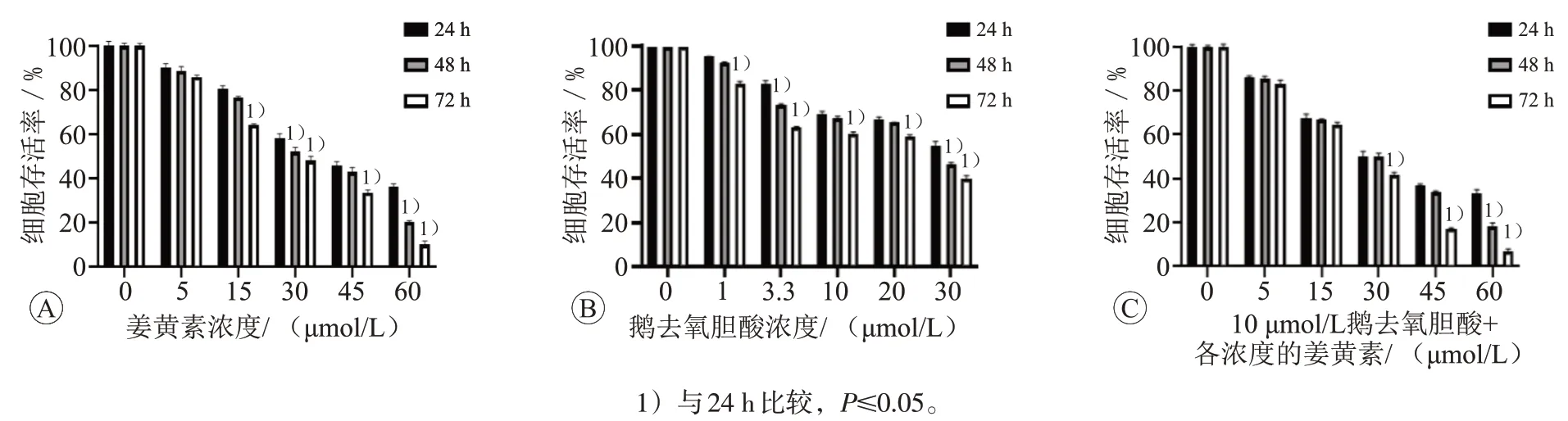
图2 姜黄素和鹅去氧胆酸对HepG2细胞存活率的影响
姜黄素组和鹅去氧胆酸组与对照组比较都随剂量的加大和时间的推移有明显的下降(P≤0.05),提示姜黄素可以抑制SMMC-7721增殖,鹅去氧胆酸激活FXR后同样抑制了SMMC-7721细胞的增殖。采用10 μmol/L的鹅去氧胆酸激活细胞FXR后再用各浓度姜黄素处理SMMC-7721细胞,细胞存活率均较两者单独使用更低(P≤0.05)。见图3。
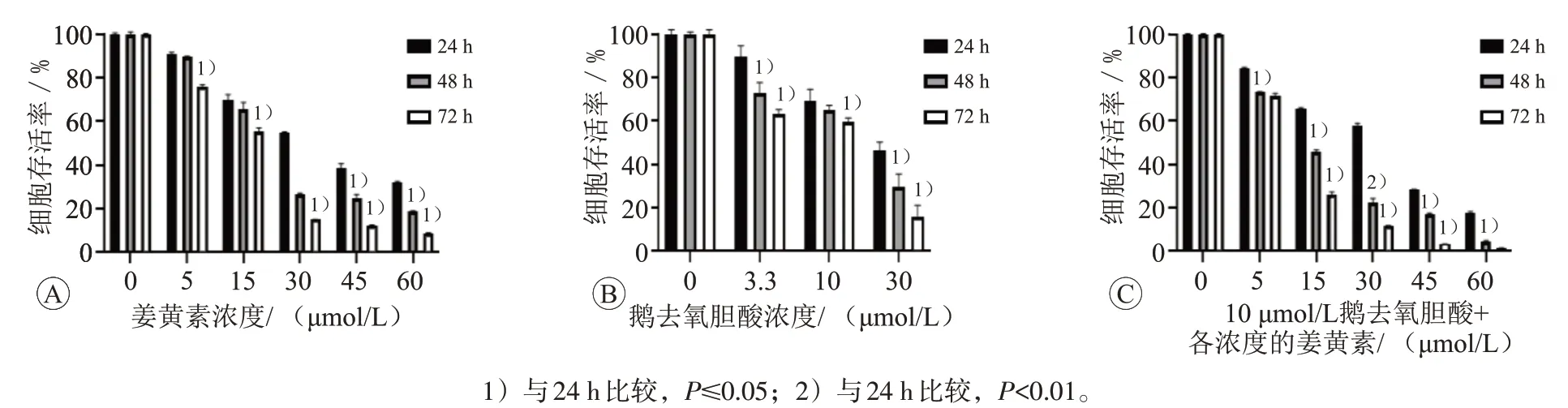
图3 姜黄素和鹅去氧胆酸对SMMC-7721细胞存活率的影响
2.3 克隆形成实验
单独使用10 μmol/L的鹅去氧胆酸、15 μmol/L的姜黄素处理肝癌HepG2细胞后,与对照组相比,其克隆形成率分别为(46.4±2.3)%、(53.2±1.9)%,表明鹅去氧胆酸和姜黄素对HepG2增殖均有一定程度的抑制作用。当鹅去氧胆酸和姜黄素联用后,其克隆形成率降至(10.2±1.6)%,提示鹅去氧胆酸和姜黄素联用对抑制HepG2的增殖有叠加效应。见图4。
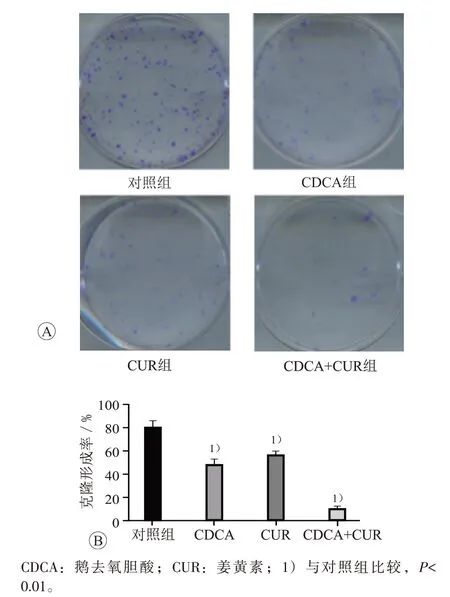
图4 鹅去氧胆酸和姜黄素处理后HepG2细胞的克隆形成结果
3 讨论
肝细胞癌的发生和发展是受多基因和多因素调控的过程。FXR在肝脏、肾脏、肠道和血管内皮等器官组织中高水平表达,可能在肝癌的发生发展中起着关键作用。研究发现FXR有显著的抗肿瘤作用[7]。胆汁酸是胆固醇代谢的终产物,如发生异常导致水平升高,除产生细胞毒性作用外,还有可能活化特定的胆汁酸受体,影响肝细胞癌发生和发展[8]。鹅去氧胆酸是FXR的高效内源性配体,有很高的激动活性,FXR通过激活胆汁酸代谢基因从而直接或间接调控这种基因的表达。胆汁酸的合成与代谢受机体内多种反馈机制调节,胆汁酸的稳态调节对机体至关重要[9]。本研究通过实时荧光定量PCR发现鹅去氧胆酸可能通过激活HepG2肝癌细胞中的FXR后,上调胆汁酸代谢的靶基因SHP和BSEP的表达,使影响胆汁酸合成的CYP7A1和CYP8B1的mRNA表达水平降低,并抑制NTCP和β-catenin的mRNA表达。此外,肝细胞内鹅去氧胆酸水平上升也可能引起一系列反馈调节。机体内参与胆汁酸代谢的靶基因较多,部分相关靶基因仍有待发现,具体通路机制也有待进一步探讨。近年来发现Wnt/β-catenin信号通路对肝细胞癌的发生发展和预后有重要的作用[10]。有国内学者发现肝癌组织中β-catenin的表达最高,而在正常肝组织却最低。特异性对β-catenin进行干扰,使其表达降低,可以抑制肿瘤细胞增殖并促进肿瘤细胞的凋亡[11]。FXR还可以代偿性促进肝再生,敲除FXR基因的小鼠会发生肝细胞癌[12]。本研究提示鹅去氧胆酸激活FXR以调控各路胆汁酸关联基因,可能成为预防治疗肝细胞癌的靶点,并可能与下调β-catenin基因的表达有关。近年来对化疗药物抗肿瘤作用减毒增效的探求,使姜黄素的研究成为一个重要的研究领域[13]。但姜黄素的抗癌作用机制复杂,姜黄素对各种癌细胞的敏感程度不同,抑制能力不同,抑制癌细胞的作用机制也可能不同[14-15]。
本研究通过MTT实验检验鹅去氧胆酸和姜黄素对人肝癌细胞HepG2和SMMC-7721的毒性作用,并通过克隆形成实验进一步验证鹅去氧胆酸和姜黄素对HepG-2和SMMC-7721细胞增殖的影响。结果表明,姜黄素和鹅去氧胆酸对肝癌细胞HepG2和SMMC-7721均有细胞毒性。两者均能呈剂量和时间依赖性地抑制HepG2和SMMC-7721细胞的增殖,细胞的存活率随药物浓度加大和用药时间的增加而下降,且联用的效果加强。提示鹅去氧胆酸联合姜黄素有抗肝细胞癌的应用前景。综上所述,鹅去氧胆酸对肝癌细胞HepG2的细胞毒性与胆汁酸代谢有关,鹅去氧胆酸联合姜黄素能更好地抑制肝癌细胞增殖。

