微RNA与食管癌顺铂耐药
钟 誉,陈 扬,吴灵飞
(汕头大学医学院第二附属医院消化内科,广东 汕头 515041)
食管癌是世界上最常见的消化道恶性肿瘤之一,严重威胁着人类的健康。最新数据显示,2020年全球新发食管癌约60.4万例,食管癌死亡病例约54.4万例,食管癌患病率居所有恶性肿瘤第7位,病死率居第6位[1];我国每年因食管癌死亡的患者人数居恶性肿瘤的第4位[2]。食管癌分为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌两种类型。食管鳞状细胞癌约占所有食管癌病例的90%,是最常见的组织学类型。大部分食管癌早期临床症状不明显,就诊时多数已为中晚期。食管癌的治疗以手术及放化疗为主,顺铂是治疗局部进展期及转移性食管癌的一线药物,病人早期治疗效果明显,但其耐药性是导致治疗失败的重要原因[3]。美国癌症协会研究表明,90%以上的肿瘤患者会不同程度地受到所用化疗药物的耐药性影响[4]。因此,研究耐药的机制及寻求耐药逆转的有效方法成为新近研究的热点。Guo 等[5]首次发现,miRNA在食管癌组织中存在差异表达谱,越来越多研究证实,miRNA在食管癌中存在差异表达,调控癌基因调控水平进而影响食管癌细胞增殖、迁移、侵袭及凋亡等生物学行为,从而影响食管癌细胞对顺铂的敏感性。本文就miRNA在食管癌顺铂耐药中的研究进展作一综述。
1 顺铂耐药的机制
顺铂主要通过与肿瘤细胞DNA 结合形成Pt-DNA 加合物,导致DNA 结构改变,DNA 复制、转录障碍,造成肿瘤细胞死亡。然而,在此过程中常出现内源性耐药或获得性耐药,即肿瘤本身内在的和因基因突变或获得外源性耐药基因所导致的耐药性。其主要机制包括促进药物排出胞内和减少药物蓄积、增强药物灭活及DNA修复、产生保护性自噬、抑制凋亡信号传导和间接调控因子的改变等。具体见图1。
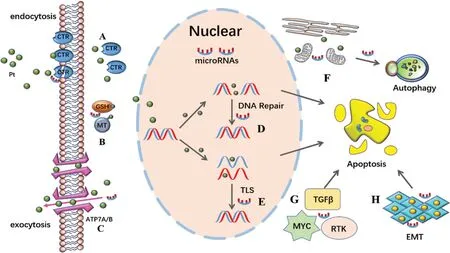
图1 miRNA参与顺铂耐药机制的调控
1.1 减少顺铂摄取
铂类药物发挥细胞毒作用的第一步是进入细胞。此过程较复杂,尚未完全揭示清楚。目前认为,顺铂的摄取主要是由哺乳动物中的铜转运蛋白介导。顺铂可引发铜转运蛋白快速降解而导致顺铂摄入减少,导致顺铂耐药[6]。钠泵、有机阳离子转运蛋白2、P 型ATP 酶转运蛋白的表达亦影响铂类药物的入胞过程。此外,内吞作用也是铂类入胞的另一种机制,内吞作用降低可导致顺铂耐药[7]。
1.2 加速顺铂外排
铂类药物进入细胞后,通过转运体出胞是导致药物在胞内浓度降低的另一个原因。P 型ATP 酶转运蛋白和ABC转运蛋白是参与顺铂外排的两种主要转运蛋白。顺铂通过激活P型ATP酶转运蛋白的催化循环,使其N端金属结合结构域的半胱氨酸残基处结合顺铂,形成稳定的Pt2+-S键。该反应将铂类药物螯合到分泌途径的囊泡中,加速顺铂外排,导致胞内药物毒性降低[8]。ABC转运蛋白家族有7个亚家族成员(从ABCA到ABCG),其中多种药物耐药相关基因 (MRP) 组 成 的 C 亚 家 族 (ABCB1/PGP、 ABCC1/MRP1、 ABCC2/MRP2、 ABCC3/MRP3、 ABCC4/ MRP4 和ABCC5/MRP5)成员参与了顺铂耐药的调控[9]。
1.3 加速胞浆内失活
顺铂进入细胞后,可因细胞解毒机制在浆内失活而产生耐药。其胞浆失活的主要形式是:谷胱甘肽和金属硫蛋白通过硫醇基团配位与顺铂结合,抑制氧化应激、保护细胞免受自由基损伤而降低顺铂毒性。另外,与顺铂结合的谷胱甘肽更容易通过转运蛋白出胞而减少药物在细胞内累积,从而减少了顺铂的抗癌效果[10]。
1.4 促进DNA修复
Pt-DNA 加合物修复系统被认为是顺铂耐药的主要机制,顺铂诱导的DNA加合物能够阻断转录和DNA合成,进而触发复杂的细胞内信号转导级联反应。在修复受损或过度损伤的情况下,细胞发生凋亡。为了抵制顺铂引起的大量细胞死亡,细胞会启动一系列DNA修复系统,包括核苷酸切除修复、错配修复、同源重组和非同源末端连接等[11]。
1.5 跨损伤DNA合成
当DNA 损伤无法修复时,细胞可以利用跨损伤DNA合成提高其对DNA 损伤的耐受性。跨损伤DNA 合成由具有广泛催化位点且缺乏校对活性的Y 家庭聚合酶(Polη、Polι、Polκ和Rev1)和B家族聚合酶执行[12],使细胞通过加合物复制DNA,避免复制叉崩溃和死亡信号,造成肿瘤细胞对铂类药物诱导DNA损伤的耐受性[13]。
1.6 改变细胞存活途径
当细胞暴露于顺铂等铂类药物后,促细胞生存和凋亡信号通路会被同时触发。细胞的最终命运取决于这些相反信号的相对强度和持续时间。MAPK 通路(包括ERK、p38和JNK)是抑制细胞凋亡的通路,研究表明,MAPK通路激活与顺铂耐药有关[14]。TP53可以根据细胞环境触发促生存或促凋亡信号。研究表明,顺铂耐药与TP53功能缺陷有关。Timmerman 等[15]研究发现,TP53缺失可促进纵隔来源的生殖细胞肿瘤对顺铂耐药。除此之外,顺铂治疗过程中会增加活性氧水平,导致DNA损伤、细胞器断裂、线粒体功能破坏和ATP 耗竭,促进细胞凋亡。Pan 等[16]报道,自噬途径亦与顺铂耐药性相关。自噬是一种分解代谢途径,根据应激条件回收必需成分。顺铂可诱导细胞自噬,并通过减少凋亡及增强DNA修复而介导耐药[17]。
1.7 改变生物信息传导通路
研究发现实体瘤细胞在缺氧条件下会诱导顺铂耐药。缺氧转录程序主要由HIF 转录因子激活。HIF 转录因子可以调节多达2%的人类基因组的转录,从而影响细胞凋亡或细胞存活[18]。顺铂进入细胞后,会导致内质网应激,触发未折叠蛋白反应。大量研究表明,内质网应激诱导的分子伴侣活性增加与顺铂耐药相关[19]。此外DNA甲基化表观遗传学改变[20],上皮间质转化(epithelial-mesenchymal transition,EMT)[21]以及 MYC、TGFβ、MYC、RTK 等[13]信号通路改变均参与了顺铂耐药的调控。
2 miRNA
miRNA 是一类丰富的调节性非编码单链RNA 分子,广泛存在于真核生物中,长度约为19~23个核苷酸,这是一类在动植物中新发现的基因表达调控因子,它们通过靶向mRNA、诱导翻译抑制和mRNA 降解来调节基因表达[22]。最初发现miRNA时研究人员并没有意识到它们的重要性。第一个被确认的miRNA 是在线虫体内发现的lin-4基因,并且认为是线虫独有的。然而,通过传统的克隆方法和生物信息学手段发现在线虫、果蝇、哺乳动物中存在着数百个miRNA,这引起了各领域科学家的重视。据估计,在人类基因组中至少存在300~1 000 个miRNA,miRNA已成为最大的一类基因表达调控因子[23-25]。
虽然目前已揭示出miRNA的生物学功能,但如何精确地鉴定miRNA所靶向的基因仍是一项严峻的挑战。多项研究发现,1 个miRNA 可以结合多达200 个靶基因,而这些靶基因可以行使不同的功能,包括受体、分泌蛋白、转运蛋白及转录因子[26]。初步推算,miRNA 可能参与人类1/3基因的调控,其中包括与癌症相关的基因表达[27]。研究表明,miRNA 通过调控癌基因表达发挥促癌或抑癌作用[28]。miRNA通过调节细胞增殖、迁移、侵袭和凋亡相关的靶基因而导致细胞生物性状的改变,进而影响肿瘤的进展[29]。miR-34 是第一个被证明受肿瘤抑制基因p53直接调节的miRNA[30],其与肿瘤的发生及进展有关。
3 miRNA参与顺铂耐药的机制
与化疗敏感的食管癌细胞相比,顺铂耐药的细胞呈现不同程度的miRNA 表达失调。miRNA 主要通过影响细胞生物学行为及相关信号通路参与顺铂耐药的调控。
3.1 调节细胞增殖与凋亡
Zuo 等[31]证实过表达 miR-153-3p 通过下调 NRF2 来抑制ESCC 细胞增殖并增加顺铂抗癌的敏感性。Liu 等[32]发现,ESCC 细胞中过表达miR-455-3p 可通过激活Wnt/β-catenin 和 TGF-β/Smad 通路诱导 ESCC 呈现肿瘤干细胞特征,促进肿瘤的发生及耐药性。Zhao 等[33]研究表明,miR-125a-3p 上调可抑制STAT3 信号通路,增加ESCC 细胞凋亡,降低其对顺铂耐药。miR-10b被证实是多种恶性肿瘤中的癌基因,也参与了介导食管癌顺铂耐药的调控。Wu 等[34]研究证实过表达miR-10b 介导PPARγ表达下调,激活AKT/mTOR/P70S6K 信号传导,抑制食管癌细胞凋亡并增强其耐药。Shi等[35]报道,外泌体过表达miR-193可下调TFAP2C,减少顺铂对食管癌细胞周期蛋白的抑制,促进食管癌细胞分裂增殖而导致耐药。Zhu 等[36]研究发现ESCC中上调的miR-106b-3p通过与蛋白质-谷氨酰胺γ-谷氨酰转移酶E 3′UTR 序列结合负性调控蛋白质-谷氨酰胺γ-谷氨酰转移酶E 表达而抑制细胞凋亡,诱导ESCC 对顺铂耐药。Zheng 等[37]报道,过表达miR-145 可通过下调MRP1 和P-gp 蛋白表达抑制AKT3,增强其对顺铂化疗的敏感性。失调的长链非编码RNA(long noncoding RNA,lncRNA)在食管癌顺铂耐药中亦起着重要作用,miRNAs作为lncRNAs 下游反应物常参与其中。Chang 等[38]研究发现,上调的circ_0007142通过海绵样吸附miR-494-3p促进LASP1表达从而抑制细胞凋亡,提高食管癌细胞对顺铂的耐受性。Zhu 等[39]研究表明,lncRNA-EMS 通过下调miR-758-3p 促进WTAP 表达,可抑制ESCC 细胞凋亡并促进顺铂耐药。Liu等[40]证实lncRNA FOXD2-AS1充当竞争性内源性RNAs 靶向吸附miR-195,通过活化AKT/mTOR 信号通路促进ESCC 细胞生长,抑制其凋亡并产生顺铂耐药。Cheng 等[41]报道,下调miR-873-3p 可激活SOX4/Wnt/β-catenin 信号通路进而促进ESCC 细胞增殖,提高其顺铂耐药性。Wang 等[42]研究表明,lncRNA-LINC00261 海绵样吸附miR-545-3p下调MT1M表达以促进ESCC细胞凋亡进而抑制顺铂耐药。
3.2 影响细胞迁移和侵袭能力
Yan 等[43]研究发现,过表达的miR-624 通过抑制ARRDC3 表达从而上调YAP 表达并激活HIF1α信号通路,促进细胞迁移和侵袭能力,增加ESCC 细胞顺铂耐药。Yang 等[44]报道,过表达 miR-21 通过下调PDCD4的 mRNA和蛋白水平,增强食管癌细胞的侵袭能力并诱导顺铂耐药性产生;Wan 等[45]研究证实,miR-21 通过下调PTEN表达促进食管癌细胞顺铂耐药。Jia 等[46]研究证实lncRNA NORAD 通过海绵样吸附miR-224-3p,上调异黏蛋白(metadherin,MTDH)表达以促进ESCC 细胞迁移和侵袭,并产生顺铂耐药。有关mRNA参与食管癌顺铂耐药调控及其机制详见表1。
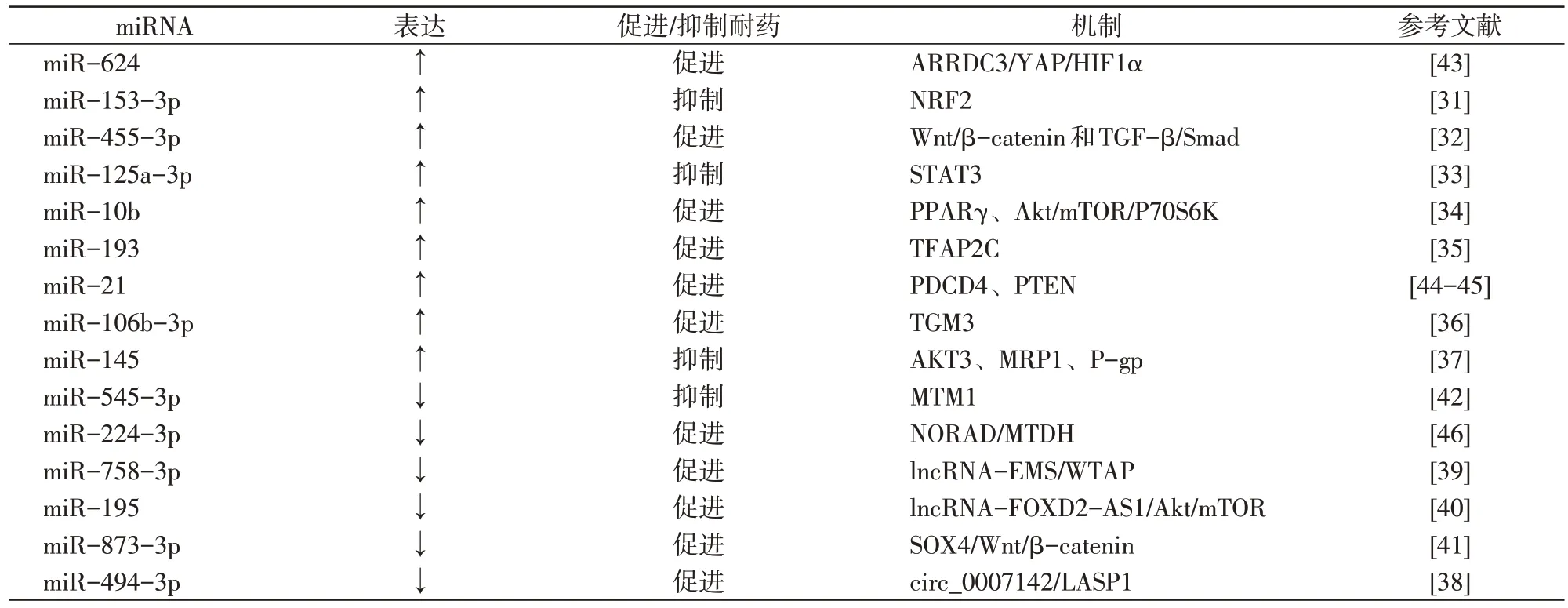
表1 miRNA与食管癌顺铂耐药的关系
4 小结与展望
总之,作为近年非编码RNA 家族中的一个新研究热点,miRNA在食管癌化疗耐药中的作用已得到越来越多研究的证实。miRNA通过调控mRNA,诱导食管癌细胞的发生、发展。在对食管癌进行新辅助化疗及姑息治疗过程中,miRNA不仅可以作为化疗药物的直接治疗靶点,另外由于其具有高度稳定性,易于在外周血、尿液和唾液中被检测,因此,还可用于肿瘤的诊断、预后和疗效的观察。虽然目前尚无miRNA用于抗癌治疗的临床报道,但是相信在不久的将来,随着miRNA参与肿瘤发生及耐药机制更深入的研究,开发针对miRNA的靶向药物有望在肿瘤治疗中探索出一条新途径。

