大车前苷通过调控miR-711/S100A16信号通路表达抑制膀胱癌细胞的增殖和迁移
黄 耿,桂定文,付金伦,林 玲,万京桦,袁 琛(鄂东医疗集团黄石市中心医院泌尿外科,黄石 45000;肾脏疾病发生与干预湖北省重点实验室;武汉科技大学职业危害识别与控制湖北省重点实验室;通讯作者,E-mail:drhsszxyyhg@6.com)
膀胱癌来源于膀胱上皮,是我国最常见的泌尿系统恶性肿瘤[1]。尽管膀胱癌的治疗策略近些年有了较大的发展,由于膀胱癌细胞增殖和迁移能力强,患者术后易复发、生存期较短,总体治疗效果并不令人满意[2]。针对膀胱癌增殖和迁移机制的研究显得尤为迫切。已有研究表明,中药提取物在细胞氧化应激、糖代谢、线粒体功能等方面发挥重要作用,能够有效抑制肿瘤细胞增殖和迁移[3-5]。近年来,中药提取物在多种肿瘤发生、发展中的作用被广泛关注。大车前苷是车前草的活性成分,是一种苯丙烷类糖苷[6]。研究表明,大车前苷能够明显抑制多种肿瘤如黑色素瘤、宫颈癌、肝癌等细胞的增殖和转移[7-9]。大车前苷在膀胱癌细胞中发挥的作用和分子机制并不清楚。本研究采用大车前苷处理膀胱癌MGH-U3细胞,观察大车前苷对膀胱癌细胞增殖和迁移的影响,通过生物信息学技术和双荧光素酶报告基因在分子水平研究大车前苷影响膀胱癌细胞恶性生物学行为的机制。
1 材料和方法
1.1 细胞和试剂
膀胱癌MGH-U3细胞购自美国ATCC细胞库。大车前苷购自成都普瑞法科技开发有限公司(分析纯、批号PRF20081722)。双荧光素酶报告基因检测试剂盒购自美国Promega公司。miR-711模拟序列、无意义模拟序列(NC)、野生型荧光S100A16报告载体(pcDNA-WT-S100A16)、突变型荧光S100A16报告载体(pcDNA-Mut-S100A16)购自武汉普美克生物有限公司。CCK-8试剂盒购自江苏碧云天生物科技公司。qRT-PCR试剂盒购自美国Millipore公司。RPMI-1640培养基、胎牛血清购自美国Gibco公司。一抗S100A16、β-actin、p-AKT、p-ERK、c-Myc、CIP2A抗体均购自美国Abcam公司。
1.2 CCK-8法检测MGH-U3细胞活力
将生长状态良好的MGH-U3细胞接种于96孔板,取对数生长期的MGH-U3细胞,分别加入0,5,10,20,40,80 μg/ml的大车前苷,24 h后每孔加入30 μl的CCK-8试剂,在培养箱中孵育3.5 h,通过全自动酶标仪分析每孔MGH-U3细胞在450 nm波长处的光密度(OD)值。
1.3 细胞培养和处理
使用含10%胎牛血清的RPMI-1640培养基培养膀胱癌MGH-U3细胞,于37 ℃、5%CO2培养箱中培养。取对数生长期的MGH-U3细胞,细胞融合度达65%时,分别加入0,40 μg/ml的大车前苷,分别命名为对照组和大车前苷组。
1.4 细胞划痕实验检测MGH-U3细胞迁移能力
将对照组和大车前苷组细胞悬液加入24孔板,经过48 h的孵育,用移液枪枪头在24孔板孔底划痕,用显微镜拍照并测量划痕宽度B1。经过24 h的孵育,用显微镜拍照并测量划痕宽度B2。对照组和大车前苷组MGH-U3细胞划痕愈合率=(B1-B2)/B1×100%。
1.5 qRT-PCR检测miR-711和S100A16 mRNA表达
用Trizol试剂从MGH-U3细胞提取RNA,逆转录反应合成cDNA,采用qRT-PCR试剂盒对miR-711和S100A16 mRNA相对表达量进行检测。qRT-PCR引物如下:①miR-711上游引物:5′-TGCGCGGGACCCTGGGAGAGAT-3′,下游引物:5′-CCAGTGCAGGGTCCGAGGTATT-3′;②β-actin上游引物:5′-CACGATGGAGGGGCCGGACTCATC-3′,下游引物:5′-TAAAGACCTCTATGCCAACACAGT-3′;③S100A16上游引物:5′-ATGTCAGACTGCTACACGGAG-3′,下游引物:5′-GTTCTTGACCAGGCTGTACTTAG-3′;④U6上游引物:5′-CGCTTCGGCAGCACATATAC-3′,下游引物:5′-AAATATGGAACGCTTCACGA-3′。以U6作为miR-711的内参,β-actin作为S100A16 mRNA的内参。
1.6 生物信息学技术预测和双荧光素酶报告基因实验验证miR-711的靶基因
通过miRGator数据库预测miR-711潜在互补结合的基因是S100A16。当MGH-U3细胞生长状态良好时,分别将pcDNA-WT-S100A16+miR-711、pcDNA-WT-S100A16+NC、pcDNA-Mut-S100A16+NC、pcDNA-Mut-S100A16+miR-711转染MGH-U3细胞。当转染48 h后,通过双荧光素酶报告基因试剂盒检测4组MGH-U3细胞的萤火虫荧光素酶活性和海肾荧光素酶活性,两者比值即为相对荧光素酶活性。
1.7 Western blot检测S100A16和AKT-ERK信号通路蛋白表达水平
磷酸盐缓冲液清洗对照组和大车前苷组MGH-U3细胞,分别加入60 μl含蛋白酶抑制剂的细胞裂解液,4 ℃裂解1 h,离心收集细胞裂解物。煮沸变性后,经8%十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳分离,恒流转膜至硝酸纤维素膜。采用40 g/L脱脂牛奶在常温下封闭2 h,分别加一抗S100A16(1 ∶5 000稀释)、β-actin(1 ∶5 000稀释)、p-AKT(1 ∶2 000稀释)、p-ERK(1 ∶1 000稀释)、c-Myc(1 ∶3 000稀释)、CIP2A(1 ∶3 000稀释),4 ℃反应过夜。次日回收一抗,加入相应的二抗山羊抗兔,常温下反应3 h。浸润增强化学发光液,在Bio-Rad凝胶成像系统中显影。
1.8 统计学方法
采用SPSS 14.0统计软件分析数据,每组实验均重复4次,计量资料均采用均数±标准差表示,多组数据间的比较采用单因素方差分析,两组间数据的比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度大车前苷对MGH-U3细胞活力的影响
CCK-8结果显示,分别采用0,5,10,20,40,80 μg/ml大车前苷处理膀胱癌MGH-U3细胞后,与0 μg/ml比较,随着大车前苷处理浓度的升高,MGH-U3细胞活力显著降低(F=29.16,P<0.05,见图1),40 μg/ml大车前苷处理的抑制效果最明显,选择40 μg/ml大车前苷用于后续研究。
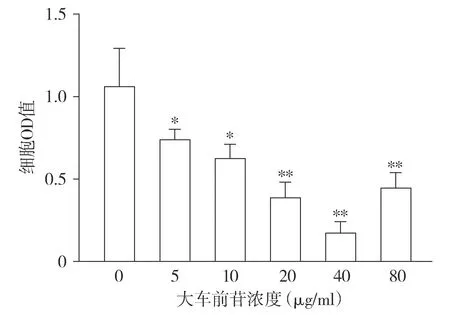
与0 μg/ml相比,*P<0.05,**P<0.01图1 不同浓度大车前苷对MGH-U3细胞活力的影响Figure 1 Effect of different concentrations of plantamajoside on the viability of MGH-U3 cells
2.2 大车前苷对MGH-U3细胞迁移能力的影响
细胞划痕实验显示,与对照组相比,大车前苷组MGH-U3细胞划痕愈合率显著降低(t=7.10,P<0.05,见图2),提示大车前苷可抑制MGH-U3细胞的迁移。
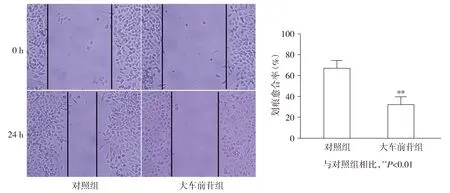
图2 大车前苷对MGH-U3细胞迁移能力的影响Figure 2 Effect of plantamajoside on the migration ability of MGH-U3 cells
2.3 大车前苷对MGH-U3细胞miR-711表达的影响
qRT-PCR显示,对照组和大车前苷组MGH-U3细胞中miR-711的表达分别为1.02±0.28和7.02±0.35,与对照组比较,大车前苷组MGH-U3细胞中miR-711表达显著升高(t=27.03,P<0.01)。
2.4 生物信息学数据库预测miR-711的靶基因
通过miRGator数据库预测miR-711互补结合的靶基因是S100A16,miR-711与S100A16 mRNA序列498-523位点配对结合(见图3)。

图3 miR-711与S100A16 mRNA配对结合的位点Figure 3 Paired binding sites of miR-711 and S100A16 mRNA
2.5 双荧光素酶报告基因实验验证miR-711与S100A16 mRNA的结合
双荧光素酶报告基因实验显示,pcDNA-WT-S100A16+NC组和pcDNA-WT-S100A16+miR-711组相对荧光素酶活性分别为0.97±0.26和0.41±0.15(t=3.79,P<0.01),pcDNA-Mut-S100A16+NC组和pcDNA-Mut-S100A16+miR-711组相对荧光素酶活性分别为1.02±0.17和0.94±0.25(t=0.51,P>0.05,见图4),证实miR-711能够配对结合S100A16 mRNA。
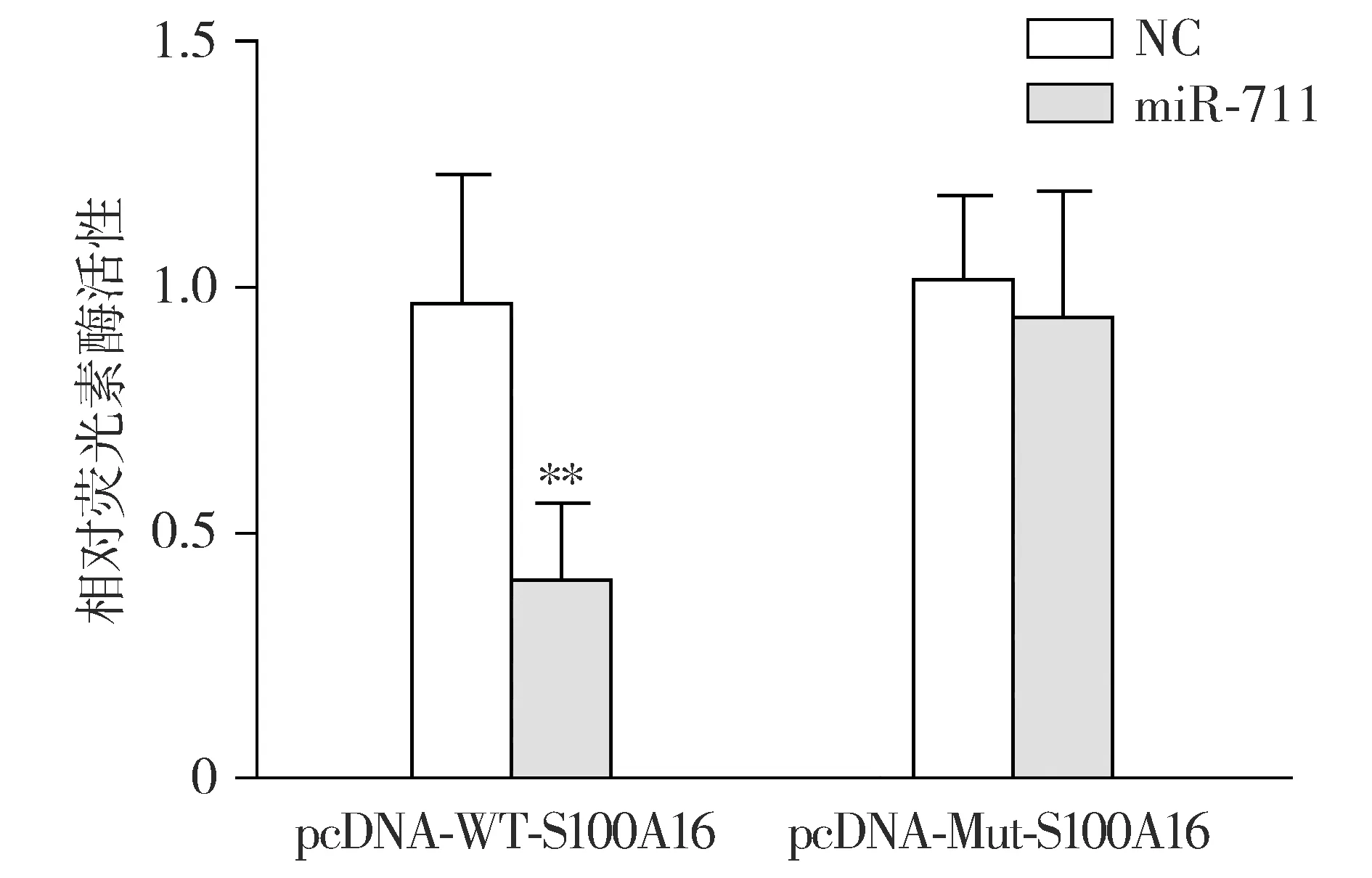
与pcDNA-WT-S100A16+NC组相比,**P<0.01图4 双荧光素酶报告基因实验验证miR-711与S100A16 mRNA的结合Figure 4 Verification of binding of miR-711 to S100A16 mRNA by dual-luciferase reporter gene assay
2.6 大车前苷对miR-711和S100A16 mRNA表达的影响
qRT-PCR结果显示,对照组和大车前苷组MGH-U3细胞中miR-711的表达分别为1.02±0.28和7.02±0.35,大车前苷组MGH-U3细胞中miR-711表达显著增多(t=27.03,P<0.01);对照组和大车前苷组MGH-U3细胞中S100A16 mRNA表达分别为5.85±1.09和1.04±0.18(t=8.68,P<0.01)。提示大车前苷增加miR-711表达后,S100A16 mRNA表达被抑制。
2.7 大车前苷对S100A16和AKT-ERK信号通路蛋白表达的影响
Western blot结果显示,大车前苷处理MGH-U3细胞后,S100A16蛋白表达显著降低,AKT-ERK信号通路蛋白如p-AKT、p-ERK、c-Myc、CIP2A表达显著降低(见图5)。
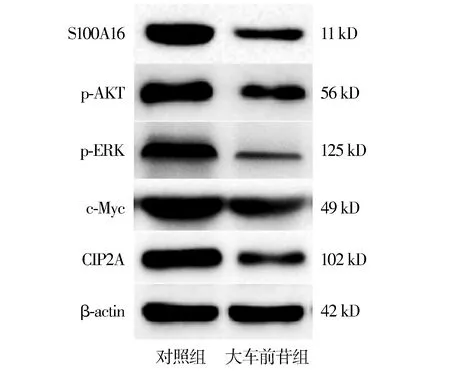
图5 大车前苷对MGH-U3细胞S100A16蛋白和AKT-ERK信号通路蛋白表达的影响Figure 5 Effect of plantamajoside on the expression of S100A16 protein and AKT-ERK signaling pathway proteins in MGH-U3 cells
3 讨论
大量文献报道,中药提取物蝙蝠葛碱、重楼皂苷、槲皮素、和厚朴酚通过抑制多种信号通路的激活,干扰膀胱癌细胞的增殖与转移[10,11]。寻找有效安全的抗癌中药提取物是膀胱癌研究者关注的热点。大车前苷具有广泛的生物学活性[12]。Xiao等[13]研究发现,大车前苷能够抑制高糖诱导的大鼠肾小球系膜细胞的氧化应激、炎症和细胞外基质积累。Wang等[14]研究发现,大车前苷通过抑制肝星状细胞活化和增殖在肝脏中表现出抗纤维化作用。本研究结果显示,不同浓度的大车前苷处理后膀胱癌MGH-U3细胞的活力明显降低,细胞迁移距离明显降低,表明大车前苷能够抑制膀胱癌细胞的增殖和迁移。
微小RNA(miRNA)在中药提取物的抗癌作用方面起到关键作用[15,16]。如芒柄花素通过调控miR-21的表达,抑制膀胱癌细胞的生长和侵袭[17]。miR-711在胃癌、前列腺癌中异常低表达,抑制肿瘤细胞的化疗抵抗、转移,在体内和体外抑制肿瘤细胞的增殖,其低表达往往预示肿瘤患者的预后不良[18]。本研究通过miRGator数据库预测,miR-711可能互补结合的靶基因是S100钙调蛋白A16(S100 calcium binding protein A16,S100A16)。双荧光素酶报告基因实验证实miR-711可与S100A16 mRNA互补结合,S100A16是miR-711的靶基因。S100A16基因在多种肿瘤如胰腺癌、胃癌、非小细胞肺癌中高表达,与肿瘤的耐药性相关,可显著促进肿瘤细胞的迁移和生长,S100A16低表达患者具有更好的预后[19,20]。本研究显示,MGH-U3细胞中miR-711表达升高后,S100A16基因表达显著减少,进一步证明S100A16是miR-711的靶基因。研究指出,S100A16蛋白主要通过激活AKT-ERK信号通路,促进p-AKT、p-ERK、c-Myc、CIP2A蛋白的表达,从而加速肿瘤的转移和生长,对肿瘤的发生和发展起到促进作用[21]。本研究显示,大车前苷处理MGH-U3细胞后,AKT-ERK信号通路蛋白如p-AKT、p-ERK、c-Myc、CIP2A表达显著降低,表明AKT-ERK信号通路转导被抑制,以上结果提示大车前苷通过调节miR-711/S100A16表达发挥作用。
综上可见,本研究证实了大车前苷在膀胱癌MGH-U3细胞增殖和迁移中的抑制作用,其作用机制与miR-711/S100A16信号通路密切相关。大车前苷可能成为膀胱癌临床治疗的中药提取物。

