Maresin 1激活Nrf2信号通路减轻低氧/复氧诱导的心肌细胞损伤
杨 光,钟妮尔,王 瑞,李 炜,安慧仙(陕西省人民医院心血管内二科,西安 70068;西安国际医学中心医院心内二科;通讯作者,E-mail:anhuixian6789@63.com)
急性心肌梗死是一个常见的心血管疾病,其发病率、死亡率和致残率都很高[1,2]。急性心肌梗死是由冠状动脉供血阻断引起的,其产生持续性的缺血和缺氧,继而引起严重的心肌损伤和心肌功能障碍[3,4]。目前,恢复冠状动脉供血是治疗急性心肌梗死的重要手段。但是,血流再灌注会导致心肌的第二次损伤,临床上称之为心肌缺血再灌注损伤[5,6]。氧化应激是心肌缺血再灌注损伤进展的重要因素,活性氧(reactive oxygen species,ROS)的持续积累,会导致心肌细胞凋亡和坏死等一系列不良反应[7-9]。虽然细胞本身具有抗氧化应激系统,但并不能完全有效地抵抗氧化应激产生的损伤。因此,探寻新的抗氧化应激防治手段和药物,对治疗心肌缺血再灌注损伤具有十分重要的意义。
核转录因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是氧化应激的主导调节因子[10,11]。当发生氧化应激时,细胞质中的Nrf2蛋白与抑制分子分离,并向细胞核内迁移。当进入细胞核后,Nrf2蛋白与抗氧化反应元件结合,激活下游基因血红素加氧酶-1(heme oxygenase-1,HO-1)和醌氧化还原酶1(quinone oxidoreductase 1,NQO1)的表达,从而发挥抗氧化和细胞保护等生物学效应。越来越多的研究表明,增强Nrf2的激活可以有效地保护心肌缺血再灌注损伤[12-14]。Nrf2通路的激活受多种机制的调控,许多药物对Nrf2都具有潜在的调控作用[15,16]。因此,探寻可增强Nrf2激活的药物,对心肌缺血再灌注损伤的治疗具有十分重要的意义。
Maresin-1(MaR1)是二十二碳六烯酸的衍生代谢产物,具有良好的抗氧化和抗凋亡活性[17]。研究表明,MaR1对多种组织和器官的损伤具有保护作用[18-21]。有趣的是MaR1对一些器官的缺血再灌注损伤也具有保护作用,包括脑、肝、肾和肺的缺血再灌注损伤[22-25]。目前,关于MaR1是否对心肌缺血再灌注损伤具有保护作用,还没有相关研究。本研究通过心肌细胞的低氧/复氧(hypoxia/reoxyge-nation,H/R)模型来模拟体内心肌缺血再灌注损伤,来检测MaR1对低氧/复氧诱导的心肌细胞凋亡和氧化应激的影响,并探讨其可能的分子作用机制。
1 材料与方法
1.1 材料
MaR1购自美国Cayman Chemical公司(纯度>98%);HL-1小鼠心肌细胞购自北京BeNa Culture Collection公司;DMEM培养基和胎牛血清购自武汉Procell生命科技有限公司;CCK-8、LDH、TUNEL和SOD检测试剂盒购自上海碧云天生物科技有限公司;ROS和MDA检测试剂盒购自西安万类生物科技有限公司;Lab-Tek载玻片小室购自美国Thermo Fisher Scientific公司;兔抗鼠Nrf2抗体、Lamin B1抗体、α-actin抗体、HO-1抗体、NQO1抗体和HRP标记的山羊抗兔IgG购自武汉三鹰生物技术有限公司;Nrf2抑制剂ML385购自上海Selleck公司。
1.2 方法
1.2.1 细胞培养和低氧/复氧模型的建立 HL-1细胞培养在DMEM培养基中,并添加10%的胎牛血清,置于37 ℃、5% CO2的细胞培养箱中培养。将心肌细胞置于厌氧培养箱中(1% O2、5% CO2和94%N2),于37 ℃条件下孵育6 h;将细胞转移至常氧培养箱中(5%CO2和95%空气),于37 ℃条件下孵育12 h,进行低氧/复氧模型建立。
1.2.2 MaR作用研究分组 将细胞分为常氧对照组、低氧/复氧组、低氧/复氧+溶剂组和低氧/复氧+MaR1组。常氧对照组细胞置于37 ℃、5%CO2的细胞培养箱中正常培养。低氧/复氧组细胞仅进行低氧/复氧处理。参考文献报道[18,19],将MaR1的使用浓度确定为50 nmol/L。将MaR1溶于二甲基亚砜,配置成溶液。低氧/复氧+溶剂组中,将溶剂二甲基亚砜加入到细胞培养基中,预处理细胞30 min后,进行低氧/复氧模型建立。低氧/复氧+MaR1组中,将MaR1溶液加入细胞培养基中,至终浓度达到50 nmol/L,预处理细胞30 min后,进行低氧/复氧模型建立。
1.2.3 Nrf2抑制剂研究分组 将细胞分为常氧对照组、低氧/复氧组、低氧/复氧+溶剂组、低氧/复氧+MaR1组和低氧/复氧+MaR1+ML385组。常氧对照组、低氧/复氧组、低氧/复氧+溶剂组和低氧/复氧+MaR1组的细胞处理,参考1.2.2分组处理。低氧/复氧+MaR1+ML385组中,将MaR1和ML385溶液加入细胞培养基中,使MaR1终浓度达到50 nmol/L和ML385终浓度达到5 μmol/L,预处理细胞30 min后,进行低氧/复氧模型建立。
1.2.4 CCK-8实验检测心肌细胞存活率 制备细胞悬浮液并接种到96孔培养板,按照1.2.2分组进行处理。处理完成后,更换培养基,并加入CCK-8溶液(10 μl/孔),置于37 ℃、5% CO2的条件下,继续培养2 h。酶标仪用于测量细胞溶液在450 nm波长下的吸光度。
1.2.5 LDH细胞毒性实验检测心肌细胞上清中LDH的活性 细胞按照1.2.2分组进行处理。处理完成后,收集细胞,进行离心,吸取上清液加入到另一个96孔培养板中(120 μl/孔)。然后,加入LDH检测液(60 μl/孔),混合均匀,在室温黑暗中孵育30 min,然后在490 nm处测量吸光度。
1.2.6 TUNEL实验检测心肌细胞的凋亡率 在Lab-Tek载玻片小室上培养HL-1心肌细胞,按照1.2.2和1.2.3分组进行处理。处理完成后,加入4%多聚甲醛固定细胞30 min。PBS洗涤细胞,加入含0.3% Triton X-100的PBS,室温孵育5 min。PBS洗涤细胞,每孔加入50 μl TUNEL检测液,于37 ℃避光孵育60 min。去除反应液,PBS洗涤细胞,加入DAPI溶液,室温避光孵育10 min,对细胞核进行染色。PBS洗涤细胞后,用抗荧光淬灭封片液封片,采用荧光显微镜进行观察和拍照。使用激发/发射波长488/550 nm,观察绿色荧光(TUNEL染色阳性细胞)。使用激发/发射波长364/454 nm,观察蓝色荧光(DAPI核染色)。
1.2.7 流式细胞术检测心肌细胞中ROS的产生水平 细胞按照1.2.2和1.2.3分组进行处理。采用无血清培养基稀释DCFH-DA探针,使其浓度达到10 μmol/L。待细胞处理完成后,去除旧培养基,加入含有DCFH-DA探针的无血清培养基,置于37 ℃、5% CO2的细胞培养箱中培养30 min。然后,采用荧光酶标仪检测荧光强度。
1.2.8 MDA实验检测心肌细胞中MDA的含量 细胞按照1.2.2分组进行处理。处理完成后,收集细胞,加入PBS进行匀浆,离心后取上清。加入检测试剂,漩涡混匀,95 ℃沸水浴40 min。取出后,用自来水冷却,然后离心取上清,在532 nm处测量吸光度值。
1.2.9 WST-8法检测心肌细胞中SOD的活性 细胞按照1.2.2分组进行处理。处理完成后,收集细胞,加入SOD制备液,充分裂解细胞。吸取20 μl上清,加入160 μl酶工作液和20 μl反应启动液。在37 ℃条件下,反应30 min后,在450 nm下测量吸光度。
1.2.10 Western blotting检测Nrf2、HO-1和NQO-1的蛋白表达 细胞按照1.2.2和1.2.3分组进行处理。处理完成后,收集细胞,采用总蛋白提取试剂盒提取细胞总蛋白。用细胞核蛋白提取试剂盒提取核蛋白。收集样品,测定蛋白质浓度,将蛋白样品和SDS上样缓冲液混合,进行煮沸变性处理。取蛋白样品,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,然后将蛋白质转移到PVDF膜上。将膜浸入5%脱脂奶粉溶液中,并在室温下密封1 h。添加第一抗体(Nrf2抗体的稀释度为1 ∶2 000;HO-1抗体的稀释度为1 ∶1 000;NQO-1抗体的稀释度为1 ∶1 000;α-actin抗体的稀释度为1 ∶1 000;Lamin B1抗体的稀释度为1 ∶3 000),并在4 ℃摇床中培养过夜。清洗膜后,加入HRP标记的山羊抗兔IgG(稀释度为1 ∶5 000),室温孵育1 h。清洗膜后,加入ECL试剂进行显色反应。将膜置于凝胶成像仪内,进行曝光和图像采集。
1.2.11 统计学分析 采用GraphPad Prism 8统计学软件进行数据统计分析和作图。实验结果以平均值±标准差表示。采用单因素方差分析方法分析数据,组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MaR1提高低氧/复氧损伤心肌细胞的存活率
CCK-8实验结果显示,与常氧对照组比较,低氧/复氧组心肌细胞的存活率显著降低(P<0.01);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组心肌细胞的存活率升高(P<0.01,见图1)。LDH实验结果显示,与常氧对照组相比,低氧/复氧组心肌细胞中的LDH活性显著增加(P<0.01);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组心肌细胞中的LDH活性降低(P<0.01,见图1)。
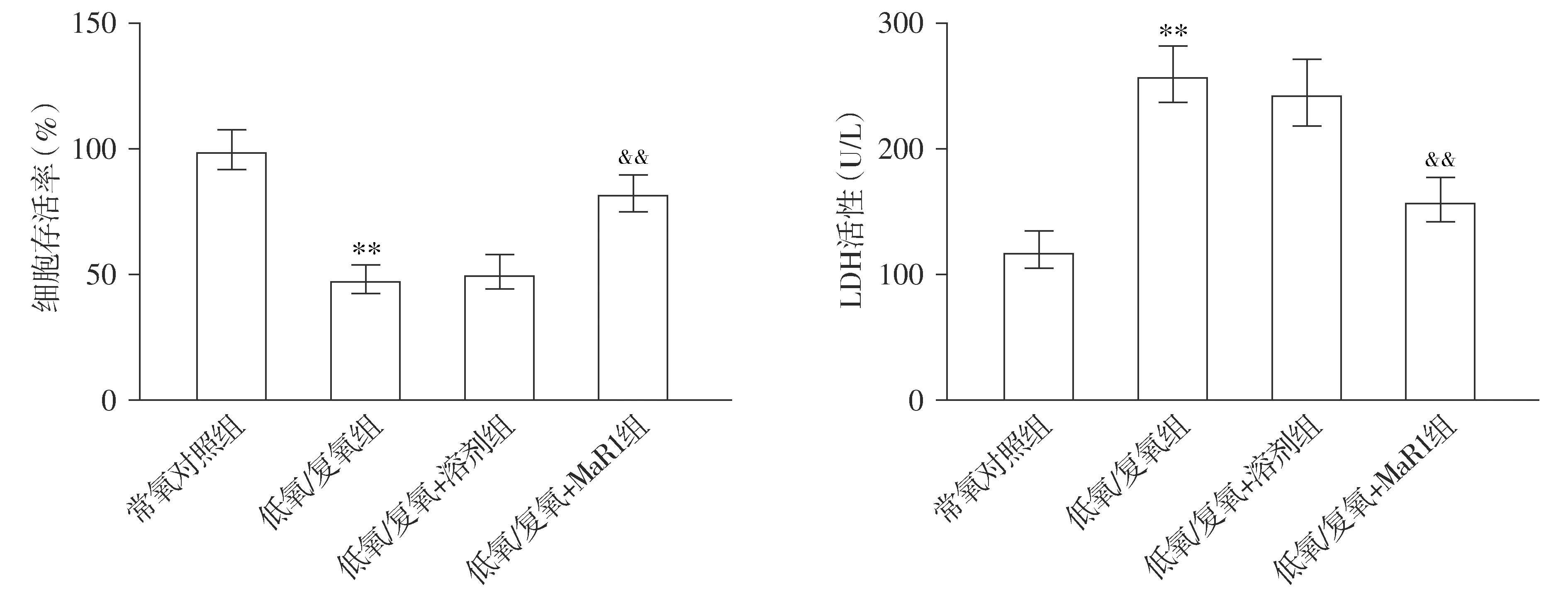
与常氧对照组比较,**P<0.01;与低氧/复氧组和低氧/复氧+溶剂组比较,&&P<0.01图1 MaR1对低氧/复氧诱导的心肌细胞损伤的影响Figure 1 Effect of MaR1 on H/R-induced cardiomyocyte injury
2.2 MaR1减轻低氧/复氧诱导的心肌细胞凋亡
TUNEL实验结果显示,与常氧对照组比较,低氧/复氧组凋亡心肌细胞数量显著增加(P<0.01);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组凋亡心肌细胞数量减少,差异有统计学意义(P<0.01,见图2)。

绿色荧光为TUNEL染色细胞,表示凋亡细胞;蓝色荧光为细胞核,表示总细胞数量;与常氧对照组比较,**P<0.01;与低氧/复氧组和低氧/复氧+溶剂组比较,&&P<0.01图2 MaR1对低氧/复氧诱导的心肌细胞凋亡的影响 (TUNEL染色,×200)Figure 2 Effect of MaR1 on H/R-induced cardiomyocyte apoptosis (TUNEL staining,×200)
2.3 MaR1减轻低氧/复氧诱导的心肌细胞的氧化应激
ROS实验结果显示,与常氧对照组比较,低氧/复氧组心肌细胞中ROS水平显著升高(P<0.01);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组心肌细胞中ROS水平降低(P<0.01,见图3)。MDA实验结果显示,与常氧对照组比较,低氧/复氧组心肌细胞中MDA含量显著增加(P<0.01);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组心肌细胞中MDA含量减少(P<0.01,见图3)。SOD实验结果显示,与常氧对照组相比,低氧/复氧组心肌细胞中SOD活性显著降低(P<0.01);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组心肌细胞中SOD活性升高(P<0.01,见图3)。
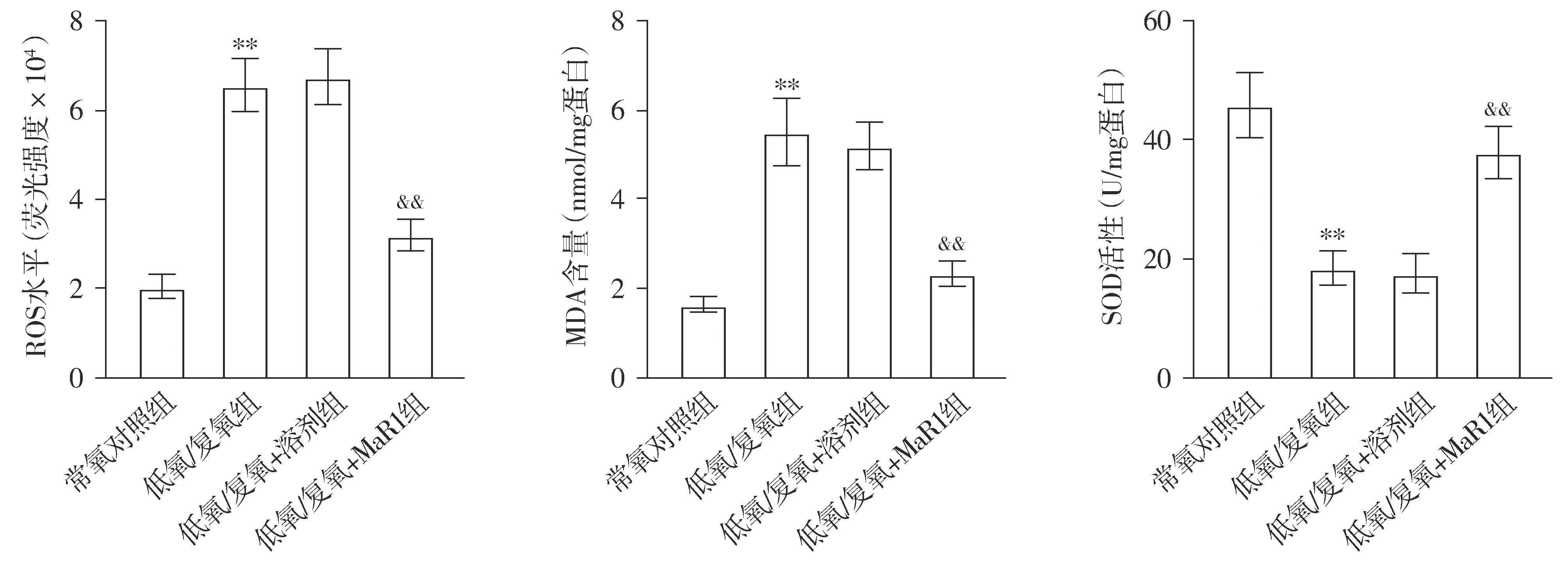
与常氧对照组比较,**P<0.01;与低氧/复氧组和低氧/复氧+溶剂组比较,&&P<0.01图3 MaR1对低氧/复氧诱导的氧化应激的影响Figure 3 Effect of MaR1 on H/R-induced oxidative stress in cardiomyocytes
2.4 MaR1增强低氧/复氧诱导的心肌细胞中Nrf2的激活
Western blotting结果显示,与常氧对照组比较,低氧/复氧组Nrf2蛋白在细胞核中的表达量显著增加(P<0.05,见图4);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组Nrf2蛋白在细胞核中的表达量增加(P<0.01,见图4)。另外,与常氧对照组比较,低氧/复氧组Nrf2下游基因HO-1和NQO1的表达水平显著上升(P<0.05,见图4);与低氧/复氧组和低氧/复氧+溶剂组比较,低氧/复氧+MaR1组HO-1和NQO1的表达水平增加(P<0.01,见图4)。
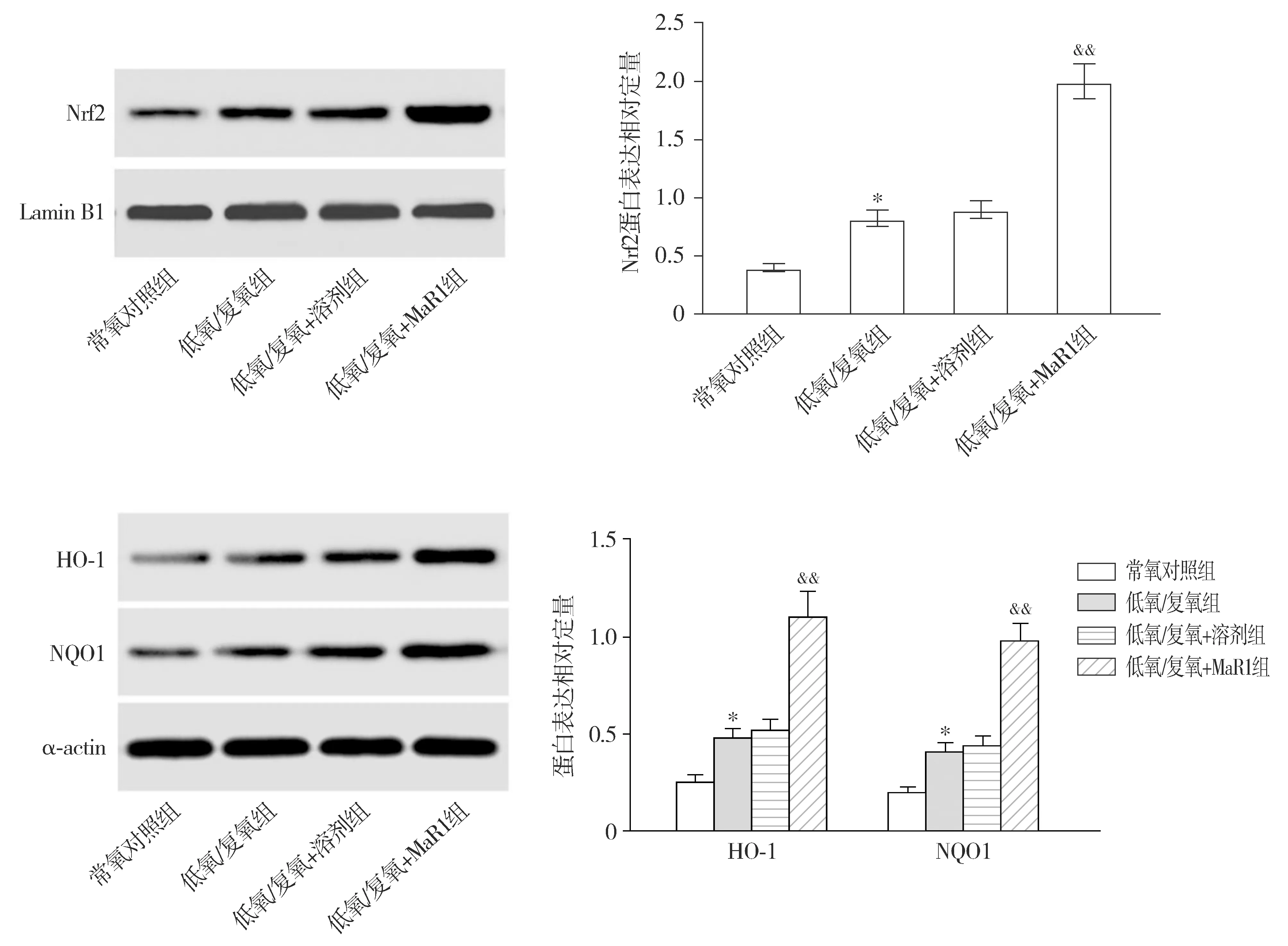
与常氧对照组比较,*P<0.05;与低氧/复氧组和低氧/复氧+溶剂组比较,&&P<0.01图4 MaR1对低氧/复氧处理的心肌细胞中Nrf2激活的影响Figure 4 Effect of MaR1 on Nrf2 activation in H/R-induced cardiomyocytes
2.5 抑制Nrf2逆转MaR1介导的心肌细胞保护作用
为了验证MaR1通过激活Nrf2来抑制低氧/复氧诱导的心肌细胞损伤,我们进一步观察了抑制Nrf2对MaR1介导的心肌细胞保护作用的影响。Western blotting结果显示,与低氧/复氧+MaR1组比较,低氧/复氧+MaR1+ML38组Nrf2蛋白在细胞核中的表达量降低(P<0.01,见图5)。TUNEL实验结果显示,与低氧/复氧+MaR1组比较,低氧/复氧+MaR1+ML38组凋亡心肌细胞数量增加(P<0.01,见图5)。ROS检测实验结果显示,与低氧/复氧+MaR1组比较,低氧/复氧+MaR1+ML38组心肌细胞中ROS水平升高(P<0.01,见图5)。

与常氧对照组比较,*P<0.05,**P<0.01;与低氧/复氧组和低氧/复氧+溶剂组比较,&&P<0.01;与低氧/复氧+MaR1组比较,△△P<0.01图5 Nrf2抑制对MaR1介导的心肌细胞保护作用的影响Figure 5 Effect of Nrf2 inhibition on MaR1-mediated cardioprotective effect
3 讨论
过度的氧化应激反应是心肌缺血再灌注损伤的主要病理变化。探寻新的具有抗氧化活性的药物,来抑制心肌缺血再灌注诱导的氧化应激反应,是目前研究的一个热点方向。本项目中,我们发现MaR1在低氧/复氧心肌细胞模型表现出良好的抗氧化活性,其可有效减轻低氧/复氧诱导的心肌细胞损伤和氧化应激,并进一步证实了其抗氧化活性与增加Nrf2的激活密切相关。
据报道,MaR1对一些器官和组织的损伤,具有良好的保护作用。MaR1可减轻败血症或脂多糖在小鼠中诱导的急性肾损伤[19,26]。Zhang等[27]报道,MaR1可减轻伴刀豆球蛋白A诱导的急性肝损伤。Ma等[20]报道,MaR1对创伤失血性休克引起的急性肺损伤也具有保护作用。另外,MaR1对一些器官的缺血再灌注损伤也发挥保一定的保护作用。在动物模型研究中发现,MaR1可保护肺、肾、肝和脑受到的缺血再灌注损伤[22-25]。目前,关于MaR1对心脏的缺血再灌注损伤是否具有保护作用,还没有相关研究。本研究中,我们通过构建心肌细胞的低氧/复氧模型来模拟体内心肌缺血再灌注损伤,来检测MaR1对心肌缺血再灌注损伤的可能作用。我们的实验结果显示,采用MaR1处理心肌细胞,可显著减轻低氧/复氧诱导的心肌细胞损伤。本研究表明,MaR1对低氧/复氧诱导的心肌细胞损伤具有保护作用。
MaR1的细胞保护效应与其抗凋亡和抗氧化活性密切相关。MaR1可抑制紫外线引起的角细胞凋亡和氧化应激[28]。MaR1可减少脂多糖在肝细胞中诱导的细胞凋亡和ROS的产生[18]。在脂多糖刺激的肾小管上皮细胞中,MaR1处理可抑制细胞凋亡,并且阻断ROS的产生[19]。本研究发现,MaR1可提高低氧/复氧损伤的心肌细胞的存活率,并且抑制其细胞凋亡。另外,在低氧/复氧处理的心肌细胞中,MaR1处理可降低ROS水平和MDA含量,而提高SOD活性,表明MaR1对低氧/复氧诱导的氧化应激具有显著的抑制作用。我们的研究结果表明,MaR1在低氧/复氧损伤的心肌细胞中发挥抗凋亡和抗氧化作用。
MaR1可通过激活Nrf2信号通路来发挥其保护效应。在肺、肾和肝器官的缺血再灌注过程中,MaR1可通过提高Nrf2蛋白的核转移和增加下游基因的表达,来减轻组织损伤[24,25,29]。在结肠炎动物模型中,MaR1可通过增强Nrf2信号通路的激活,来减轻炎症和氧化应激等不良反应[30]。另外,MaR1也可通过增强Nrf2信号通路的激活,来抑制肝纤维化引起的氧化应激[31]。鉴于Nrf2对低氧/复氧心肌损伤也发挥保护作用,本研究进一步验证了MaR1是否通过调控Nrf2来减轻低氧/复氧心肌损伤。本研究结果发现,MaR1可增加Nrf2蛋白在低氧/复氧处理的心肌细胞的细胞核中的表达量,并且增加下游基因HO-1和NQO1的表达。已有研究证实,MaR1可促进Nrf2蛋白的核转移,但其具体分子作用机制并不明确[29,31]。本研究结果表明,MaR1可增加Nrf2蛋白在细胞核中的表达量,并没有直观地显示核转移水平,因此研究结果具有一定的局限性。但是,Nrf2在细胞核中的表达量增加,也可以一定程度上表明Nrf2的激活。采用Nrf2抑制剂处理细胞,则显著逆转MaR1介导的对低氧/复氧处理的心肌细胞的抗凋亡和抗氧化作用。因此,我们的研究表明MaR1对低氧/复氧心肌损伤的保护作用与激活Nrf2密切相关。
综上所述,本研究结果表明,MaR1可减轻低氧/复氧诱导的心肌细胞凋亡和氧化应激,其发挥心肌保护的机制是通过激活Nrf2信号通路实现的。但是,本项目通过细胞模型得到的体外实验数据,需要通过动物模型来进一步验证。未来,我们将建立缺血再灌注心肌动物模型,以验证MaR1对心肌缺血再灌注损伤的保护作用,并进一步阐明其机制,为MaR1的临床治疗应用提供更坚实的理论基础。

