Wee1在小鼠1-细胞期受精卵中的表达和定位
韩 迪,刘智慧,庄 妍,孟 峻(内蒙古医科大学附属医院临床检验诊断学教研室,呼和浩特 00050;山西省中医院检验科;内蒙古医科大学附属医院检验科;通讯作者,E-mail:nmfrank@6.com)
真核生物的生长与繁殖依赖于细胞周期,一次细胞周期完成可以驱使细胞分裂产生两个新的子细胞,典型的细胞周期包括G1、S、G2和M期[1]。在整个细胞周期进程中,不同时期细胞的结构、功能及其物质的含量、定位会发生一系列复杂的改变,从而产生相应的特点,尤其是在G2/M转化的过程中,为适应不同的功能,细胞会产生明显的特征改变。细胞发生G2/M转变的最基本机制是细胞周期蛋白依赖性激酶1(cyclin-dependent kinase,Cdk1)的激活,细胞周期蛋白B1/CDK1的磷酸化控制细胞发生核膜破裂、纺锤体形成和染色质浓缩,这是G2期进入M期的关键步骤[2]。Cdk1激酶的活性受3个因素调控:第一,Cdk1激酶激活的前提是需要与它的细胞周期蛋白伴侣A或B结合形成一个完整的构型,即形成CyclinA/B-Cdk1,从而驱动细胞开始进入M期[3]。第二,细胞周期蛋白H与Cdk7共同介导的保守T环残基磷酸化(例如人Cdk1中的Thr161)是激活Cdk1达到最大活性所必需的环节[4,5]。第三,CyclinB-Cdk1复合物受Cdc25磷酸酶的正向调节[6],Cdc25C磷酸酶激活CyclinB-Cdk1对调节G2/M进程具有重要意义[7],但在CyclinB-Cdk1复合物首次形成后,Wee1/PKMYT1激酶能够通过磷酸化Cdk1的14位苏氨酸和15位酪氨酸抑制该复合物的活性[6]。
Wee1最初是从裂殖酵母中提取出来的一种丝/苏氨酸蛋白激酶[8]。目前通过研究发现Wee1蛋白激酶家族有3个重要成员,即Wee1、PKMYT1和Wee2,其中Wee1被认为是G2检查点激酶,PKMYT1激酶是膜相关酪氨酸和苏氨酸特异性细胞分裂周期蛋白2(cell division control protein 2,Cdc2)抑制激酶,而Wee2是卵母细胞减数分裂抑制激酶[9]。目前关于Wee2的研究已经证实:Wee2主要参与调节生殖细胞(卵母细胞和精子)减数分裂的恢复[10],并且增加Wee2的活性会阻滞1-细胞期受精卵的发育[11]。但Wee1作为Wee1蛋白激酶家族的重要成员,目前关于Wee1的研究,仅有文献报道Wee1在非洲爪蟾成熟的卵母细胞至原肠胚胚胎阶段均有表达,并且Wee1会导致G2期时间延长,延缓非洲爪蟾1-细胞期受精卵的分裂[12]。但在小鼠1-细胞期受精卵中Wee1 mRNA及其蛋白表达和定位的具体研究甚少。
研究细胞周期的进展有助于了解细胞的生长发育情况,在众多的哺乳动物中,小鼠受精卵是研究细胞周期较好的模型之一。故本研究采用qRT-PCR、Western blot以及间接免疫荧光技术检测小鼠1-细胞期受精卵中Wee1 mRNA和蛋白的表达水平,并观察不同时期Wee1蛋白在细胞质和细胞核中的分布情况,探讨小鼠受精卵从1-细胞期到分裂为2-细胞胚胎过程中是否伴随Wee1的表达水平和定位改变,为之后进一步研究Wee1蛋白激酶对小鼠早期胚胎发育的调控提供理论基础,进一步丰富哺乳动物早期胚胎有丝分裂分子调控机制研究的相关理论。
1 材料与方法
1.1 实验动物
采用内蒙古医科大学实验动物中心SPF级昆明系小鼠【SYXK(蒙)2015-0001】,雌鼠:4~6周(体质量20 g左右/只);雄鼠:8周以上(体质量>30 g/只)。
1.2 主要试剂
孕马血清促性腺激素,兽药字:110914564,购自宁波三生公司;人绒毛膜促性腺激素,兽药字:101631282,购自苏州素仕公司;UNIRT-10柱式Trizol总RNA提取试剂盒、BCA法微量蛋白质浓度测定试剂盒均购自上海生工公司;TaKaRa反转录试剂盒购自宝日医生物技术(北京)有限公司;TransStart Tip Green RTPCR SuperMix试剂盒购自北京全式金生物技术有限公司;SDS-PAGE Gel Kit购自上海碧云天公司;Wee1蛋白抗体(ab203236)、β-连环蛋白抗体(ab6276)、山羊抗兔IgG二抗均购自美国Abcam公司;Triton X-100购自飞净生物科技有限公司;Hoechst33258荧光染料、BSA均购自美国Sigma公司。
1.3 小鼠受精卵的采集与培养
取4~6周体质量为20 g左右的雌性昆明系小鼠6~10只,中午12∶00-13∶00,腹腔注射孕马血清促性腺激素10 IU/只。第2天中午12∶00-13∶00时腹腔注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)10 IU/只,并将注射HCG后的雌鼠与8周以上的雄鼠1 ∶1合笼过夜。次日清晨8∶00检栓,处死有阴栓的雌鼠。剪开小鼠腹部,取出输卵管,放入M2培养液清洗。在体视显微镜下撕开输卵管壶腹部,用100 μl移液枪将自然流出的受精卵细胞团转移到0.3%透明质酸酶溶液中,反复吹吸几次,待去除卵丘细胞后,立即使用吸卵管将受精卵转移到M2培养液中,用M2培养液清洗3~5次,去除残留的透明质酸酶、卵丘细胞和其他杂质。将洗干净的受精卵移入提前平衡好的M16培养液中,在37 ℃,5% CO2的培养箱中培养至相应时期以备后期实验使用。HCG注射后11~13 h成熟的卵母细胞在输卵管壶腹部完成受精并进入有丝分裂细胞周期,在注射HCG后19 h收集G1期受精卵,在注射HCG后23 h收集S期受精卵,在注射HCG后27 h收集G2期受精卵,在注射HCG后29 h收集M期受精卵[13]。
1.4 qRT-PCR检测小鼠1-细胞期受精卵中Wee1 mRNA的表达水平
采用qRT-PCR分别检测G1、S、G2、M期1-细胞期受精卵中Wee1 mRNA的表达水平。收集各期受精卵各100个分别放于4个1.5 ml EP管中,按照UNIRT-10柱式Trizol总RNA抽提试剂盒说明书的步骤提取总RNA,并分别测定其在260 nm和280 nm处的吸光度,OD260/OD280值在1.8~2.0之间可用于反转录实验。用TaKaRa反转录试剂盒将提取的总RNA反转录成cDNA,引物由上海生工公司合成(见表1),反应条件为:42 ℃ 15 min,85 ℃ 5 s,1个循环。用TransStart Tip Green RT-PCR SuperMix试剂盒扩增Wee1目的基因,反应条件为:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 15 s,45个循环;95 ℃ 15 s,56 ℃ 30 s,95 ℃ 15 s,1个循环。用β-actin作为内参基因,使用CFX96荧光定量PCR仪检测样本Ct值,采用2-ΔΔCt计算Wee1 mRNA相对表达量。
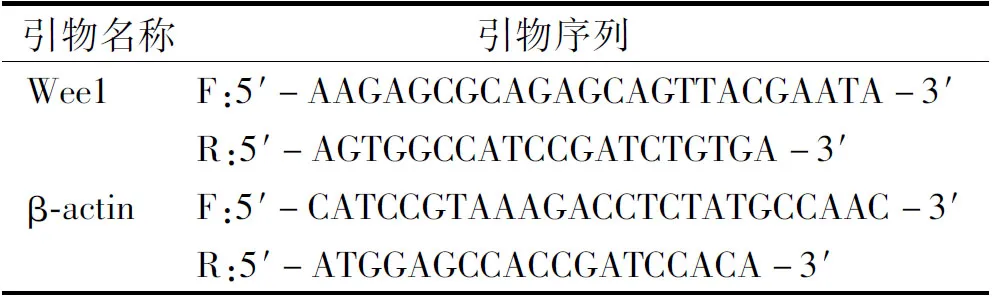
表1 Wee1和β-actin引物序列Table 1 Wee1 and β-actin primer sequences
1.5 Western blot检测小鼠1-细胞期受精卵G1、S、G2、M期Wee1蛋白的表达水平
为研究Wee1蛋白的表达水平伴随小鼠1-细胞期受精卵发育不同时期的变化,采用Western blot检测各时期Wee1蛋白的表达水平。取4个时期受精卵各200个分别放于4个1.5 ml EP管中,经3~4次冻融循环后,分别加入蛋白酶抑制剂和RIPA裂解液(1 ∶100)充分裂解受精卵,4 ℃ 12 000 r/min离心10 min,上清为受精卵总蛋白。用BCA法测定各时期受精卵蛋白浓度。用10% SDS-PAGE分离蛋白质,并转膜至0.45 μm硝酸纤维素膜,用5%脱脂奶粉室温封闭1 h,分别与0.5%脱脂奶粉稀释的Wee1蛋白抗体(1 ∶1 000)和β-连环蛋白抗体(1 ∶1 000)4 ℃孵育过夜,洗膜,与稀释后的山羊抗兔IgG二抗(1 ∶1 000)室温避光孵育1 h,TBST溶液洗涤3次后扫膜,测定Wee1蛋白和内参β-actin蛋白的灰度值。用Image J软件进行灰度值分析,以Wee1/β-actin表示Wee1蛋白的相对表达量。
1.6 间接免疫荧光观察Wee1蛋白在小鼠1-细胞期受精卵发育各期的定位
利用间接免疫荧光技术观察不同时期Wee1蛋白在细胞核和细胞质中的定位情况。分别收集G1,S,G2,M期受精卵各200个,用PBS(含1%聚乙烯醇)浸洗,之后用4%POM固定液室温固定1 h,PBST清洗后用0.1% Triton X-100通透10 min,在含5%BSA的PBS中封闭40 min。将处理完的受精卵转入封闭液稀释的Wee1蛋白抗体(1 ∶1 000)中4 ℃孵育过夜,洗去一抗之后放入FITC标记的山羊抗兔IgG二抗(1 ∶100)室温避光孵育1 h,洗去二抗加入Hoechst33258荧光染料(浓度为25 μg/ml)染色10 min,分别在530 nm、488 nm、260 nm波长处激发标本,在激光共聚焦显微镜下观察核酸的染色情况以及Wee1蛋白在小鼠1-细胞期受精卵发育的各个时期的定位情况。
1.7 统计学方法
2 结果
2.1 小鼠1-细胞期受精卵G1、S、G2、M期Wee1 mRNA的相对表达量及变化
Wee1 mRNA在小鼠1-细胞期受精卵发育过程的4个时期(G1、S、G2、M)均有不同程度的表达(见图1),相对表达量依次为1.107±0.004,1.343±0.007,1.597±0.008,1.177±0.006,可以明显看出从G1至G2期Wee1 mRNA的表达量逐渐增加,在G2期Wee1 mRNA表达量达到最高,而当小鼠1-细胞期受精卵进入M期之后Wee1 mRNA表达量较G2期显著减少,差异具有统计学意义(P<0.01)。
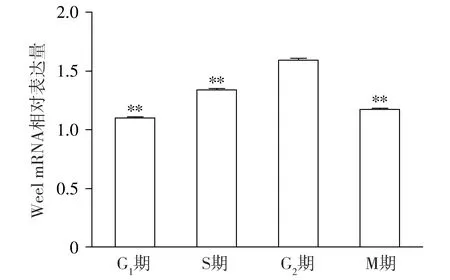
与G2期比较,**P<0.01图1 Wee1 mRNA在小鼠1-细胞期受精卵发育过程中相对表达量Figure 1 Relative expression of Wee1 mRNA in each stage of mouse one-cell stage zygote
2.2 小鼠1-细胞期受精卵G1、S、G2、M期Wee1蛋白的表达结果
小鼠1-细胞期受精卵的发育全程伴随Wee1蛋白表达含量的变化。通过对Western blot结果进行灰度值分析发现:Wee1蛋白的表达量从G1期到G2期呈增加的趋势,但当受精卵进入M期时Wee1蛋白表达量较G2期明显减少,差异具有统计学意义(P<0.01,见图2)。这与1-细胞期受精卵分裂过程中Wee1 mRNA表达水平的变化保持一致。

与G2期比较,*P<0.05,**P<0.01图2 小鼠1-细胞期受精卵发育各期Wee1蛋白表达水平Figure 2 The expression level of Wee1 protein in each stage of mouse one-cell stage zygote
2.3 Wee1蛋白在小鼠1-细胞期受精卵发育各期的定位变化
间接免疫荧光结果显示:小鼠1-细胞期受精卵G2/M的转换过程伴随着Wee1蛋白的核浆穿梭。通过观察从卵母细胞受精到受精卵完成第一次分裂之前各个时期的红色荧光信号可以发现:在G1期和S期,Wee1蛋白定位于细胞质,而在G2早期可以看到部分Wee1蛋白开始入核,到M期细胞核内Wee1蛋白显著增加(见图3)。
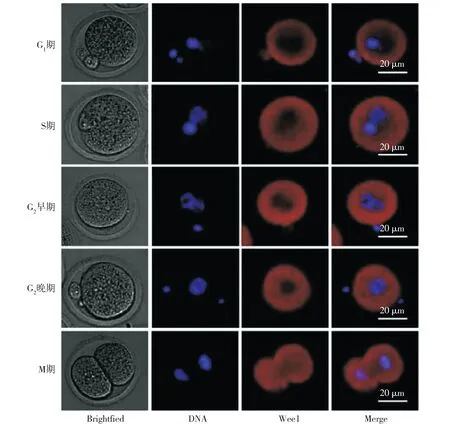
蓝色信号:DNA,红色信号:Wee1图3 Wee1在小鼠1-细胞期受精卵发育的不同时期的定位 (×400)Figure 3 The localization of Wee1 in different stages of mouse one-cell stage zygote (×400)
3 讨论
在裂殖酵母中,Cdc2基因可以调节裂殖酵母细胞G1/S进展和G2/M转变[14]。从酵母到人类,Cdc2是保守的,在哺乳动物中Cdc2同系物也能与细胞周期蛋白结合,后来这些与细胞周期蛋白相关的激酶被命名为“细胞周期蛋白依赖性激酶”或Cdk[15]。Cdk1激酶的激活是由其14位苏氨酸和15位酪氨酸去磷酸化介导的,活化的Cdk1复合物可以驱动有丝分裂[16]。在细胞分裂间期,Wee1可以通过磷酸化Cdk1的15位酪氨酸来抑制Cdk1活性,从而阻止细胞进入有丝分裂,进而延缓细胞周期进程[17]。
已有研究证明:在粟酒裂殖酵母细胞的细胞周期进程中,Wee1以促细胞分裂因子(mitosis promoting factor, MPF)依赖的方式聚集在纺锤体极体(spindlepoleboby, SPB)的表面,并可以通过改变SPB亚细胞定位调节细胞进入有丝分裂[18]。目前有研究发现在小鼠1-细胞期受精卵发育的过程中伴随着Wee1B蛋白的核浆转位[19]。但是尚不明确Wee1在哺乳动物细胞周期不同时期的表达含量是否存在变化,也不能确定Wee1蛋白激酶是否通过改变其亚细胞定位对哺乳动物细胞有丝分裂过程产生一定影响。
小鼠受精卵是研究哺乳动物细胞周期天然的细胞模型,研究早期胚胎发育的分子调控机制,有助于克服胚胎早期发育障碍,为不孕不育症的治疗提供新思路。探究小鼠受精卵发育过程中特定基因的表达和定位规律,可以应用于人类辅助生殖,通过对特定基因的干预,缩短受精卵在体外培育的时间,尽早将胚胎植入子宫从而降低外界因素对受精卵发育产生的不良影响,使胚胎得到更好的发育。
在本研究中,我们通过qRT-PCR和Western blot技术检测小鼠1-细胞期受精卵发育全过程各个时期(主要是G1、S、G2、M期)Wee1 mRNA和Wee1蛋白的表达,并且通过间接免疫荧光技术观察Wee1蛋白的亚细胞定位。我们发现小鼠1-细胞期受精卵G2/M转换过程伴随Wee1 mRNA和蛋白的下调。在小鼠1-细胞期受精卵发生有丝分裂的过程中存在Wee1蛋白激酶亚细胞的重新定位。这提示我们Wee1蛋白激酶可能参与调控小鼠早期胚胎的发育,本课题组今后将通过显微注射构建的Wee1表达载体(野生型、突变型),具体研究Wee1对小鼠1-细胞期受精卵卵裂率的影响;并通过Western blot技术检测Wee1的磷酸化/去磷酸化与小鼠1-细胞期受精卵G2/M转换(Cdc2-Tyr15脱磷酸化)发生的顺序,进一步证实Wee1是否通过磷酸化/去磷酸化在哺乳动物细胞周期进程中发挥作用。据报道,在爪蟾中14-3-3蛋白与Wee1蛋白激酶的结合与解离可以控制Wee1蛋白激酶在不同时期发生核浆转位[20]。这说明Wee1蛋白激酶也可能通过与其他调节细胞周期的分子(如Cdc25B、Cdc14A、PKA、14-3-3ε蛋白)共同作用,参与调节小鼠1-细胞期受精卵的发育,这也将是本课题组今后研究的方向之一。

