干涉HOTAIR对HepG2肝癌细胞增殖和周期的影响
车红磊,唐海灵,党 琳(陕西中医药大学基础医学院生物化学教研室,咸阳 7046;西安市中心医院消化内科;通讯作者,E-mail:dlinmen@63.com)
肝癌是一种发病率和死亡率均较高的恶性肿瘤,亚洲国家尤其我国是肝癌高发地区。针对肝癌的治疗方法包括手术、化疗、肝移植、经导管化疗栓塞术等,但肝癌发现时经常是中晚期,上述治疗方法很难将肿瘤细胞彻底消灭,多数患者最终会出现肿瘤的复发和远处转移,因此肝癌的临床治疗效果一直不理想[1]。进一步深入揭示肝癌的发生机制,对肝癌的治疗思路将提供有益启发。
长链非编码RNA(long noncoding RNA,lncRNA)指的是核苷酸数目超过200且不编码蛋白质的RNA分子。虽然lncRNA不编码蛋白质,但其可通过多种机制调控特定基因的表达状态,涉及的调控机制包括表观遗传调控、转录和转录后调控、翻译和翻译后调控等[2]。lncRNA通过调控基因表达从而影响组织细胞的生物学功能,并广泛参与多种疾病的发生发展过程。近些年来,大量研究表明lncRNA与肿瘤的关系极为密切,已成为肿瘤领域的研究热点[3]。HOX转录物反义RNA(HOX transcript antisense RNA,HOTAIR)定位于人染色体12q13.13,长度2.2 kb。许多研究发现HOTAIR与多种肿瘤的关系紧密,与肝癌的关系尤为密切[4]。肝癌组织中HOTAIR水平显著升高,与TNM分期、门静脉癌栓、肿瘤大小和预后等指标密切相关[5]。HOTAIR能够募集多梳抑制复合物2(PRC2)或通过竞争吸附调控微小RNA(miRNA)的表达,进而促进肝癌细胞的增殖、侵袭、上皮-间质转化(EMT)等,具体分子机制有待深入揭示[6]。本研究以肝癌细胞系为研究对象,观察干涉HOTAIR对HepG2肝癌细胞增殖和周期的影响,为后续深入研究奠定基础。
1 材料与方法
1.1 主要仪器
CO2细胞培养箱(Thermo Scientific,美国);低温离心机Centrofriger BL-II(JP,西班牙);多功能酶标仪(Tecan,瑞士);ABI7500荧光定量PCR仪(ABI,美国);FACSCalibur流式细胞仪(Beckman Coulter,美国)。
1.2 主要试剂
DMEM高糖培养基(Gibco,美国);胎牛血清(Gibco,美国);TRIzol和Lipofect2000脂质体(Invitrogen,美国);HOTAIR引物、干涉序列及阴性对照(上海吉玛制药技术有限公司);MTT检测试剂盒(上海信裕生物工程有限公司);SYBR Premix Ex Taq荧光定量PCR(RT-PCR)检测试剂盒(宝生物工程有限公司);细胞周期检测试剂盒(上海碧云天生物技术有限公司)。
1.3 细胞培养
选取人正常肝细胞系Chang liver(人张氏肝细胞)和HepG2、SMMC-7721、Bel-7402、MHCC97肝癌细胞系用于本实验。细胞系由本室保存,复苏后接种于培养皿中,加入含10%胎牛血清的DMEM高糖培养基,置于37 ℃、5% CO2的孵箱中培养,每隔2 d传代一次。
1.4 siRNA转染HepG2细胞
收集对数生长期的HepG2细胞接种于6孔板中,每孔3×105个细胞,培养24 h,然后分别将3个HOTAIR的siRNA(siRNA#1、siRNA#2、siRNA#3)及阴性对照(NC)用Lipofect2000脂质体转染至HepG2细胞中,继续培养24 h,收集细胞用于检测HOTAIR的干涉效果。HOTAIR的3个siRNA靶序列分别为5′-TGGAATGGAACGGATTTAGAAGC-3′(siRNA#1),5′-CAGAGAAAAGGCTGAAATGGAGG-3′(siRNA#2),5′-CAGAGGTTTATGTATTTTTATTT-3′(siRNA#3)。
1.5 RT-PCR检测HOTAIR表达
收集上述正常培养的5种细胞和分别转染siRNA#1、siRNA#2、siRNA#3及NC的HepG2细胞,采用TRIzol法提取总RNA,反转录为cDNA,然后进行RT-PCR反应,反应条件为95 ℃ 5 min,95 ℃ 10 s,55 ℃ 30 s,40个循环。HOTAIR的上下游引物序列分别为5′-GGTAGAAAAAGCAACCACGAAGC-3′和5′-ACATAAACCTCTGTCTGTGAGTGC C-3′,GAPDH内参的引物序列分别为5′-GCTGAGAAC-GGGAAGCTTGT-3′和5′-GCCAGGGGTGCTAAGCAG-3′。
1.6 MTT实验检测细胞活力
分别制备NC组和siHOTAIR组(选用siRNA#1、siRNA#2、siRNA#3中干涉效果最强的进行实验)的单细胞悬液,每组设置5个复板。以每孔1 000个细胞接种至96孔板中,每孔培养液体积200 μl,分别于1,2,3,4,5 d后取出一个复板进行MTT实验。向每孔加入20 μl的MTT溶液,继续孵育4 h,吸出培养孔中的上清液,每孔加入150 μl的DMSO,振荡10 min,用多功能酶标仪检测490 nm波长处的吸光度,绘制生长曲线。
1.7 流式细胞术检测细胞周期
将干涉HOTAIR的siRNA和阴性对照分别转染HepG2肝癌细胞系,转染后继续培养72 h,然后收集细胞并计数,取1×105个细胞,经预冷的PBS洗涤后,向细胞沉淀中加入70%乙醇溶液重悬细胞,固定30 min,加入PI染色液,避光孵育30 min,然后进行流式细胞仪检测。
1.8 统计学分析
2 结果
2.1 肝癌细胞系中HOTAIR的表达
RT-PCR的检测结果表明,与Chang liver细胞比较,HepG2、SMMC-7721、Bel-7402和MHCC97肝癌细胞系中HOTAIR的表达量均有所增高,其中HepG2细胞系中的表达增高最显著,是Chang liver细胞的3.6倍(P<0.01,见图1)。
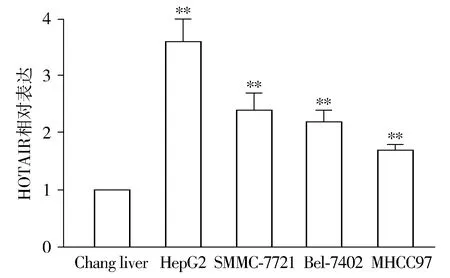
与Chang liver比较,**P<0.01图1 肝癌细胞系中HOTAIR的表达Figure 1 Expression of HOTAIR in liver cancer cell lines
2.2 靶向HOTAIR的干涉效果
由于HOTAIR在HepG2肝癌细胞系中的表达增高最显著,因此选择HepG2细胞系为模型,通过siRNA干涉以降低HepG2细胞中HOTAIR的表达水平。实验结果显示,3对siRNA序列都有明显的干涉效果(P<0.01,见图2),siRNA#2抑制率达到70%,因而选择siRNA#2进行下一步实验。
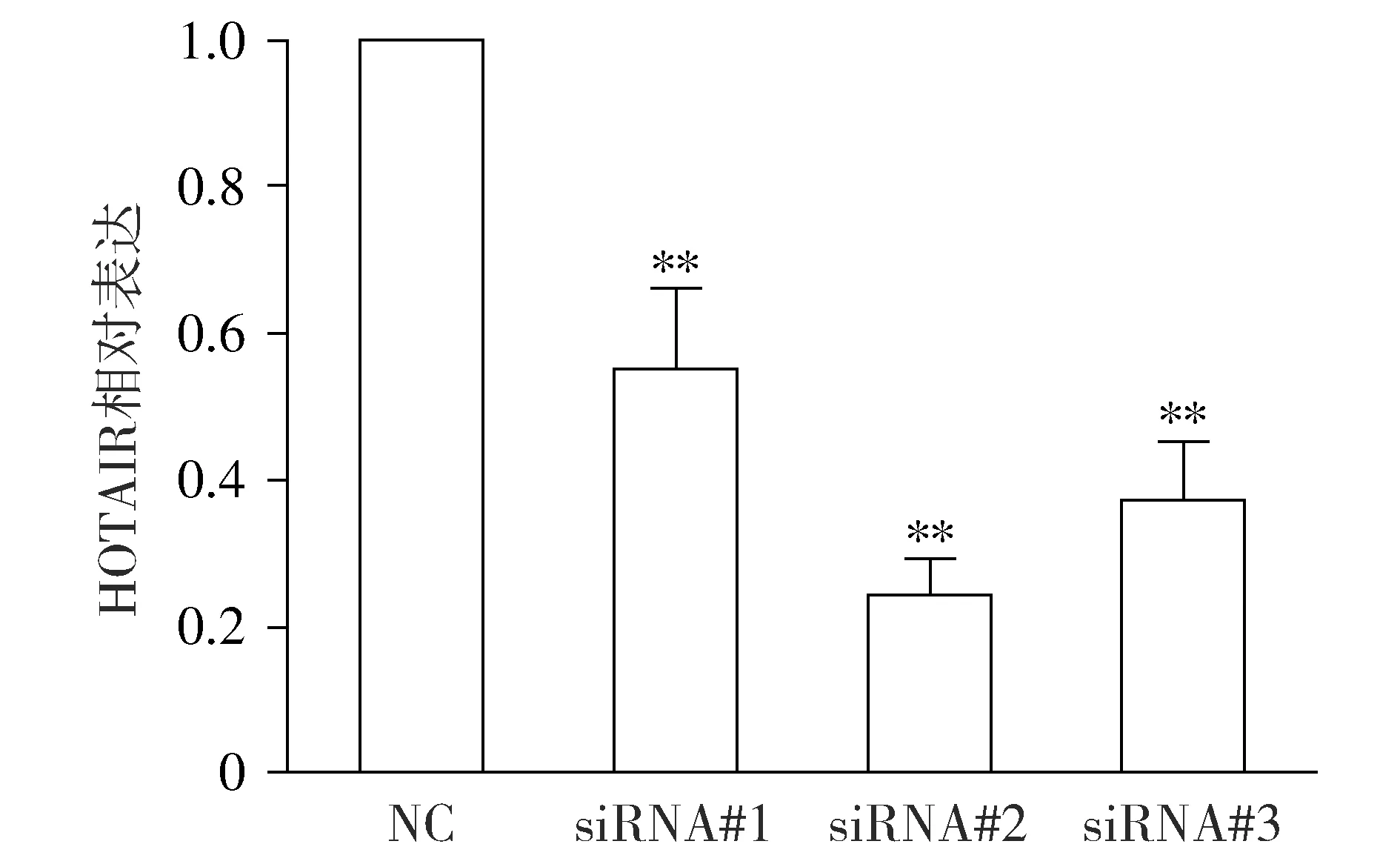
与NC组比较,**P<0.01图2 靶向HOTAIR的干涉效果Figure 2 Interference efficacy of targeting HOTAIR
2.3 干涉HOTAIR对HepG2细胞增殖的影响
选择siRNA#2干涉HOTAIR并检测HepG2肝癌细胞增殖能力变化。实验结果表明,与NC组比较,siHOTAIR组HepG2肝癌细胞的生长增殖显著降低,第5天的结果最为明显(P<0.01,见图3,4),这表明干涉HOTAIR可以抑制HepG2细胞的增殖能力。
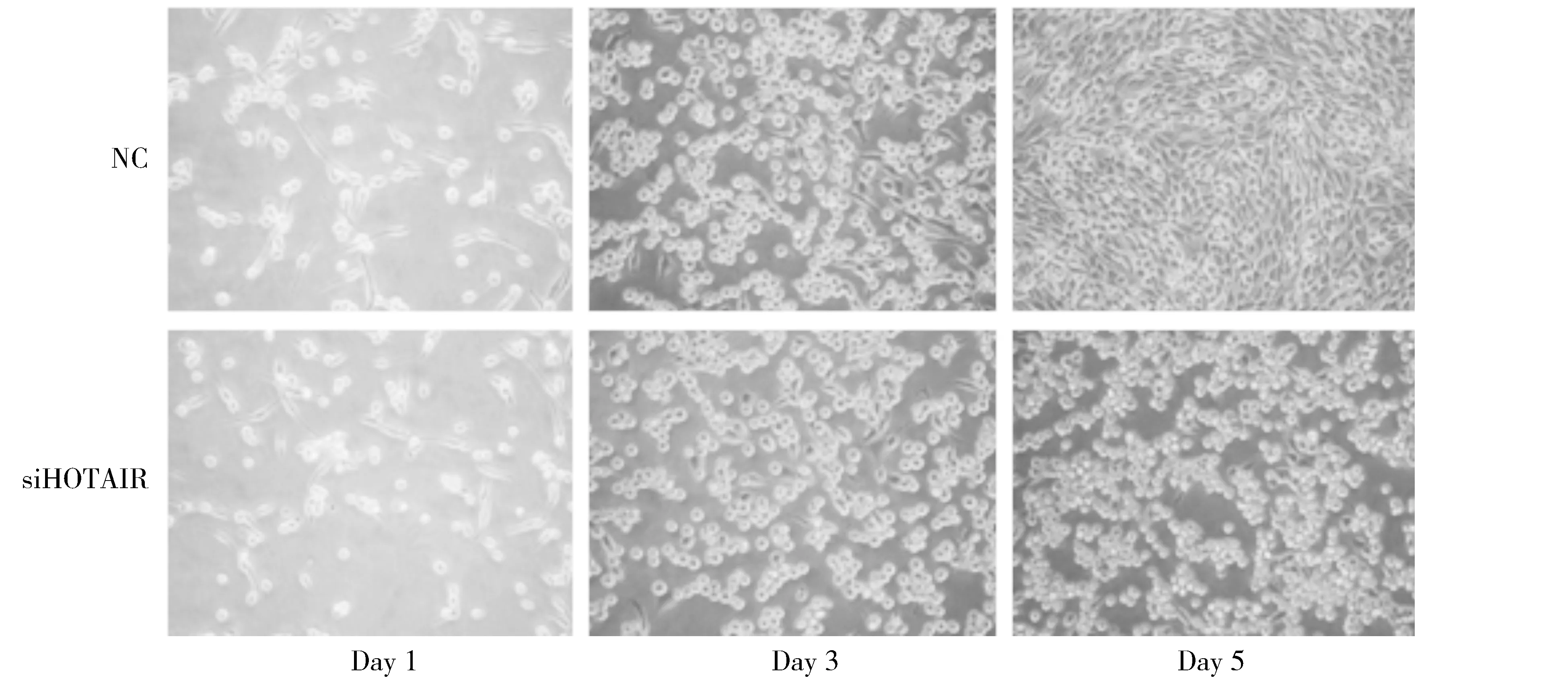
图3 干涉HOTAIR后HepG2细胞镜检结果 (×100)Figure 3 Microscopic results of HepG2 cells transfected with HOTAIR siRNA (×100)
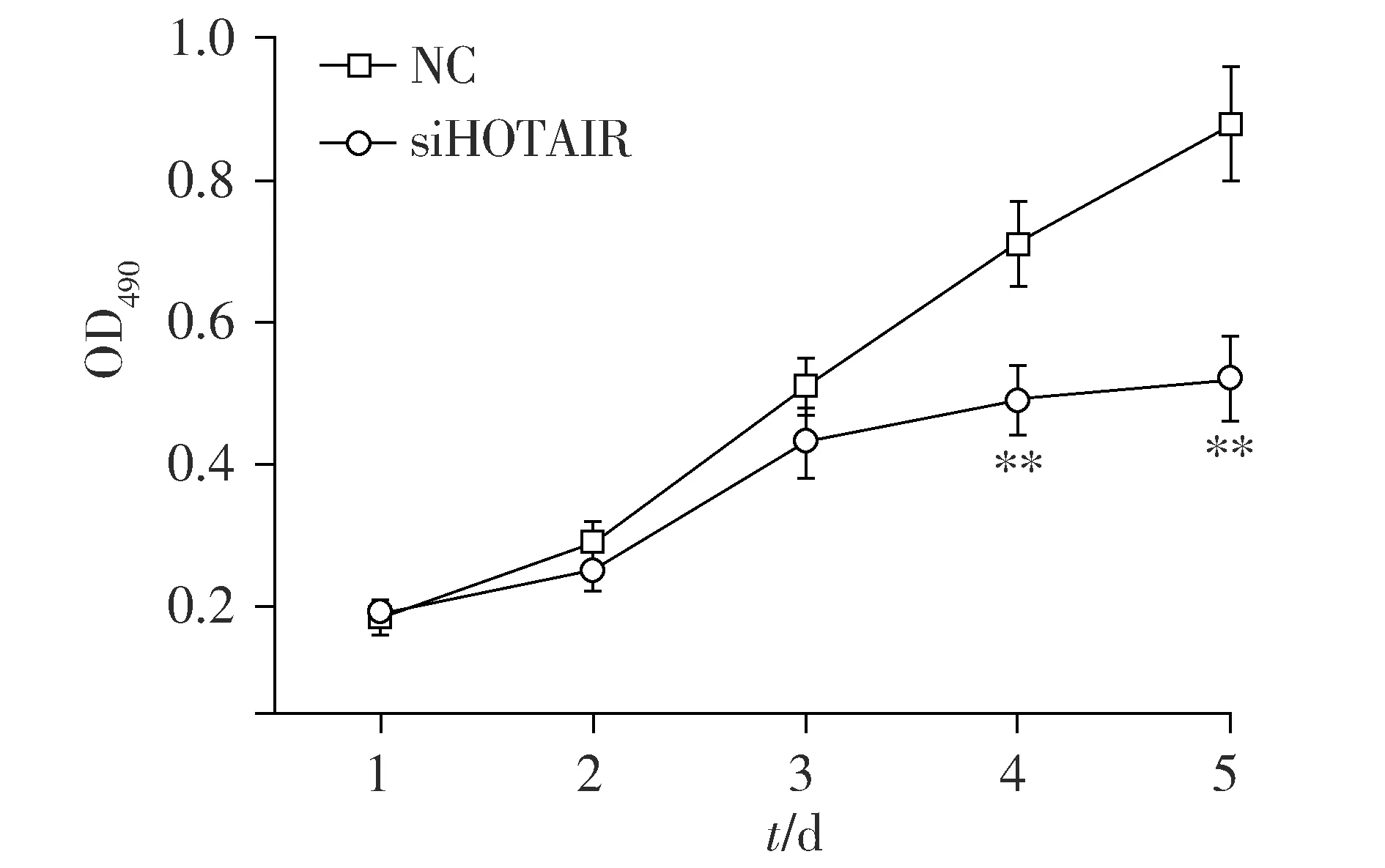
与NC组比较,**P<0.01图4 干涉HOTAIR对HepG2细胞增殖的影响Figure 4 Effects of HOTAIR siRNA on HepG2 cell proliferation
2.4 干涉HOTAIR对HepG2细胞周期的影响
选择siRNA#2干涉HOTAIR并检测HepG2肝癌细胞周期变化。结果显示,与NC组比较,干涉组(siHOTAIR)中HepG2肝癌细胞的G1期细胞比例显著增高(P<0.01),S期细胞比例显著降低(P<0.01,见图5),这表明干涉HOTAIR可导致HepG2发生细胞周期阻滞。
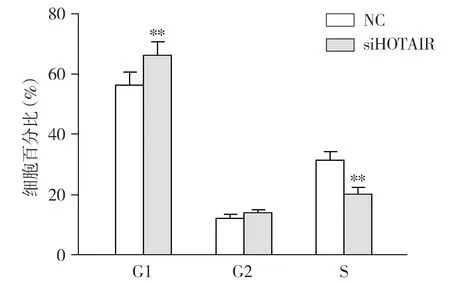
与NC组比较,**P<0.01图5 干涉HOTAIR对HepG2细胞周期的影响Figure 5 Effects of siHOTAIR on HepG2 cell cycle
3 讨论
长链非编码RNA在肿瘤发生发展中的作用和机制是近年来的研究热点前沿。HOTAIR是第一个发现的反义转录长链非编码RNA,目前的研究表明HOTAIR和多种肿瘤的关系紧密,包括肺癌、乳腺癌、结直肠癌、肝癌、胃癌、食管鳞状细胞癌、视网膜母细胞瘤等[4]。在这些肿瘤组织细胞中均发现HOTAIR的表达水平显著升高,和肿瘤细胞的恶性增殖、远端侵袭、放化疗敏感性以及患者预后等密切相关[7]。
在肺癌中研究发现,HOTAIR能够促进细胞周期由G1期向S期过渡,从而促进非小细胞肺癌细胞增殖[8]。KEGG通路分析表明,HOTAIR和细胞周期通路中E2F1、CDK4、CDK6的表达显著正相关[8]。在视网膜母细胞瘤中发现,HOTAIR在Y79和HXO-RB44肿瘤细胞中表达增高,干涉HOTAIR可诱导细胞周期阻滞、抑制细胞增殖、促进细胞凋亡[9]。深入研究发现,HOTAIR作为内源竞争RNA(competing endogenous RNAs, ceRNA),通过结合miR-20b-5p导致RRM2表达增高,从而使得PI3K/AKT信号通路过渡激活,最终促进细胞增殖[9]。在乳腺癌细胞系MCF-7中发现,干涉HOTAIR显著抑制了细胞增殖,并诱导细胞发生G1期阻滞[10]。在食管鳞状细胞癌细胞中发现,HOTAIR的表达明显增高,通过内源竞争结合miR-1,导致cyclin D1表达增高,从而促进细胞周期运行[11]。上述研究表明,HOTAIR在许多肿瘤细胞中表达增高,可以通过多种分子机制诱导细胞周期运行,从而促进细胞增殖,而干涉HOTAIR能够抑制该效应。
在肝癌中研究发现,HOTAIR表达显著升高,与肝癌的TNM分期、门静脉癌栓、肿瘤大小和预后等指标密切相关[5]。HOTAIR具有促进肝癌细胞增殖、侵袭和上皮-间质转化(EMT)等作用,目前发现其机制主要是通过调控特定miRNA的水平实现的[6]。HOTAIR通过两种方式调控miRNA的表达水平,一是间接调控,即通过募集PRC2形成沉默复合物,靶向miRNA的启动子区,从而抑制其转录表达,已发现的miRNA包括miR-34a、miR-145、miR-122、miR-218等;二是直接调控,HOTAIR通过竞争吸附miRNA实现调控作用,已发现的miRNA包括miR-217、miR-214-3p、miR-23b-3p和miR-1等[6]。除了调控miRNA的表达水平,HOTAIR还可以激活JAK1/STAT3信号通路促进肝癌生长[12]。此外有研究发现,HOTAIR能够抑制细胞周期蛋白D1(cyclin D1)的表达,从而抑制Huh7肝癌细胞增殖,并导致细胞周期阻滞[13]。虽然HOTAIR在肝癌中的作用及机制研究越来越多,但并未完全阐明,是否有别的作用和机制有待进一步揭示。
本研究发现HOTAIR在多种肝癌细胞系中表达增高,干涉HOTAIR抑制HepG2细胞增殖,同时导致细胞周期发生G1期阻滞。此研究结果和上述有关HOTAIR在肝癌中的研究结果一致,但本研究缺乏深入的机制研究,在此基础上,后续研究有必要进一步观察干涉HOTAIR对肝癌细胞侵袭和迁移的影响,深入揭示其中的分子机制和信号通路。

