化学品风险评估新技术方法的发展及应用
贾 栗,范瑞棋,,张婉君,,陈义强,苑晓燕
(1.解放军疾病预防控制中心,北京 100071;2.中国农业大学动物科技学院动物营养学国家重点实验室,北京 100193)
传统的化学品风险评估测试主要以动物模型为研究对象,随着实验动物3R原则的不断深入实施,以及2007年美国国家科学院开创性文件《21世纪的毒性测试:愿景与策略》(Tox21)和2009年《科学与决策:推进风险评估》的发表,再到2019年美国环境保护署(Environmental Protection Agency,EPA)发布将于2035年停止进行或资助针对哺乳动物开展的研究均表明,近20年来,毒理学测试方法已从传统的动物实验转向非动物替代方法的开发和运用。新的化合物不断涌现,替代方法产生了大量体外测试数据,迫切需要开发快速高效的用于化学品风险评估的新技术方法(new approach methodologies,NAM)[1]。美国EPA 在 2018年定义了NAM的范围:包括各种非动物新技术、替代策略、理想的预测模型及大量化学危害和风险评估产生的相关数据和信息。这些新数据复杂且多样化,来自高通量测试、毒代动力学测试、分子流行病学、组学技术、暴露科学、计算化学和新动物模型等[2]。NAM目前主要应用于快速高效地识别化学品的危害特征并收集剂量反应数据,对大量的化学品进行优先顺序排列,从中筛选出需要深入测试评估的化学品,大大提高了化学品风险评估的效率。NAM的大规模开展和实施为化学品的危害表征和风险评估提供了适合的科学基础,为更多与人类相关的安全评估提供信息。本文就目前国内外开发的NAM及其在化学品风险评估方面的应用、NAM整合测试策略、存在问题等方面进行综述,为我国化学品风险评估NAM的开发及应用提供参考。
1 适用于化学品风险评估的NAM
为了应对不断涌现的化学品风险评估及大量的信息整合处理工作,多种NAM应运而生。目前国内外比较关注的用于化学品风险评估的NAM主要有计算方法学、体外测试策略和体外生物动力学等。
1.1 计算方法学
计算方法学是近年来毒理学非常活跃的研究领域,具有巨大的发展潜力。几乎所有的毒理学研究和风险评估都使用了计算机工具,其中包括庞大的化学品毒理学特征数据库、用于模拟生物系统和分子动力学的计算机模型以及用于预测毒性的建模软件[3]等。
交叉参照(read-across)NAM应用最广泛的是填充化学品危害特征及风险评估中的数据空白。交叉参照是一种数据填充技术,可用一些化学品的终点信息数据来预测另一种(一类)具有相似特性的化学品的终点信息,可免除目标物质的体内试验,具有速度快、费用低的特点[4]。其作为非测试方法中的重要策略已被欧盟和美、加、日等多国的管理机构所接受,在我国《新化学物质申报登记指南》中也被认可[5]。目前已开发并使用的交叉参照模型主要有OECD QSAR Toolbox,Toxmatch和ToxRead等。欧盟EU-ToxRisk项目开发了特定的交叉参照案例评估这种方法的适用性,如通过使用计算数据进行化学品危害表征,通过基于生理的毒代动力学模型(physiologically based toxicokinetic,PBTK)解决化合物的动力学/生物利用度在人体的差异性等[6]。如用类似物的已知毒性数据来预测2-乙丁酸90 d重复毒性试验,通过有害结局路径(adverse outcome pathway,AOP)框架网络确定脂肪肝变性的关键分子事件,并用相应的体外测试来支持交叉参照的假设,通过证据权重方法辅助分析不确定性,然后进行人体等效剂量的计算,以推导出风险评估的起点(point of departure,PoD)。另有案例选择一系列具有体内发育毒性的2-甲己酸类似物来预测2-甲己酸的生殖发育毒性,并用斑马鱼胚胎实验、小鼠胚胎干细胞实验、基于诱导多能干细胞神经发育模型和PBTK模型等进行测试,探讨类似物是否能准确预测各自的体内发育毒性,进一步探讨结构与发育的关系。有研究者使用基于化学结构分析和近百万个化学性质危害数据开发的交叉参照模型对9个化合物危害终点进行分类,准确度达到70%~95%[7]。交叉参照已被广泛用于预测复杂毒性和不良反应。然而,交叉参照的可靠性值得进一步规范,需要整合多个NAM测试结果来验证,因此需要更复杂的预测模型或证据权重评估程序来整合相关信息。
1.2 体外测试方法
高通量转录组学(high-throughput transcriptomics,HTTr)筛查技术是较早开展的体外替代方法,在2007年发布的《21世纪的毒性测试:愿景与策略》中就明确了开发和利用人类细胞体外模型,开发基于通路的与毒性和计算机模型相关的细胞检测方法。随着高通量技术的发展,转录组学技术已被生物医学领域广泛运用。早期转录组学技术用于研究化学暴露下基因组水平扰动,为化学品毒性作用模式(modes of action,MOA)及分类提供支持。近年来,剂量依赖HTTr的应用为化学品早期筛选提供了更加全面和高效的方法,可支持计算生物信号通路发生扰动的PoD。有人提出,基于HTTr数据的剂量反应模型可被纳入风险评估框架,作为化学品危害评估的一种手段[8]。随着HTTr的不断应用和发展,科学家们在此基础上开发出更多新颖的、适用性强的方法进行化学品危害评估。Harrill等[9]以MCF-7细胞为模型,采用测序读出模板核苷酸(TempO-Seq)分析方法对44种环境化合物进行HTTr分析,并开发了一种新的基于基因表达特征的剂量反应建模方法,以确定基因表达开始出现扰动的阈值。TempO-Seq技术特点在于与细胞裂解物相容性较好、无需额外RNA纯化、仅需皮克量RNA就能生成多重测序文库,适用于高通量环境化学品危害评估。我国学者新开发的剂量依赖的人简化转录组学(human reduced transcriptomics,RHT)方法可评估基于通路扰动的单一化学品,并开发了基于单一化学品预测模型的混合物的基准效应评估方法,这种方法可对环境化学物/混合物干扰的生物信号扰动进行定性和定量评估[10]。另有研究者用大型公共毒理基因组数据库(TG-GATEs)已发表数据开发了一个基于web的交互式浏览器MoAviz,通过可视化方式展示化学品扰动的信号通路,为识别化学品毒作用模式提供了系统框架[8]。体外转录组学技术会产生大量复杂数据集,如何收集、评估和解释转录组学数据具有非常大的挑战性,如如何实现可视化和解释数据、如何选择细胞和组织,需要测试细胞或组织的数量、是否需要增加其他测试以获得更具生物学相关性的代表性数据等[8]。针对上述问题,美国EPA以MCF-7细胞为模型,使用全细胞转录组学对1000多种化合物进行剂量-效应评估的案例及Tox21中高通量转录组学项目的研究案例,均可提供有价值的参考[11-12]。随着基于组学的NAM的发展,这些都是需要进一步探讨的问题。
微生理系统(microphysiological system,MPS)有时也被称为器官芯片或人体芯片,是指在芯片上构建的器官生理微系统,它以微流控芯片为核心,结合细胞生物学、生物材料和工程学等多种方法,在体外模拟构建多种组织器官微环境。这种微缩的组织器官模型可在体外接近真实地重现人体器官的生理、病理活动,预测人体对外界刺激的反应,成为近年来发展迅速的前沿科学。美国于2011年率先启动人体芯片(human-on-chip)计划后,欧洲部分国家也纷纷开展了器官芯片的研究项目[5]。MPS模型包括潜在的生物学和毒理学AOP中的关键事件,可提供与化学品安全评估相关的信息[13]。如“微型大脑”或大脑类器官是原代细胞或诱导多能干细胞的3D培养物,可定向发育成神经组织,并应用于人脑组织的药物毒性研究[14-15]。目前正在开发能模拟体内肺结构的人源体外组织培养物如体外气液界面细胞培养模型,用于评估一些吸入毒理学终点[16]。但这些方法还在发展初期,需要进一步改进和验证[17-18]。此外,肠细胞类器官和体外肾小管样结构组织也已建立,这些体外技术虽还不能完全重现这些器官的复杂性,但依然可进行一些毒性评价探索,同样需要进一步优化和验证[19-20]。MPS模型的开发已逐渐从单器官模型向相互关联的多器官模型迈进[21-22],“人体芯片”是一种多通道的3D微流控细胞培养系统,划定特定的微环境、3D细胞聚集培养模拟体内多个器官,从而设计一个全身的仿生装置[23]。但目前的MPS模型还存在技术壁垒,包括但不限于无法合理重现器官系统之间的相互作用、未能适当模拟药物在体内的药动学过程、无法评估长期暴露的毒性效应和无法基于体外暴露药物浓度来准确估计人体剂量等。基于PBTK研究建模和体外-体内外推(in vitro-in vivoextrapolation,IVIVE)方法可尝试解决这些问题。
1.3 体外生物动力学方法
生物动力学NAM主要包括体外方法(优选使用人体组织试验材料或细胞)、计算(计算机)方法,及两者的组合。如使用人结直肠癌细胞Caco-2、犬肾细胞MDCK或猪肾细胞LLC-PK1研究肠道吸收和转运蛋白;使用人造皮肤用于皮肤吸收研究;使用人胚胎绒毛癌BeWo细胞建立代谢模型,开展人体血浆蛋白结合测定及胎盘转运试验等[24-25]。器官芯片模型也是最新研究热点,通过更好的生理相似性及在一个平台内整合不同器官的方法提高检测准确性[26-29]。计算方法(模型)主要有基于生理学的动力学(physiologically based kinetic,PBK)和基于生理学的药动学(physiologically based pharmacokinetic,PBPK)模型[30-32]。如使用人体细胞或组织体外实验数据与计算机技术结合,使用计算分配系数,以参数化PBPK模型来预测人体生物动力学[30,33]。生物动力学技术将在下一代毒性测试中发挥重要作用,用于生物动力学的NAM将在体外毒性实验设计中发挥关键作用。
化学物质的毒代动力学(毒动学)参数在人体和动物间差异显著,需要发展以人为基础的体外模型,从而有效预测化学物质的人体危害。因此PBPK模型应运而生,其是根据机体解剖学和生理学知识,按照脏器(如肝和肾)解剖学结构或组织(如脂肪和肌肉)类型等进行分区的生物动力学模型。主要用于综合预测化合物的吸收、分布、代谢和消除过程及体内毒性。预测器官组织中化合物浓度、代谢产物的变化过程和化合物毒性剂量在动物种属中的外推。在制药领域,PBPK模型在人体用药初始剂量选择和药物相互作用预测中被广泛应用。
在毒理学领域,PBPK模型主要作用是将受试化合物的体外数据推到人体内,也叫做定量IVIVE。有学者采用体外肝微粒体孵化和Caco-2转运研究中获得的计算机衍生参数和生物动力学数据开发了基于PBPK模型的NAM,通过反向剂量法预测草药生物碱伊波加因碱(ibogaine)及其代谢产物降伊波加因碱(noribogaine)的人类心脏毒性,同时也验证了这种NAM的适用性[34]。
2 NAM在化学品风险评估中的应用
近年来,多种NAM已广泛应用于高通量化学品风险评估中,并取得了很好的效果。而关于混合化学物或复杂化学物的风险评估,NAM的应用才刚起步,并且逐渐成为关注的焦点。
2.1 环境混合污染物
目前大部分的风险评估主要针对单一化学品,但事实上,人类在环境或职业中往往同时暴露于多种化学物,而它们之间的相互作用可能会导致暴露风险复杂化[35],因此,混合物的风险评估面临重大挑战。浓度加和(concentration addition,CA)和独立作用(independent addition,IA)模型预测是目前常用的混合物风险评估方法[36],但这种模型预测具有一定的不适用性和不确定性。而使用NAM测试策略进行混合物风险评估可能会更好的降低混合物暴露对健康影响的不确定性[37]。Hsieh等[38]采用人体多能干细胞诱导的肝细胞、心肌细胞、内皮细胞、神经元细胞和脐静脉内皮细胞5种体外模型,对42种单一环境污染物及其8种混合物进行体外细胞毒性测试,构建浓度-反应关系,再用贝叶斯概率方法进一步模拟上述环境污染物暴露-效应模式的可能性;同时采用CA和IA模型预测混合物的联合毒性效应,并与实际检测的结果进行比较。结果表明,由“低毒”或“安全”的单一化合物构成的混合物均表现出显著的生物活性,尽管CA预测混合物风险比IA更为准确,但在有些情况下,混合物的生物活性远大于其组分加和的生物活性。当所有成分的数据都可用时,CA是预测混合物毒性的首选,但这种预测的准确性因不同的细胞而产生差异,因此在评价复杂混合物联合毒性时依然需要结合实际测试数据。而NAM则可快速提供大量体外测试数据,以用于多种混合物的风险评估,降低混合物风险评估的不确定性,为完善环境污染物风险评估提供了更多的可能性。
2.2 复杂或未知化学物
最近更新的美国EPA有效有毒物质控制清单(https://www.epa.gov/tscainventory/how-accesstsca-inventory#download)中大约20%化学品是未知物质、成分可变的物质或复杂反应产物,研究此类复杂物质存在重大挑战。未知或可变的成分、复杂的反应产物通常包含许多不同的单独成分,每种成分可能具有不同的物理化学和毒理学特性[39]。而在当前的化学品监管制度下很少有既定的评估框架[40]。House等[41]测试了141种石油物质在15种人类细胞类型中的作用,以推导出一套综合的表型,从而根据物质的体外生物活性对其进行分组。结果表明,NAM数据可用于对单个复杂混合物进行排序,这种方式与基于化学成分预测体内潜在危害的结果高度一致。进一步表明复杂混合物的生物活性分析是表征复杂物质“足够相似性”的可行途径,旨在测试是否及如何使用体外生物活性数据为复杂混合物分组提供信息。
Wetmore等[42]使用BioMAP分析评估了30种有机种植水果和蔬菜提取物的生物活性,评估了其浓度响应。然后将结果与ToxCast中测试的农用化学品结果进行比较,认为这些提取物是安全的。这项研究的结果部分得到了美国化学理事会的长期研究计划的支持。结果表明:①水果和蔬菜中的化合物影响多个体外毒性终点;②与ToxCast单一化学物质相比,提取物在定性和定量上表现出不同的生物活性特征(可能因提取物是生物活性植物化学物质的复杂混合物);③剂量反应源于对复杂物质中不同成分的反应叠加;④化学物的生物活性不一定是不良反应,强化了体外生物活性并不等同于一对一的不良健康影响。鉴于此类有益健康的物质在体外会产生多种生物活性,因此在使用高通量毒性测试方法评估危害表征时需要注意[42]。
3 NAM整合测试策略
NAM的种类繁多,发展迅速,但单一的替代方法有其局限性和适用范围,不可能建立一对一的替代方法完全替代传统动物实验,因此需要将多种NAM及不同来源的信息整合使用,更精准地完成风险评估。关于如何将适用的NAM整合并用于不同目的的风险评估,Andersen等[44]提出了一个方法路线图(图1),描述了在不同风险环境中应用NAM的级别和场景。级别1为计算机筛选。这个层级的NAM可估计化学品物理特征、推断可能产生的毒性(如QSAR平台、毒理学关注阈值等)、预测可能的代谢物、并评估在预期使用条件下的暴露情况。目的是利用已知相似属性化合物信息对新的化学品信息进行数据填充,可快速进行大量的化学品筛选。级别2为高通量体外筛查。若在级别1中确定有毒性但未能确定可信的暴露安全阈值,则需要进行级别2的NAM测试。级别2的NAM主要以体外高通量测试为主,主要参考Tox21和EPA的ToxCast中的测试方法。近年来广泛应用的方法有基于细胞检测基因表达的HTTr技术[43],评价细胞形态学的高内涵成像技术、基准剂量分析和MOA分析的通路可视化方法,如动作可视化软件MoAviz[44]。理想情况下,2级检测应针对监管终点而定制,明确如何适用于已知的MOA或AOP。使用IVIVE将ADME数据与生物活性测定数据整合转换成半数抑制浓度、人等效剂量值,并与暴露估计值进行比较,生成暴露模式。级别3为目的性更强的检测和安全性评价。是在级别2基础上更加精细的暴露评估。预计级别3未来会广泛应用,可能会使用更复杂的多维或多细胞分析的NAM,比如与人体相关的符合目标的测试(human-relevant fit-for-purpose,FFP)。FFP平台主要开发细胞靶向检测[45]。FFP检测平台多种多样,有复杂的中枢神经系统组织,如“迷你大脑”[46],各种组织的衍生细胞三维培养等检测平台等,与高内涵技术集成可同时评估多个毒性终点。级别4为更完整的检测系统。在高剂量下,化学品在体内动物实验中动力学呈非线性,且动物与人体的差异性等问题,不能简单地将体外数据推导到体内,因此该层级应设计更加复杂的检测,包括多细胞和多维检验、人类芯片、组织替代物检测平台,以检测代谢物的肝代谢、组织间循环以及细胞或亚细胞组分代谢物生成[47-48]。一系列平台整合可进行更综合的毒性测试[49],将暴露信息及各种体外测试数据与每个级别相结合进行整合评估,可实现更加准确的风险决策。
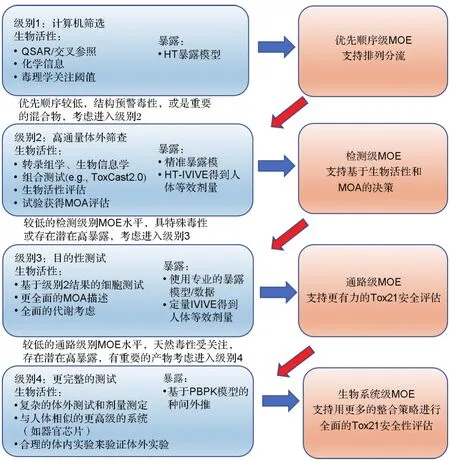
图1 新技术方法整合测试策略层次图[1].QSAR:定量结构-活性关系;HT:高通量;MOE:暴露边界;IVIVE:体外到体内外推;MOA:作用模式;PBPK:基于生理的药代动力学.
4 NAM应用中存在的问题及解决方案
NAM已成为全球生物医药大发展背景下的热门领域,但多数情况下,NAM在各国和组织间独立发展,可信度的规则和标准未能得到规范。在风险评估中使用NAM的障碍是人们无法普遍认可这些新工具和数据,解决方案是需要建立评估NAM可信度的方法。针对此问题,美国卫生与环境科学研究所组织多个相关行业的专家共同提出了一个框架,提供了一套标准来评估NAM的适用性,同时提供了一种系统方法来评估当前可用的NAM,并确定它们对监管的适用性。此框架主要包括3个步骤:①确定应用目的。确定NAM是用于优先排序、危害识别还是风险评估。②解决核心原则。包括方法的准确性(如假阳性和阴性检测)、透明度(明确的预测模型和算法等)及了解其局限性和适用范围。③定义适合用途的标准。包括化学品适用范围、方法描述、数据集质量的验证、同行评审、预测的终点或途径、机制说明、稳定性测定、数据可访问性、与体内数据(动物或人类)的生物学比较、模型的统计评估、预测的确定性水平、生物变异性和关注的亚群等。同时一些已被验证的应用案例可供研究者们参考借鉴[50]。
5 结语
使用整合的NAM可快速识别化学品毒性,从而更易关注到有潜力的化学品并开展更进一步的风险评估。NAM的使用进一步突出了共享数据和方法以及协调化学品优先排序和评估资源的必要性,使得整体化学品风险评估更高效、更精准。
目前,NAM主要应用于化学品的筛选和优先排序这类风险评估过程中的早期步骤,未来还将深入应用于风险评估的各个阶段。其发展尚需解决以下问题:①全球化学品安全立法复杂且多样化,而大部分国家当前法律仅允许和(或)鼓励少量新技术应用,需要重新思考当前的立法程序,使之足够严谨且适用于新技术规范。②目前全球数据共享不完整,缺乏许多类型的毒理学数据和信息,需要各相关行业开展数据共享,不断优化技术和信息学结构,增加数据的可用性,做到符合可查找、可访问、可互操作和可再利用的原则,应鼓励建立全球可自由访问的免费的共享数据库。③目前有许多计算机模型和其他一些NAM可用于风险评估,但这些NAM均处于开发、验证或接受的不同阶段[51],需要确定哪些方法适用于化学品安全评估,如何开发更有前途的NAM,以及发展如何让NAM达到可接受水平的决策框架。我国的NAM正处于发展阶段,更加需要相关政策的制定和规范,也需要更多的研究人员投入到该领域中来,使NAM在风险评估方面的应用发挥更大作用。

