柚皮挥发性有机化合物与牛乳铁蛋白相互作用分子机制及指纹图谱
耿照明,周清滕,郭 明,胡智燕,朱杰丽
(1.浙江农林大学化学与材料工程学院,浙江 杭州 311300;2.浙江省林业科学研究院,浙江 杭州 310023)
柚皮挥发性有机化合物(pomelo volatile organic compounds,PVOC)因具有独特的香味及存在大量具有抗菌消炎的烯萜和醛酮类化合物,在医药食品、化学化工等方面具有潜在应用价值[1]。而挥发性活性物质的药理活性需要与载体蛋白结合转运至相应作用靶点方能发挥作用[2]。蛋白质可与PVOC分子发生可逆或不可逆结合,二者的相互作用高度依赖于PVOC分子的性质、蛋白质的天然结构、蛋白质与PVOC分子结合时的结构变化以及温度和pH等参数。探究两者的作用本质和规律是一个系统且复杂的工作。在处理挥发性物质样品进行分析时,确保其完整性非常重要。顶空固相微萃取(headspace-solid phase microextraction,HS-SPME)是一种无溶剂的样品处理技术,具有成本低、所需样品少、灵敏度高、重现性好和操作简单快捷的特点,能较准确地反映样品的挥发物组成[3],可与气相色谱-质谱技术联用(gas chromatography-mass spectrometry,GC-MS),实现挥发性样品成分的快速分析[4-5]。光谱学可用于评估生理条件下蛋白质配体相互作用。借助多光谱方法,如荧光猝灭、三维荧光、圆二色性光谱和紫外吸收,可研究蛋白质分子相互作用和结构变化的主要作用力。分子建模可以预测蛋白质和配体之间的最佳结合构象[6-7]。
牛乳铁蛋白(bovine lactoferrin,BLF)是一种源自转铁蛋白的铁结合糖蛋白,主要从牛乳中提取。BLF具有抗氧化、抗癌、抗炎防止微生物感染、维持铁在正常范围内的平衡和调节铁在肠道的吸收等一系列功能特性[8],因此被广泛应用于营养补充剂和婴儿配方食品中。而BLF若在胃内消化程度过高,将失去一些生物活性功能,如失去输运铁和对抗自由基的功能,可能引起食物过敏,降低在肠道发挥生理功能的可能性[9-10]。为保证BLF作为一种有效的铁转运蛋白,必须在到达特定受体之前保持其稳定性。因此,寻找一种蛋白质-活性物复合物保护机制来保持蛋白质稳定性尤为重要。
本研究对PVOC物质组与BLF的吸附结合进行探索,选取低丰度蛋白BLF(图1)作为PVOC物质组小分子的蛋白受体,采用HS-SPME/GC-MS技术分离、鉴定PVOC,采用光谱和分子建模技术从微观角度探究PVOC与载体蛋白之间的相互作用机制,结合组学阐释PVOC物质组与载体蛋白作用的分子机制。
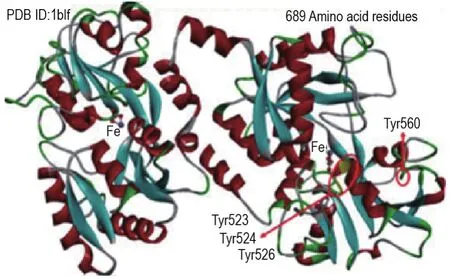
Fig.1 Three-dimensional structure of bovine lactoferrin(BLF)(low abundance)
1 材料与方法
1.1 药材、主要试剂、仪器和软件
一、二和三级琯溪蜜柚及南非葡萄柚和以色列青柚(3个品种各级挑选1个样品,依次编号为S1~S9)均采自福建省漳州市平和果园,所选柚子长势相近,无病虫害,果实直径约10 cm,采后4℃保存备用。D-柠檬烯〔(+)-dipentene,Dt,纯度≥95%)〕,上海萨恩化学技术有限公司;乙酸芳樟酯(linalylacetate,La,纯度≥95%),上海梯希爱化成工业发展有限公司;圆柚酮(nootkatone,Nt,纯度≥98%)和BLF(80 ku,纯度≥95%),上海源叶生物科技有限公司;醋酸钠(CH3COONa,NaAc,纯度≥98%),国药集团化学试剂有限公司;冰醋酸(CH3COOH,HAc,纯度≥98%),上海凌峰化学试剂有限公司。7890A/5975C气相色谱-质谱联用仪和DB-17MS色谱柱(30 m×250 μm×0.25 μm),美国Agilent公司;AL204电子天平,上海梅特勒托利多国际贸易有限公司;SPME手柄和固相微萃取头(50 μm/30 μm DVB/CAR/PDMS),美国 Supelco公司;F-4500型荧光分光光度计,日本HITACHI公司;UV-2600型紫外光谱仪,日本SHIMADZU公司;ZD-2型酸度计,上海精密科学仪器有限公司;J-810CD光谱仪,日本Jasco公司。ChemDraw 2019软件,美国CambridgeSoft公司;Discovery Studio 2.5软件,美国Biovia公司;AutoDock4.2.6软件,美国Scripps Research公司;Origin 2021软件,美国OriginLab公司。
1.2 顶空固相微萃取气质联用技术构建PVOC指纹图谱及其与牛乳铁蛋白吸附结合指纹图谱
配制0.2 mol·L-1HAc-NaAc缓冲液(pH=7.4),然后使用该缓冲液配制BLF 5×103mg·L-1溶液。PVOC 1.0×10-5mol·L-1单分子及混合液标准品均使用无水乙醇配制。通过5次连续进样考察仪器的精密度、稳定性及重复性。将采集的柚子样品取果皮并切成小块(2 mm×2 mm),分别称取0.5 g置于顶空瓶中,25℃于固相微萃取仪上平衡萃取,萃取结束后,采用GC-MS技术获得PVOC指纹图谱。样品在GC进样口热解吸2 min。色谱条件:氦气作为载气,扫描速度3.2 amu·min-1,初始温度为50℃,保持1 min,然后以10℃·min-1程序升温至260℃,保持2 min;前进样口、传输线、离子源和四极杆温度分别为260℃,260℃,230℃和150℃。质谱条件:电子轰击源(electron Impact,EI)电离能量为-70 eV,质量扫描范围为质荷比(m/z)50~500,溶剂延迟时间为4.5 min。总运行时间24 min。
将收集的9种柚皮PVOC分别定量通入盛有2 mL BLF蛋白溶液的顶空瓶中,密封。室温低转速平衡搅拌10 min,使PVOC与BLF充分结合至饱和后进行HS-SPME定时平衡萃取,采用GC-MS技术获得PVOC与BLF吸附结合的指纹图谱[11]。空白对照组(2 mL HAc-NaAc缓冲溶液0.05 mol·L-1)按上述步骤操作。
在NIST98.L标准谱库中对GC-MS分析得到的质谱数据进行检索,查寻有关质谱资料,对基峰、m/z和相对丰度等进行分析,分别对各峰所代表物质的化学结构和名称进行确认,获得PVOC物质组成分信息[12],采用峰面积归一法分析相对含量。采用Origin 7.5软件建立GC-MS指纹图谱;以9个柚皮PVOC物质组共有成分相对含量为特征,采用离差平方和法,选用欧式距离为测度,对样品进行聚类分析[13]。
1.3 PVOC物质组与BLF结合的分子模型的建立
使用ChemDraw构建PVOC配体结构,并进行MM2能量最优化处理,在Autodock软件中添加原子类型后保存文件。PDB蛋白质数据库导出“1BLF”晶体结构作为BLF的对接模板。在Pymol中打开配体文件对其进行去水和加氢的前期处理。利用Autodock 4.2.6软件添加AD4原子类型并保存。利用Autodock进行分子对接,体系盒子大小设置为X:70,Y:70,Z:70(X,Y和Z分别表示各方向上格点的数量),格点间隔默认0.375 Å(1 Å=0.1 nm),格子的中心移至格子整体包覆住Try523,Try524,Try526和Try560,采用拉马克遗传算法(LGA)进行内部构象搜索,通过AutoDock软件包的python脚本,运行AutoGrid,进行分子对接,输出保存为pdb格式。对接结束后,根据Autodock 4.2.6软件内分子间结合能高低进行分子模型评估,首选对接排名较高的对接结果。在这一步中,PyMol软件用于pdb文件的可视化和生成。
1.4 紫外光谱、荧光光谱和紫外可见吸收光谱测定PVOC物质组与BLF相互作用
使用F-4500荧光分光光度计分别在298和310 K检测BLF的固有荧光发射,激发波长设置为282 nm,发射波长设置为270~450 nm。分别用PVOC单分子(Dt,La和Nt)标准液及物质组(Dt,La和Nt)混合液对BLF溶液进行连续滴定至饱和。对于所有样品,滴定结束时乙醇的含量不超过3%(V/V)。根据式①进行内滤效应校正[14]。
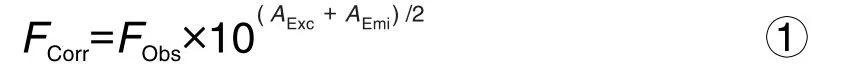
其中FObs和FCorr分别为初始荧光强度和内滤波效应校正后的荧光强度。AExc和AEmi分别是PVOC在最大激发波长处的荧光值和最大发射波长处的荧光值。
分别取BLF溶液、PVOC单分子标准液及物质组混合液各3 mL于比色皿中,测定200~500 nm紫外可见吸收光谱。收集BLF固有荧光发射数据与PVOC单分子的紫外吸收数据,根据Förster的偶极-偶极非辐射能量转移理论,得到蛋白质与配体间作用结合距离[15]。
通过Stern-Volmer方程(式②)分析荧光猝灭数据[16],探索BLF与PVOC物质组结合机制。

式中,F0,F,Kq,KSV,τ(010-8s)和L分别表示无猝灭剂和有猝灭剂时的荧光强度、猝灭速率常数、Stern-Volmer猝灭常数、分子平均寿命和猝灭剂浓度。
确认荧光猝灭机制后,用双对数Stern-Volmer方程(式③)计算PVOC物质组在BLF上的结合位点数[17]。
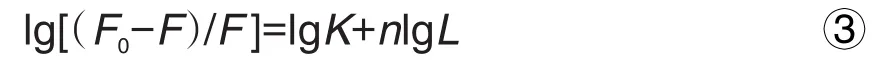
其中,K为结合常数,n为结合位点数,L为PVOC样品浓度。
使用Hill方程(式④)消除约束模型中的假设,减少建模条件之间的差异[18]。
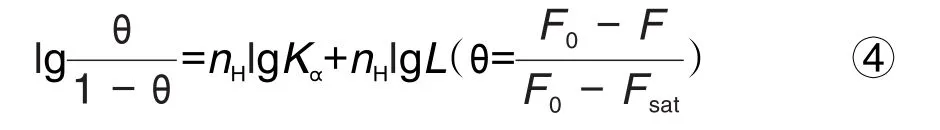
式中,θ为荧光饱和度,Fsat为蛋白荧光强度最小时的荧光值,Ka为结合常数,nH为Hill系数,L为PVOC物质组样品浓度。
1.5 理论方程计算PVOC物质组与BLF结合作用力类型和结合距离
根据Ross理论[19],可由体系的焓变(ΔH)、熵变(ΔS)和自由能变(ΔG)来判断生物大分子与小分子之间相互作用力的类型。配体与蛋白受体分子作用的作用力有氢键、静电作用力、范德华力和疏水作用力。体系的ΔH,ΔS和ΔG可反映蛋白受体与配体之间相互作用力的类型,ΔS>0表示作用力为疏水作用力和静电力;ΔS<0表示氢键和范德华力;ΔH>0,ΔS>0表示疏水作用力;ΔH<0,ΔS<0表示为氢键和范德华力[20]。通过荧光光谱极点测取,并根据Van't Hoff方程(式⑤和⑥)[21-23],得到体系的ΔH和ΔG。
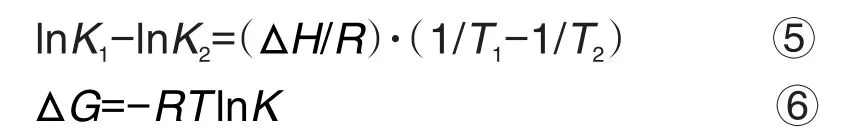
根据Gibbs-Helmholtz方程(式⑦),计算获得作用体系的ΔS。

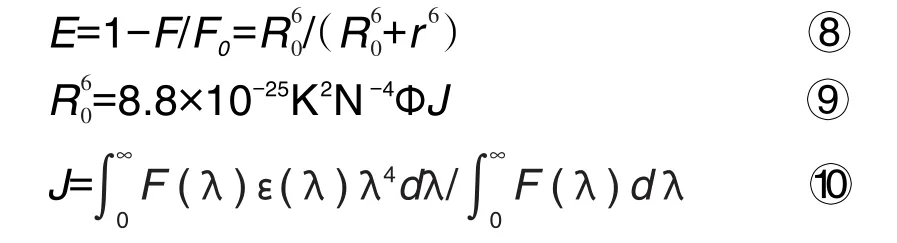
式⑧中,E为能量转移效率,R0为能量转移效率为50%时分子间的距离,r为供受体分子间的实际距离。式⑨中,溶液折射常数N=1.336;供体的荧光量子产率Φ=0.118;K2是取向因子,一般将溶液中的供受体当作混乱取向,从而取K2=2/3计算R0;式⑩中,J是蛋白荧光发射谱与猝灭剂紫外吸收谱的重叠积分,λ为波长,F(λ)为波长λ处的荧光值,ε(λ)为波长λ处的紫外吸收值。
1.6 圆二色性光谱法测定BLF蛋白二级结构变化
移取BLF溶液3 mL于比色皿中,以HAc-NaAc缓冲液为参比溶液,记录圆二色性(circular dichroism,CD)光谱仪上BLF的远紫外-CD谱,再分别测定添加等摩尔浓度的3种PVOC单分子及其混合物溶液的CD谱。检测波长为190~260 nm。BLF的二级结构中占主导作用的α-螺旋含量变化由式[11]计算得出,将数据转换为摩尔椭圆率[θ](deg·cm2·dmol-1),并绘制CD谱图。BLF蛋白的α-螺旋结构的特征是在208 ~210 nm处出现负带[25],β-折叠结构的特征是在190~200 nm处有一个强的正带,在210 nm附近有一个负带。结合CD谱图及式[12]计算α-螺旋含量。以α-螺旋含量反映二级结构变化。
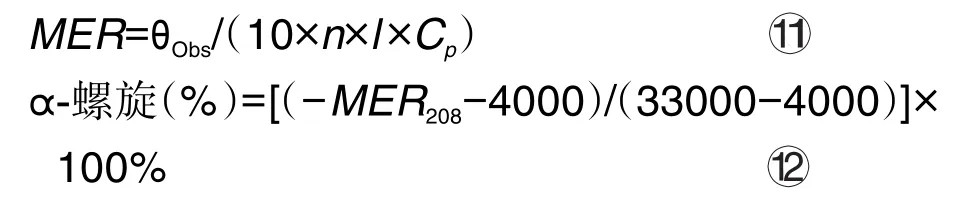
式中,θObs是仪器测定的CD光谱强度;MRE是椭圆率;CP是蛋白物质的量分数;l是样品池的厚度;n是氨基酸残基基团的数目。
1.7 三维荧光光谱法测定BLF蛋白三级结构变化
使用F-4500型荧光分光光度计在298 K检测记录BLF的三维荧光数据,然后再分别测定添加等体积的3种PVOC单分子及其混合物溶液时BLF三维荧光数据。激发波长(λEx)范围为220~310 nm,增量为10 nm;发射波长(λEm)范围为220~500 nm,增量为5 nm。将三维荧光数据导出,使用Origin2021软件进行可视化分析。以λMax红移程度或蓝移程度反映蛋白质构象变化的程度。以特征峰λEX=280 nm处Peak1的变化反映Tyr和Trp残基的光谱特征;以λEX=230 nm处Peak2的变化反映多肽骨架结构荧光特征,同时反映蛋白二级结构特征。
1.8 分子动力学模拟软件分析BLF-PVOC最佳结合模型构象稳定性
选择PVOC物质组单分子(Dt,La和Nt)分别在BLF上的最佳结合模型进行配体与蛋白的分离,将蛋白与配体分别导入到分子动力学模拟软件中,将蛋白置于盒子中心且距离盒子边缘3 nm,采用AMBER3力场,并向盒子中填充TIP3P周期性水模型,并添加Na+/Cl-以中和电荷,保证体系的稳定性。能量优化首先采用最陡下降法进行1000步能量优化,再采用共轭梯度法进行2000步能量优化,之后再进行压力和温度平衡。最后系统温度为298 K,时间步长设置为2.5 fs。每隔100 ps保存一次能量和坐标信息,体系进行100 ns的非限制动力学模拟。非键分子间作用距离截断值设置为10.0 Å,每100 ps保存一次能量和坐标信息。结合能计算采用MM/PBSA方法[26]。最后对100 ns模拟结果进行Cα原子的均方根偏差(root mean square deviation,RMSD)和氨基酸残基均方根浮动(root mean square fluctuation,RMSF)分析,以此判断对接模型的构象稳定性。
2 结果
2.1 9种柚皮挥发物指纹图谱及牛乳铁蛋白吸附结合指纹图谱
方法学考察结果表明,各共有峰的相对保留时间及相对峰面积RSD均<3%,说明仪器的精密度、稳定性和重复性良好。以出峰最多且峰型较完整的一级以色列青柚挥发物作为样品对照峰,测定S1~S9 PVOC物质组的总离子流色谱(total ionic chromatography,TIC)(图2A),共筛选出21种共有成分(表1);通过峰面积归一化法确定PVOC的相对含量,并采用平方和法和欧氏距离进行聚类分析,经聚类分析筛选出Dt,La和Nt等活性PVOC物质组特征成分[27]。利用HS-SPME/GC-MS测定BLF对柚皮PVOC物质组平衡吸附的GC-MS总离子流图(图2B),BLF对柚皮PVOC物质组平衡吸附的GC-MS数字化指纹图谱见表2。
午饭后,办公室没人,淼哥坐在办公桌前看毛姆的《刀锋》。娟妹一阵风似的跑过来坐下兴奋地说:“淼哥、淼哥,刚吃饭的时候刷手机,看到一则新闻说是,一男子三亚游泳,水里撸管致10名女子怀孕。我的天啦,吓死宝宝了,差点儿没让我把刚吃下的鸡腿吐出来。你说我们总是遇到那么多不怀孕来做辅助生育的,她们这也太好怀孕了吧?真是人比人,气死人。”
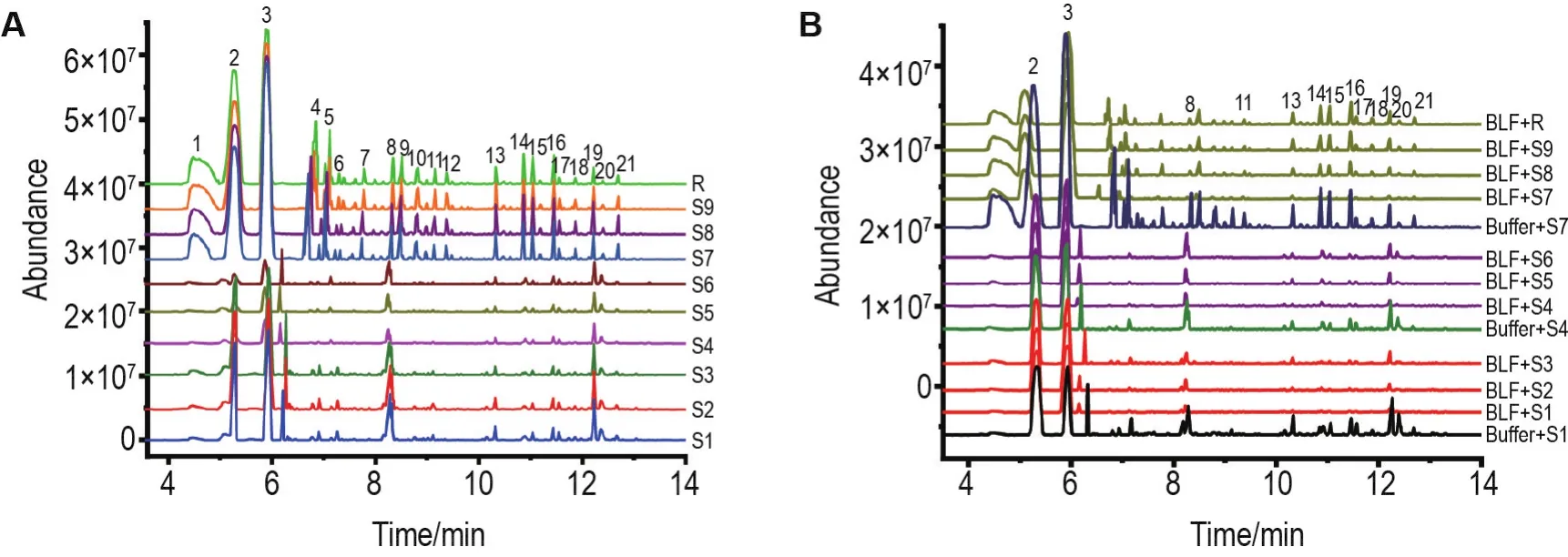
Fig.2 Total ion chromatography of volatile organic compounds(PVOCs)of 9 pomelo peels before(A)and after adsorption with BLF(B).S1-S3,S4-S6 and S7-S9:the first,second and third grade Guanxi pomelo(S1-S3),South African grapefruit(S4-S6)and Israel green pomelo(S7-S9),respectively;R:contrast fingerprint of volatile compounds in pomelo peels.
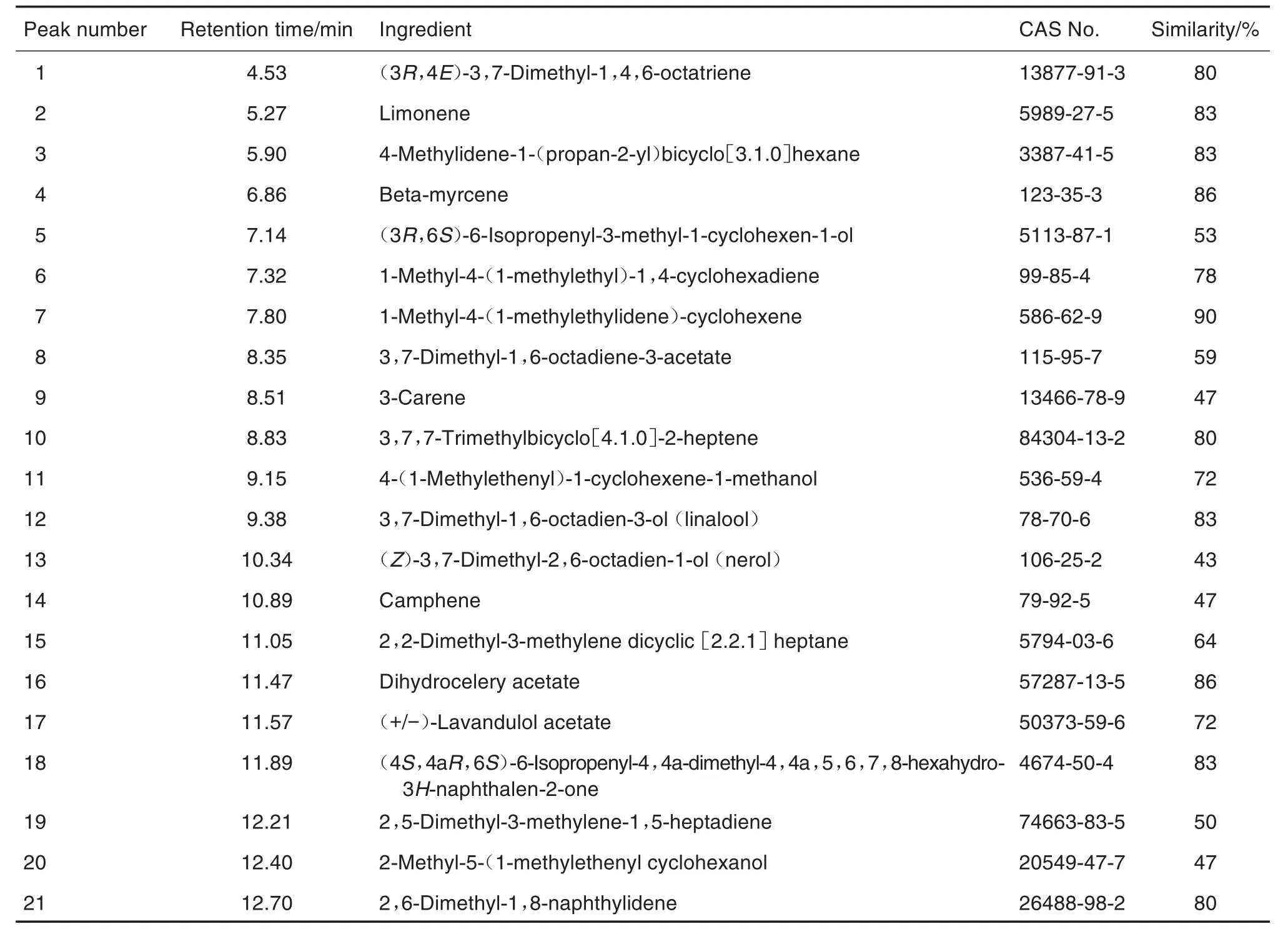
Tab.1 ldentification results of peaks of PVOCs in 9 pomelo peels in Fig.2A
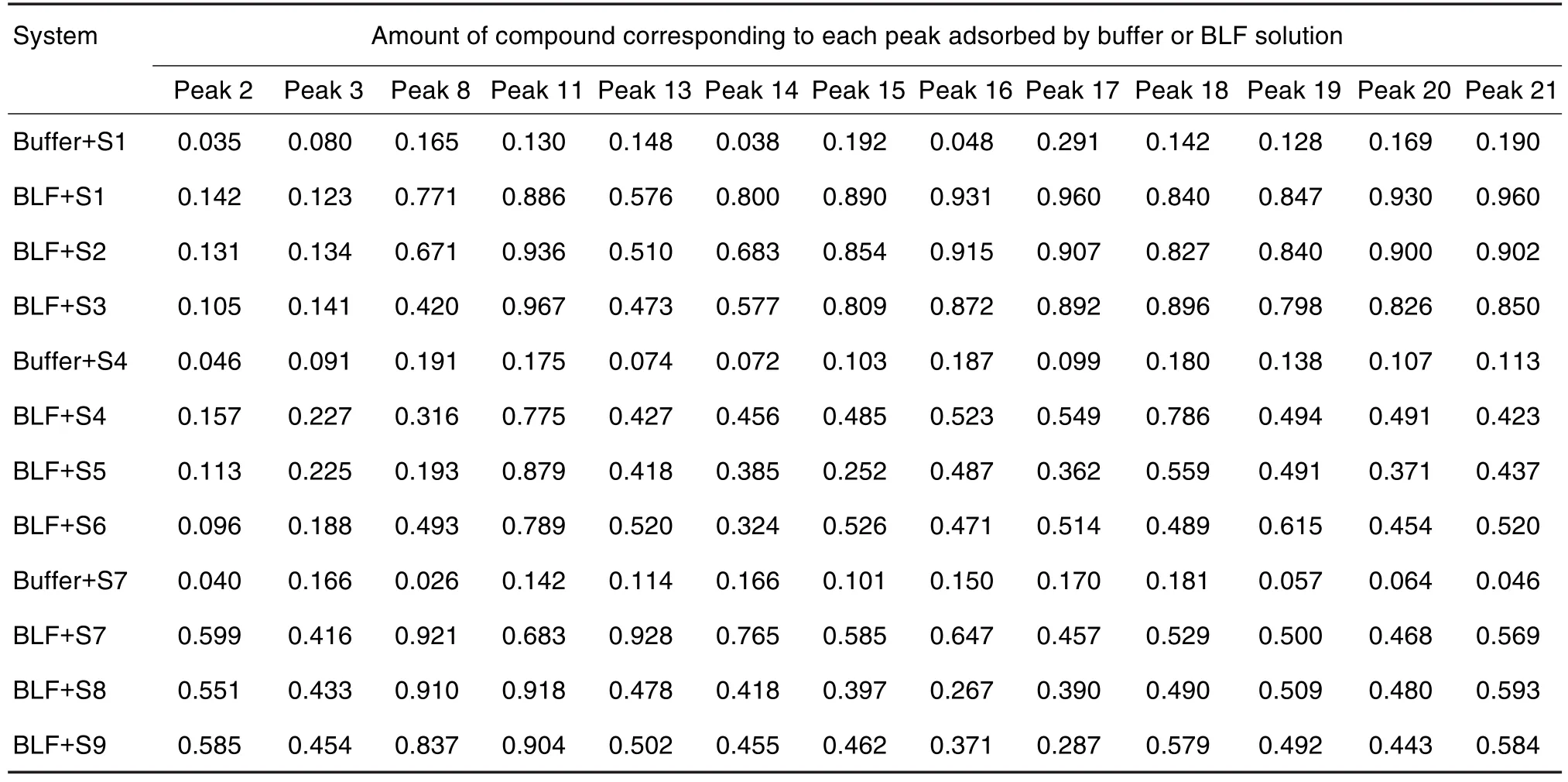
Tab.2 Digital fingerprint of adsorption and binding degree of common aroma between BLF and PVOCs of 9 pomelo peels
由图2可知,排除溶剂干扰,9种柚皮的PVOC在与BLF溶液平衡吸附后,指纹图谱中峰高均有不同程度降低,表明BLF吸附结合柚皮PVOC的能力较强。琯溪蜜柚和南非葡萄柚的共有特征峰峰高明显降低,由于出峰位置基本未变,初步判断该成分与BLF进行结合。比较图2A和2B中共有峰峰高并结合表2中缓冲液与BLF溶液对挥发物吸附数据,可见BLF溶液对9种柚皮的PVOC的吸附量>缓冲液对挥发物的吸附量,因此可排除溶剂吸附挥发物的影响。
对BLF与9种柚皮PVOC共有吸附结合程度结果进行聚类分析,以组间分类距离为横坐标,样品编号为纵坐标绘制聚类分析图(图3)。结果在组间距离为10时,存在3条直线能够连接所有样品组分,因此PVOC与BLF的吸附结合程度也被分为3类,即一、二和三级以色列青柚(S7~S9)PVOC是第一类;一、二和三级南非葡萄柚(S4~S6)PVOC为第二类;一、二和三级琯溪蜜柚(S1~S3)PVOC则是第三类。根据表2分别计算3类PVOC与BLF的吸附结合程度总和,发现琯溪蜜柚PVOC与BLF的吸附结合程度最强是27.492,其次是以色列青柚(21.856)和南非葡萄柚(17.280)。
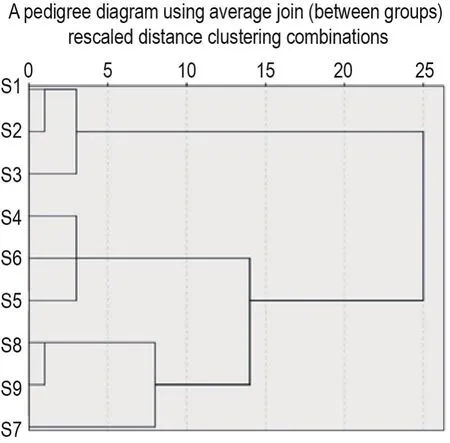
Fig.3 Systematic cluster analysis tree of degree of common aroma adsorption and binding between BLF and PVOCs of 9 pomelo peels
2.2 PVOC物质组与BLF结合的分子模型
由建立的PVOC物质组与BLF结合的分子模型(图4)可知,3种PVOC单分子Dt,La和Nt均与BLF上的活性位点Trp560存在氢键及不同类型的疏水作用力(图4B~D)。疏水性配体Nt的羰基氧以4.54 Å的距离与BLF上的Thr636产生氢键作用,并被BLF中的Trp560,Asp508,Asp509,Glu521,Lys522,Glu353,Arg531,Ala558,Thr636,Glu635,Lys637,Thr527,Gly528,Lys520形成的疏水封闭球型包裹。
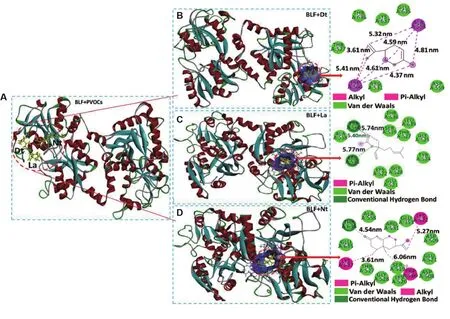
Fig.4 Optimal conformation of BLF combined with PVOCs.A:distribution of PVOCs on BLF;B,C and D:molecular docking model of PVOCs monomolecular Dt,La and Nt binding with BLF,respectively.
La的2个酯基氧分别以5.77 Å和5.74 Å的距离与BLF上的Trp560和Arg531产生氢键作用,整个La分子被包裹在BLF中由Trp560,Thr636,Ser519,Thr527,Leu639,Gly525,Tyr524,Gly528,Glu521,Lys522,Arg531及Ala558形成的疏水口袋中。Dt结构中不存在氧原子,与BLF无氢键作用,但其上的双键及环己烯基与BLF上的Trp560和Ala558联合产生交叉疏水作用,同时周围还存在Thr636,Thr527和Arg531等范德华力辅助结合作用。
2.3 PVOC物质组与BLF的相互作用
由荧光谱(图5)可见,Nt和PVOC物质组混合液均能强烈猝灭BLF的内源荧光,由于Dt和La对BLF内源荧光的猝灭效果相较于Nt不明显,因此未展示结果。对比图5A和5B可看出,在相同的浓度比条件下,PVOC物质组对BLF内源荧光的猝灭程度强于Nt。在进行的10次滴定过程中,BLF的内源荧光强度共降低了372,同时引起BLF荧光发射谱红移34 nm。表明PVOC物质组与BLF结合后,BLF的Tyr残基所处的微环境疏水性降低,极性增加。从而推断PVOC物质组与BLF发生了较强的结合作用。对比图5A和5B可以看出,Nt与BLF的相互作用则无PVOC物质组强烈,前者引起BLF荧光猝灭的程度是后者的1/2倍,且未引起BLF荧光发射峰红移或蓝移现象。表明Nt与BLF间的相互作用对BLF结合位点氨基酸残基的微环境影响较小。
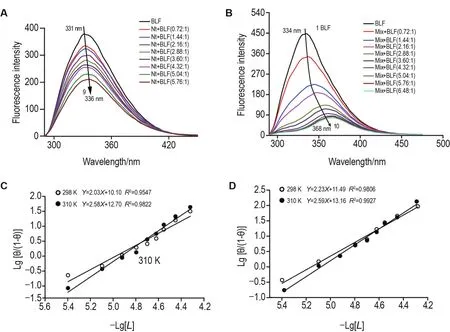
Fig.5 Fluorescence spectra and Hill equation fitting curve of BLF combined with Nt and PVOCs mix.A and B:the fluorescence spectra of BLF combined with Nt and PVOCs at 298 K;C and D:fitting curves of Hill equation for BLF+Nt system and BLF+PVOCs system at 298 and 310 K.Curves 1→10 correspond to different concentrations of PVOCs(0-8.64×10-6mol·L-1,pH 7.4).The variation of fluorescence spectra at 310 K is similar to that at 298 K,not given in the figure.
从图5C和5D可以看出,温度升高时,Nt和PVOC物质组与BLF的结合位点数n值(方程斜率值)增高,分别从2.03,2.23升高到2.58与2.59。表明PVOC分子与蛋白相互作用时温度增大(蛋白活性范围内),PVOC分子热运动剧增,触碰蛋白的活性位点机会增多。
由图5C和5D中Nt和PVOC物质组与BLF作用后R2高线性趋势可排除同时发生静态和动态猝灭现象的可能性[28-29]。此外,PVOC物质组与BLF作用后Kq均高于2×1010L·mol·s-1,证实二者的结合是静态猝灭机制。Hill方程对荧光猝灭数据的拟合结果见表3。Dt,La,Nt和PVOC物质组与BLF结合的nH值分别为 1.64,1.38,2.03和2.23,Dt和La与BLF结合的结合位点数更接近1,而物质组和Nt与BLF结合的结合位点数大于2。表明Dt和La在BLF中存在独立结合位点,而物质组和Nt在BLF中则有多个结合位点且依然存在协同关系。此外,Dt,La,Nt和PVOC物质组与BLF作用后R2均具有较高的线性相关度,同时Kq值均高于2×1010L·mol·s-1,进一步表明Dt,La,Nt和PVOC物质组与BLF形成复合物是静态猝灭机制。
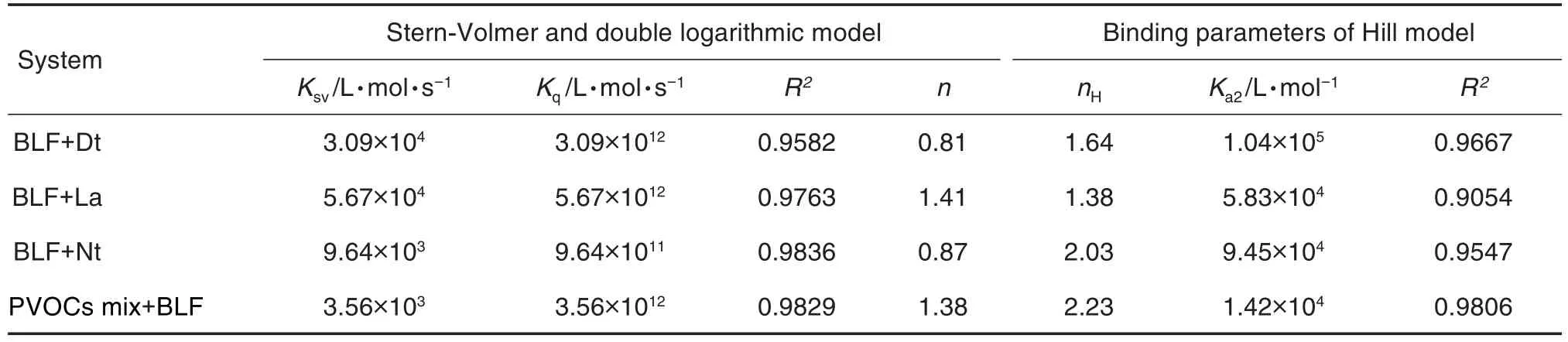
Tab.3 Binding characteristics of BLF with Dt,La,Nt and PVOCs mix at 298 K by fitting fluorescence quenching data with Stern-Volmer and double logarithmic model and Hill model
2.4 PVOC物质组与BLF结合的作用力类型和结合距离
由Van't Hoff方程及Gibbs-Helmholtz方程计算所得各体系焓变ΔH、自由能变ΔG和熵变ΔS结果见表4。PVOC物质组与BLF的自由能变ΔG均为负值,以焓为驱动力自发结合,且随温度升高,该自发趋势增大。此外,Dt+BLF,Nt+BLF和PVOCs mix+BLF体系中ΔH<0,ΔS<0,表明范德华力和氢键是其主要分子间相互作用力。而La+BLF体系中ΔS>0,ΔH<0,表明疏水作用力和范德华力是其主要分子间相互作用力。与图4分子对接显示的PVOC物质组与BLF结合的主要作用力类型一致。

Tab.4 Spontaneous tendency and main binding force types of Dt,La,Nt and PVOCs mix with BLF
分子间作用的能量转移机制分为辐射和非辐射2种,前者会导致生物大分子荧光峰形发生畸变,而后者不会导致生物大分子的荧光发射峰峰形发生畸变。PVOC与BLF相互作用的荧光光谱中,BLF的荧光发射峰形状未发生畸变(图5),可判断Dt,La和Nt及PVOC物质组与BLF间的作用荧光谱为非辐射能量转移。根据的偶极-偶极非辐射能量转移理论,得到Dt,La和Nt及PVOC物质组与BLF的结合距离r(图6)分别为3.99,4.76,1.27和1.64 nm。以上4个体系通过计算得出0.5R0<r<1.5R0,即PVOC与BLF间的作用距离均<7 nm,说明PVOC与BLF间的作用为短程分子间作用,进一步验证了PVOC与BLF间发生了分子间作用,同时也说明Dt,La和Nt与BLF的能量转移主要是通过非辐射荧光共振能量转移进行的。
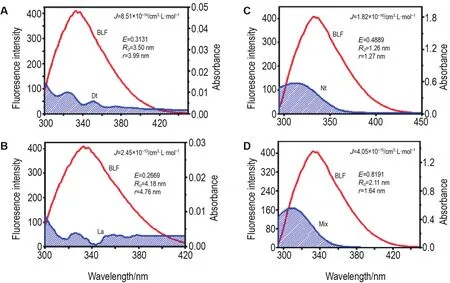
Fig.6 Fluorescence-UV overlapping spectra of Dt(A),La(B),Nt(C)and PVOCs(D)combined with BLF.
2.5 PVOC对BLF蛋白二级结构的影响
将得出的CD光谱数据通过Origin2021软件进行可视化分析,如图7所示。
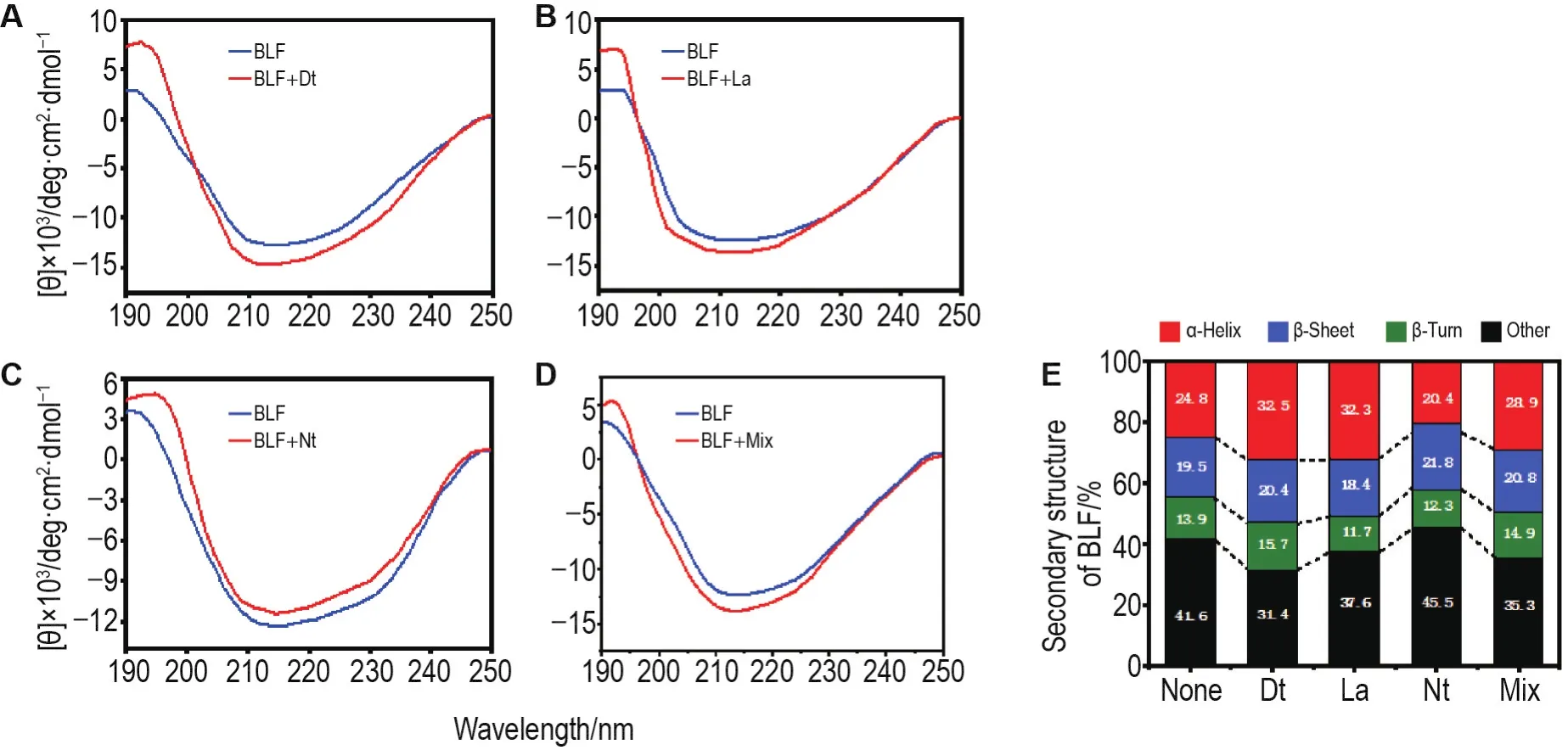
Fig.7 Circular dichrogram of BLF combined with PVOCs.A-D:the change of circular dichromatography before and after BLF was combined with Dt,La,Nt and PVOCs mix;E:the change of the proportion of α-helix,β-sheet,β-turn and other secondary structure in BLF.
Dt和La分别与BLF结合后,BLF α-螺旋结构的负带特征峰增强,β-折叠结构的正带特征峰增强(图7A和7B),α-螺旋结构和β-折叠结构所占比例均有所增大(图7E)。Nt与BLF结合后,BLF的α-螺旋负带特征峰削弱,而对β-折叠结构在190~200 nm处的正带特征峰正性增强(图7C),说明Nt的介入使BLF的α-螺旋结构减少,β-折叠结构增加(图7E)。而PVOC物质组与BLF结合则使得α-螺旋负带特征峰负性和在190~200 nm处的正带特征峰正性增加,说明其与BLF结合后导致BLF的α-螺旋松动和β-折叠结构增多。
2.6 三维荧光光谱法分析PVOC对BLF蛋白三级结构的影响
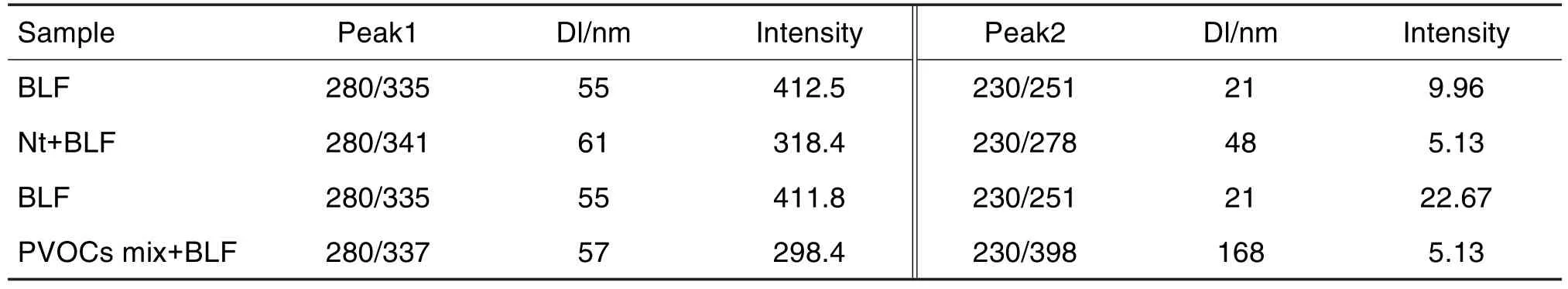
BLF与Nt和PVOC物质组间作用前后的三维荧光光谱见图8。与二维荧光结果一致,Nt与PVOC物质组均能有效猝灭BLF内源荧光;同样,由于Dt和La对BLF内源荧光的猝灭效果相较于Nt不明显,因此结果未展示。BLF+Nt、BLF+PVOC物质组相互作用体系三维荧光光谱中2个主要检测峰Peak1和Peak2的变化结果见表5。表5中可以看出BLF由于Nt和物质组的介入,使得λEX=230 nm处Peak2有较明显的红移,且荧光强度降低也较为显著,这说明,Nt和物质组对BLF的二级结构影响较大,导致BLF中大量的α-螺旋松动及部分β-折叠结构增加,这与圆二色性光谱所得结果高度一致。
Tab.5 Three-dimensional fluorescence spectra of BLF before and after combination with Nt and PVOCs mix
如等高线图(图8)所示,Nt和PVOC物质组与BLF结合后Peak1的荧光强度下降,且伴随轻微的红移,说明Nt和PVOC物质组与BLF发生了结合,并分别结合在BLF的荧光基团当中。同时也说明相互作用引起蛋白荧光基团残基微环境的改变,对其三级结构产生了影响。结合图4分子对接结果,Nt结合在BLF上的Trp560残基上,结合距离为3.60 Å。而Trp560是BLF上的荧光基团残基。表明光谱实验与分子模拟的结果一致。
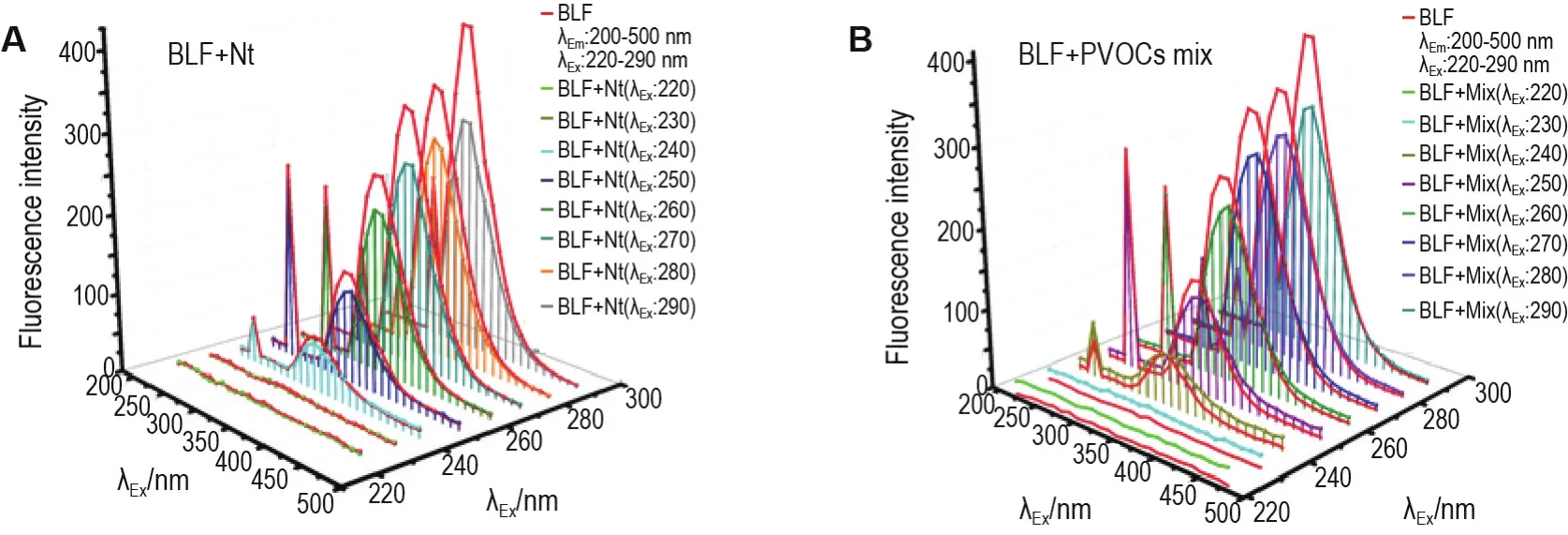
Fig.8 3D contour spectra of BLF combined with Nt(A)and PVOCs mix(B)
2.7 BLF-PVOC最佳结合模型的构象稳定性
为了探索PVOC物质组与不同蛋白受体相互作用规律,分别对BLF受体蛋白单体体系和由分子对接甄选出的Dt+BLF,La+BLF,Nt+BLF最佳结合模型体系进行100 ns的分子动力学模拟,在各个体系中均以初始蛋白构象为参照,在模拟时间内对系统Cα原子的RMSD进行计算。BLF蛋白质单体系的主链RMSD平均值为0.208 Å,>0.2 Å,各二元复合物体系Dt+BLF,La+BLF,Nt+BLF的蛋白质主链RMSD平均值分别为0.187 Å,0.191 Å 和0198 Å(图9A~C),所有结果均<0.2 Å,表明所有的动态模拟轨迹平衡性是合理的,而且当PVOC物质组单分子进入BLF蛋白质活性位点后,使得二元复合物体系的稳定性增强。
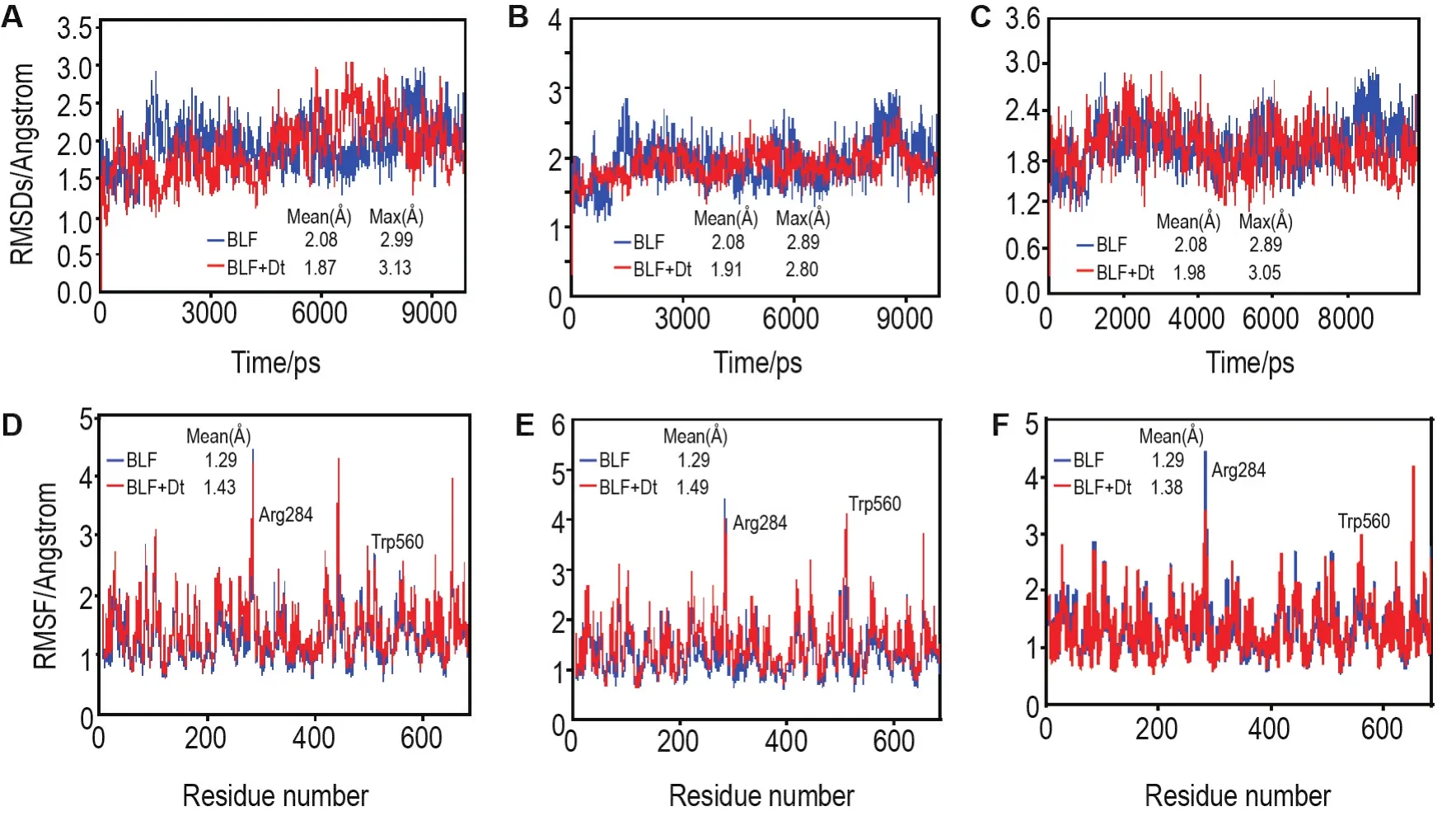
Fig.9 Mean values of RMSD and RMSF for C α atoms of various systems.A-C:the mean root mean square deviation(RMSD)values for the Cα atoms of systems of BLF and Dt+BLF,BLF and La+BLF,and BLF and Nt+BLF.C-E:the mean root mean square fluctuation(RMSF)values for the Cα atoms of systems of BLF and Dt+BLF,BLF and La+BLF,and BLF and Nt+BLF.
Dt+BLF,La+BLF和Nt+BLF最佳结合模型的稳定性通过分子动力学模拟估算后,对各个体系分子动力学平衡后氨基酸残基波动情况进行分析(图9A~C)。结果表明,BLF在被Dt,La和Nt分子进攻结合前,整个氨基酸残基RMSF波动值波动较大,当Nt配体分子进入BLF蛋白活性位点之后,RMSF波动值的波动幅度减弱,说明BLF氨基酸残基能够与Nt或溶剂产生某种程度的结合作用。结合对接可视化结果,Nt与BLF Thr636残基以4.54 Å的距离产生氢键作用(图4D)可能导致了BLF构象的改变。如图9D所示,Dt进入BLF蛋白活性位点后,BLF整个氨基酸残基RMSF波动值波动幅度减小,且BLF Trp560残基RMSF波动值明显减小,说明Dt的介入使得BLF蛋白氨基酸残基刚性增大。结合图4B对接可视化结果,Dt的双键及环己烯基于BLF Trp560和Ala558残基联合产生交叉疏水作用可能导致了BLF构象的变化,这与CD光谱得出的结论较为一致。
3 讨论
本研究利用HS-SPME/GC-MS、多光谱验证、理论计算及分子建模研究柚皮PVOC物质组与BLF的相互作用,发现BLF对柚皮PVOC物质组有较强的亲和力,结合常数为1.42×105L·mol-1。BLF对烯类PVOC的亲和力及结合力均较强,对酮类及酯类的均较弱。但若将烯类、酯类及酮类同时与BLF进行结合作用,BLF对柚皮PVOC物质组的亲和力及结合力的总和增大,说明柚皮PVOC物质组对BLF的结合作用可能存在强抵消和弱助长的协同作用关系。在BLF作为载体时,与BLF亲和力较低但活性高的PVOC单分子能与亲和力较高的PVOC单分子混合作用于BLF载体蛋白,这可能为提高柚皮PVOC物质组单分子的生物利用度提供可行途径。
BLF与柚皮PVOC物质组结合后,BLF的Tyr残基所处的微环境疏水性降低,极性增加,PVOC分子热运动剧增,触碰蛋白的活性位点机会增多。Dt和La在BLF中存在独立结合位点与BLF形成复合物是静态猝灭机制,而物质组和Nt在BLF中则有多个结合位点且依然存在协同关系。Dt,La,Nt和柚皮PVOC物质组与BLF间的作用荧光谱为非辐射能量转移。二级结构上PVOC物质组与BLF结合使得α-螺旋负带特征峰负性和在190~200 nm处的正带特征峰正性增加,α-螺旋松动和β-折叠结构增多。考虑到BLF由于小分子的嵌入结合,可能导致的蛋白三维结构疏松不利于保持蛋白的结构稳定性,本研究对蛋白结合柚皮PVOC物质组前后进行了分子动力学模拟,从模拟的RMSD结果可以得出,BLF与柚皮PVOC物质组的结合对蛋白的分子结构不会有较大影响,反而在于物质组结合后蛋白的构象更趋于稳定;但是通过RMSF结果发现,由于物质组的结合,BLF分子运动的自由度受到了限制。这也可能对维持蛋白的结构稳定性有一定的促进作用。另外,光谱及分子模拟共同评估了柚皮PVOC物质组与BLF的结合作用的结合距离、结合作用力、结合位置、结合前后蛋白的二和三级结构变化及束缚PVOC气体分子的关键氨基酸残基。组学角度下综合阐述柚皮PVOC物质组与载体蛋白的选择结合的分子机制,可为深入研究活性化合物的药理学及毒理学提供有益参考。

