绞股蓝皂苷Ll与顺铂联用对食管癌EC109细胞生长的抑制作用
赵敏彤,齐彦爽,郝林瑶,纪小桐,朴香兰
(中央民族大学药学院,北京 100081)
食管癌是世界范围内常见的恶性肿瘤之一。中国为食管癌高发国家,是我国发病率排名第六的恶性肿瘤,发病率约占全世界食管癌患者46.6%[1-3]。目前主要采用手术、放疗和化疗方式治疗食管癌,但效果仍不佳[4]。顺铂(cisplatin,DDP)是临床使用的广谱抗癌药,但其不良反应较大,且易产生耐药性[5-6]。因此,中药在恶性肿瘤治疗中越来越受重视。吴耀松等[7]研究发现,启膈散与DDP可协同抑制食管癌EC-9706细胞增殖;尚艺婉等[8]研究结果表明,六君子汤通过影响细胞能量代谢增强DDP对食管癌EC-9706细胞增殖抑制作用。表明联合治疗前景比单一放化疗更广阔,因此,研究新的联合治疗方案以及寻找治疗食管癌新药具有重要意义。
肿瘤是因细胞丧失功能调控而表现出失控性生长,其发病主要是由细胞周期调控紊乱和细胞凋亡规律失常引起。中药及复方可通过线粒体途径、内质网途径和死亡受体途径等诱导食管癌细胞凋亡[9]。绞股蓝〔Gynostemma pentaphyllum(Thunb.)Makino〕属于葫芦科绞股蓝属草质攀援植物,主要活性成分是皂苷类化合物。在壮医理论中,绞股蓝又名“国虾薄”,具有清热解毒和调节气机的作用[10]。现代药理学研究表明,绞股蓝具有抗肿瘤[11-13]、降血脂[14]和降血糖[15]等功效,其抗肿瘤作用靶点广泛,途径多样,与化疗药联用有增效作用[16]。《中药大辞典》就曾记载,绞股蓝提取液对大鼠食管癌有一定的预防和治疗作用[17];在临床上,曾将绞股蓝单独用药或联合化疗药治疗食管癌,并取得了不错的疗效[18-19]。以绞股蓝等中药材为主要成分的志苓胶囊,也表现出能够缓解食管疾病的功效[20]。绞股蓝皂苷 LI(gypenoside LI,Gyp LI)是人参皂苷20(R)-ginsenoside Rg3的达玛烷型四环三萜化学编号为2的碳上连有羟基的化合物。本实验室前期发现,Gyp LI能够抑制肺癌A549细胞和肝癌HepG2细胞存活,但对食管癌EC109细胞的抑制作用尚未见报道。如能在化疗药物中联用一定剂量的Gyp LI而减少DDP的用量,在降低不良反应的同时达到相同甚至更好的治疗效果,就能起到增效减毒的作用。因此,本研究探究Gyp LI与DDP联用对食管癌EC109细胞存活的抑制作用及其潜在机制,从而为食管癌的化疗提供更多的药物选择和治疗方案,为临床用药提供参考。
1 材料与方法
1.1 细胞、药物、试剂和主要仪器
人食管癌EC109细胞,北京协和细胞资源中心。DMEM培养基,美国Gibco公司;PBS和青链霉素混合液,北京索莱宝科技有限公司;胰酶、二甲亚砜(dimethyl sulfoxide,DMSO)、DDP和甘氨酸,美国Sigma公司;胎牛血清,以色列Biological Industries公司;Gyp LI,成都乐美天医药科技有限公司;Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒、特超敏ECL化学发光试剂盒和细胞周期与细胞凋亡检测试剂盒,上海碧云天生物技术有限公司;30%丙烯酰胺溶液、牛血清白蛋白V、4×SDS-PAGE分离胶缓冲液、4×SDS-PAGE浓缩胶缓冲液和BCA法蛋白定量试剂盒,北京兰博利德商贸有限公司;一抗:小鼠抗人Bax单克隆抗体、小鼠抗人细胞色素c(cytochrome c,Cyt c)单克隆抗体、兔抗人基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)多克隆抗体,武汉三鹰生物技术有限公司;小鼠抗人细胞周期蛋白D1和小鼠抗人细胞周期蛋白A单克隆抗体,美国Santa Cruz公司;辣根过氧化物酶(horse radish peroxidase,HRP)标记的山羊抗兔IgG抗体(二抗)、HRP标记的山羊抗小鼠IgG抗体(二抗)和小鼠抗人β肌动蛋白单克隆抗体,武汉赛维尔生物科技有限公司;脱脂奶粉,英国OXOID公司。流式细胞仪,美国 Beckman Coulter公司;FlexStation 3多功能酶标仪,美国Molecular Devices公司;Olympus IX81显微镜,日本Olympus公司。
1.2 MTT法检测细胞存活率和联合指数计算
将对数生长期EC109细胞悬液密度调整为5×107L-1,每孔 100 μL接种于 96 孔板,于 37oC,5% CO2培养箱中培养至细胞融合80%后,将Gyp LI(0,3.125,6.25,12.5,25,50,75,100和200 μmol·L-1)、DDP(0,3.125,6.25,12.5,25,50,100,200,400和800 μmol· L-1)、Gyp LI 3.125 μmol· L-1+DDP(3.125,6.25,12.5,25,50,100和200 μmol·L-1)分别作用于EC109细胞24 h,细胞对照组加等量含血清和终浓度为0.01% DMSO的培养基,空白组不接种细胞,加等量含血清的培养基。每组均设3个复孔。培养24 h后,每孔加入MTT 溶液20 μL(5 g·L-1),4 h后弃上清,加入DMSO 150 μL,室温避光振荡,用酶标仪检测490 nm波长处吸光度(A490nm)值。细胞存活率(%)=(药物组A490nm-空白组A490nm)(/对照组A490nm-空白组A490nm)×100%,利用 GraphPad Prism 8软件计算半抑制浓度(half maximal inhibitory concentration,IC50)值。选择Chou-Talalay联合指数法分析两药物之间相互作用效果,利用CompuSyn软件计算联合用药指数(combination index,CI),CI<1表示协同作用,CI=1 表示相加作用,CI>1表示拮抗作用[21]。
1.3 显微镜下观察细胞形态变化
将对数生长期EC109细胞悬液密度调至2×108L-1,每孔1 mL接种于6孔板,待细胞融合80%后,设细胞对照组、Gyp LI 60 μmol·L-1组、DDP 35 μmol· L-1组 和 Gyp LI 3.125 μmol· L-1+DDP 10 μmol·L-1联用组,培养24 h后,光学倒置显微镜下观察细胞形态,拍照记录。
1.4 流式细胞术检测细胞凋亡率
取1.3分组处理的细胞,给药24 h后,收集细胞,采用Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒染色,流式细胞仪检测细胞凋亡率。
1.5 流式细胞术检测细胞周期
取1.3分组处理的细胞,给药24 h后,收集细胞,PBS洗涤2次,加入1 mL预冷的70%乙醇,混匀细胞,固定过夜。离心弃上清,PBS洗涤1次,采用细胞周期检测试剂盒染色,室温避光孵育20 min,流式细胞仪检测细胞周期。
1.6 划痕实验检测细胞迁移
取1.3分组处理的细胞,给药0和24 h后,于倒置显微镜下观察、拍照。细胞迁移率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.7 Western印迹法检测Bax、Cyt c、细胞周期蛋白A、细胞周期蛋白D1和MMP-9蛋白表达水平
取1.3分组处理的细胞,给药24 h后,加入100 μL裂解液,裂解后样品在4℃条件12 000×g离心,取上清。用BCA蛋白定量试剂盒对样品进行定量,将各组总蛋白浓度调整一致后,沸水浴10 min使蛋白质充分变性,进行SDS-PAGE,并湿转至PVDF膜上,用5%脱脂奶粉在摇床上室温封闭2 h。TBST清洗3次,每次10 min,加入一抗(Bax和Cyt c的稀释比例为1∶5000,细胞周期蛋白A、细胞周期蛋白D1和MMP-9的稀释比例为1∶200、β肌动蛋白稀释比例为1∶5000),4℃孵育过夜。TBST清洗3次,每次 10 min,加入二抗(1∶5000),室温孵育 2 h。TBST清洗3次,每次10 min,加入特超敏ECL化学发光液在数码凝胶成像系统发光成像。采用Image J软件对蛋白印迹条带进行积分吸光度(integrated absorbance,IA)分析,β肌动蛋白为内参蛋白。以目标蛋白与内参蛋白的IA值之比表示目标蛋白相对表达水平。
1.8 统计学分析
实验数据结果以±s表示,实验重复3次。采用Graphpad Prism 8软件进行统计学分析,组间差异采用单因素方差分析及t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Gyp Ll与DDP联用对EC109细胞存活率的影响
MTT结果显示(图1),与细胞对照组比较,随着浓度的升高,Gyp LI和DDP对EC109细胞抑制作用增强,Gyp LI和DDP对EC109细胞的IC50值分别为55.34±3.52和(37.48±2.99)μmol·L-1。当Gyp LI浓度为 3.125 μmol·L-1时,对EC109细胞无明显抑制作用,因此选择 Gyp LI 3.125 μmol·L-1与不同浓度的DDP联用。在恒定Gyp LI浓度为3.125 μmol·L-1条件下,联用组中DDP的IC50值为(8.05±5.34)μmol·L-1,低于 DDP 单独给药组的IC50值,联合用药组CI值均<1,说明两药联合使用具有协同抑制食管癌EC109细胞存活的作用(表1)。以 IC50值为参考,选择 Gyp LI 60 μmol·L-1、DDP 35 μmol·L-1为后续实验单独用药组药物浓度,选择Gyp LI 3.125 μmol·L-1和 DPP 10 μmol·L-1为后续实验联用组药物浓度,作用时间选择24 h。
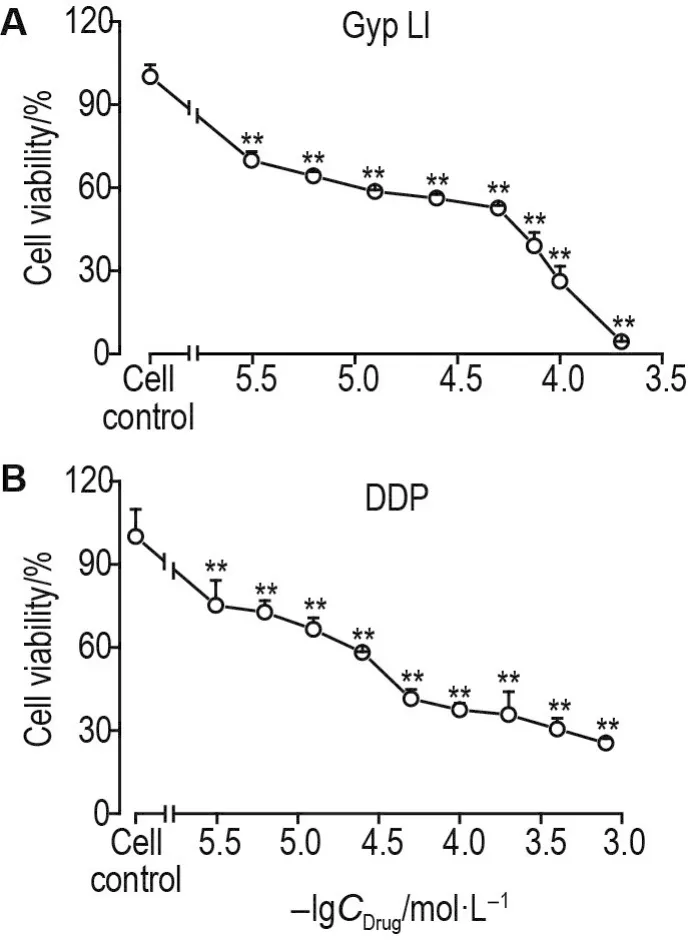
Fig.1 Effect of gypenoside Ll(Gyp Ll) and cisplatin(DDP)on viability of EC109 cells by MTT assay.100 μL of human esophageal cancer EC109 cells(5×107L-1)in the logarithmic growth phase were seeded in 96-well plants at 37oC,5% CO2until 80% of the cells fused,and treated with Gyp LI 3.125-200 μmol·L-1(A),DDP 3.125~800 μmol·L-1(B)for 24 h respectively.±s,n=3.**P<0.01,compared with cell control(0 mol·L-1)group.

Tab.1 Combination effect of Gyp Ll with DDP on viability of EC109 cells
2.2 Gyp Ll与DDP联用对EC109细胞形态的影响
光学显微镜下观察细胞形态(图2),EC109细胞在不同药物作用下细胞形态略有差别。细胞对照组细胞形态饱满、透亮,形状规则,边界清晰。Gyp LI 60 μmol·L-1组和 DDP 35 μmol·L-1组细胞生长缓慢,细胞间连接消失,形态不规则,与周围细胞脱离,少量细胞悬浮于培养液中。GypLI+DDP联用组细胞变圆皱缩,大量细胞脱落并悬浮于培养液中,凋亡样特征更显著。

Fig.2 Combination effect of Gyp Ll with DDP on morphology of EC109 cells.Cells were treated with Gyp LI 60 μmol·L-1,DDP 35 μmol·L-1and Gyp LI 3.125 μmol·L-1+DDP 10 μmol·L-1 for 24 h,respectively.Arrows show that the intercellular connections disappear and the cells become round and wrinkled.
2.3 Gyp Ll与DDP联用对EC109细胞凋亡的影响
Annexin Ⅴ-FITC/PI双染实验结果(图3)显示,与细胞对照组比较,Gyp LI 60 μmol·L-1组、DDP 35 μmol·L-1组和 Gyp LI+DDP联用组细胞凋亡率均显著升高(P<0.01)。与Gyp LI和DDP单独用药组比较,Gyp LI+DDP联用组细胞凋亡率显著上升(P<0.01)。

Fig.3 Combination effect of Gyp Ll with DDP on apoptosis rate of EC109 cells by flowcytometry.See Fig.2 for the cell treatment.B was the semi-quantitative result of A.x± s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with Gyp LI group;△△P<0.01,compared with DDP group.
2.4 Gyp Ll与DDP联用对EC109细胞周期的影响
细胞周期流式结果(图4)显示,与细胞对照组比较,Gyp LI 60 μmol·L-1组S期细胞比例显著增加(P<0.05),G2/M期细胞比例显著减少(P<0.01),说明Gyp LI能使细胞阻滞于S期。与细胞对照组比较,DDP 35 μmol·L-1组S期细胞比例显著下降(P<0.01),而G2/M期细胞比例显著上升(P<0.01),表明DDP能使细胞阻滞于G2/M期。与细胞对照组比较,联用组G0/G1期细胞比例显著上升(P<0.01),S期细胞比例显著下降(P<0.05),推测联用可使细胞阻滞于G0/G1期。与Gyp LI和DDP单用组相比,Gyp LI+DDP联用组所阻滞的细胞周期有所不同,Gyp LI和DDP分别将EC109细胞阻滞于S期和G2/M期,而Gyp LI+DDP联用则使EC109细胞阻滞于G0/G1期。

Fig.4 Combination effect of Gyp Ll with DDP on EC109 cell cycle by flow cytometry.See Fig.2 for the cell treatment.B was the quantitative result of A.±s,n=3.*P< 0.05,**P<0.01,compared with cell control group.
2.5 Gyp Ll与DDP联用对EC109细胞迁移能力的影响
从表观形态上看(图5A),细胞对照组划痕区的细胞数目明显增多,划痕边缘细胞增殖较多,愈合区域较大,划痕明显变窄;而Gyp LI和DDP单独给药组划痕区存活细胞较少,划痕面积无明显变化;Gyp LI+DDP联用组细胞数量减少,培养基中有悬浮细胞。说明Gyp LI、DDP单用和Gyp LI+DDP联用组对EC109细胞的迁移均具有一定的抑制作用,联用组的抑制迁移作用最强。划痕实验结果表明(图5B),与细胞对照组相比,Gyp LI 60 μmol·L-1组、DDP 35 μmol·L-1组和 Gyp LI+DDP 联用组的细胞迁移率均显著下降(P<0.01);与Gyp LI或DDP单用组比较,联用组细胞的细胞迁移率均显著下降(P<0.05,P<0.01)。

Fig.5 Combination effect of Gyp Ll with DDP on EC109 migration.See Fig.2 for the cell treatment.B was the quantitative result of A.Cell migration rate(%)=(0 h scratch area-24 h scratch area)/0 h scratch area×100%.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,compared with Gyp LI group;△△P<0.01,compared with DDP group.
2.6 Gyp Ll与DDP联用对EC109细胞促凋亡因子Bax、Cyt c、细胞周期蛋白A、细胞周期蛋白D1和MMP-9蛋白表达的影响
Western印迹实验结果显示(图6),与细胞对照组相比,DDP 35 μmol·L-1组和 Gyp LI+DDP 联用组细胞Bax蛋白表达水平显著升高(P<0.01),Gyp LI 60 μmol·L-1组、DDP 35 μmol·L-1组和 Gyp LI+DDP联用组Cyt c蛋白表达水平显著升高(P<0.01)。与Gyp LI 60 μmol·L-1组和DDP 35 μmol·L-1组相比,Gyp LI+DDP联用组Bax和Cyt c表达水平显著上升(P<0.01,P<0.05)。与细胞对照组相比,Gyp LI 60 μmol·L-1组细胞周期蛋白 A 表达水平显著降低(P<0.01),Gyp LI+DDP联用组细胞周期蛋白D1表达水平下降(P<0.05)。与细胞对照组相比,Gyp LI 60 μmol·L-1组、DDP 35 μmol·L-1组和 Gyp LI+DDP联用组MMP-9表达水平均显著下降(P<0.05,P<0.01)。与GypLI60 μmol·L-1组或DDP35 μmol·L-1组相比,联用组MMP-9表达水平显著降低(P<0.01,P<0.05)。

Fig.6 Combination effect of Gyp Ll with DDP on protein expressions of Bax,cytochrome c,cyclin A,cyclin D1 and matrix metallo proteinase 9(MMP-9)in EC109 cells by Western blotting.See Fig.2 for the cell treatment.B was semi-quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control group;##P<0.01,compared with Gyp LI group;△P<0.05,compared with DDP group.
3 讨论
本研究发现,Gyp LI与DDP分别在3.125~200 μmol·L-1和 3.125~800 μmol·L-1浓度均具有浓度依赖性抑制人食管癌EC109细胞存活作用,但DDP在浓度800 μmol·L-1单独作用于EC109细胞时细胞存活率仍较高,而在Gyp LI 3.125 μmol·L-1与 DDP 100 μmol·L-1联用时,细胞存活率显著降低,表明Gyp LI具有协同抑制EC109细胞存活作用,说明两药联用一定程度上增加了EC109细胞对DDP的敏感性;细胞凋亡实验结果表明,与DDP单用比较,Gyp LI与DDP联用显著促进了EC109细胞凋亡;细胞周期实验结果证明,Gyp LI使细胞周期阻滞于S期,DDP使细胞周期阻滞于G2/M期,两药联用使细胞周期阻滞于G0/G1期,联合用药和DDP单用时所阻滞的细胞周期不同,可推测它们诱导EC109细胞凋亡的机制不同;细胞划痕实验结果表明,Gyp LI与DDP联用时均能降低细胞迁移能力,与DDP单用比较,联用组细胞迁移率更低,提示Gyp LI与DDP联用抑制细胞迁移的作用更强;Western印迹法结果表明,与Gyp LI和DDP单用相比,两药联用时Bax和细胞色素c的表达水平均显著升高,而MMP-9的表达水平显著降低,说明Gyp LI具有促进食管癌细胞的凋亡和抑制其迁移的作用,而Gyp LI与DDP联用后具有更强的促凋亡和抑制迁移作用。
细胞凋亡主要有死亡受体介导的外部凋亡通路和内部线粒体通路。在线粒体通路中,BH3-only促凋亡蛋白可直接或间接激活促凋亡蛋白Bax或Bak,同时能够中和Bcl-2蛋白的抗凋亡作用,将凋亡信号传递给线粒体后,线粒体膜通透性增加,导致促凋亡因子Cyt c、线粒体次级凋亡蛋白和丝氨酸蛋白酶Omi等蛋白被释放到细胞质中,从而启动胱天蛋白酶级联反应,最终引发细胞凋亡[22]。本研究中,Western印迹结果表明,Cyp LI与DDP联用可使Bax和Cyt c表达水平均显著升高,表明Gyp LI与DDP联用可更好地促进细胞凋亡,其作用机制可能与触发了线粒体介导的凋亡通路从而诱导细胞凋亡有关。细胞周期阻滞是抑制癌细胞增殖的另一个主要靶点。细胞周期蛋白A和细胞周期蛋白D1是细胞周期的重要调节因子,细胞周期蛋白A调节细胞周期从S期转变至G2期[23],细胞周期蛋白D1和细胞周期蛋白依赖性激酶协同发挥作用,以调节细胞周期从G1期到S期的转变[24-25]。卢前微等[26]发现,苦参碱可通过减少U937细胞内细胞周期蛋白A的表达使细胞周期阻滞于S期,从而抑制U937细胞增殖。Kim等[27]发现,吲哚甲烷可通过降低细胞周期蛋白D1、细胞周期蛋白E2及细胞周期蛋白依赖性激酶4和6的表达使食管癌细胞周期阻滞于G1期,从而抑制了食管癌细胞的增殖。本研究发现,Gyp LI通过降低细胞周期蛋白A表达使细胞周期阻滞于S期,Gyp LI与DDP联用通过减少细胞周期蛋白D1的表达使细胞周期阻滞于G0/G1期。MMP-9是一种分泌性内肽酶,与细胞迁移密切相关[28]。本研究结果表明,Gyp LI与DDP联用可下调MMP-9表达,抑制细胞迁移,作用显著强于单独用药。
综上所述,Gyp LI具有较好的抑制食管癌EC109细胞存活作用,Gyp LI和DDP联用具有协同效应,可能通过上调Bax和Cyt c的表达、下调细胞周期蛋白D1和MMP-9的表达从而更显著地促进EC109细胞凋亡和抑制EC109细胞迁移。

