柴胡皂苷b2通过调控沉默信息调节因子6介导的糖代谢通路减轻二乙基亚硝胺诱导的小鼠原发性肝癌
有 曼,张 虹,何广宏,孟 璐,李瑞芳,王红伟
〔1.河南省洛阳正骨医院(河南省骨科医院)药学部,河南 洛阳 471000;2.河南科技大学基础医学院药学系,河南 洛阳 471000〕
肝癌是全球第六大常见恶性肿瘤,是肿瘤相关死亡的第四大原因[1]。据统计,超过50%的肝癌病例和死亡都发生在中国,其严重威胁着国人的生命健康[2]。原发性肝癌(primary liver cancer,PLC)按病理亚型主要分为肝细胞癌(hepatic cellular cancer,HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)和HCC-ICC混合型,这3种病理亚型的发病机制、生物学行为、组织学形态、治疗方法和预后等差异较大。HCC占PLC的85%~90%[3]。临床常用治疗肝癌的药物主要有多柔比星(doxorubicin,DOX)、五氟尿嘧啶和顺铂等。但这些化疗药物肿瘤细胞选择性差,易导致肿瘤中药物浓度不足、全身细胞毒性和肿瘤细胞耐药性等问题。近年来研发的新型抗肝癌药物奥沙利铂(oxalipatin)和索拉非尼(sorafenib)逐渐展现出各种优势,然而随着药物浓度的累积,其耐药性也开始逐渐增强,治疗有效性逐渐降低[4]。著名的索拉非尼肝细胞癌评估随机方案(SHARP)试验表明,与安慰剂组相比,索拉非尼可使患者总生存期延长2.8个月[5],然而在6个月内就开始出现耐药,疗效比较有限[6]。近年来越来越多的研究表明,从天然产物中提取的植物药物在治疗包括癌症在内的许多慢性疾病方面表现出了广阔的潜力。因此,寻找治疗肝癌的高效、安全、多靶点的新型抗肝癌药物显得尤为重要。
柴胡最早记载在中医专著《神农本草经》中[7],是我国传统的中药,已有两千多年的历史。其性味苦、微寒,归肝、胆经,常被用作解表、肝气郁滞等。近些年柴胡已被用作肝脏保护药,主要用于治疗各种肝病,如慢性肝炎、病毒性肝炎,甚至肝硬化引起的肝细胞癌[8]。柴胡皂苷(saikosaponins,SS)是柴胡中的主要生物活性成分,研究发现,它在体内外均具有抗炎、抗肿瘤、抗病毒和护肝活性[9]。根据结构差异,柴胡皂苷可分为柴胡皂苷a(SSa)、SSb1~SSb4和 SSc~SSi[10]。有研究表明,低 pH条件下,包括胃酸或中药醋炙,会导致柴胡皂苷成分的转化,主要由SSa向SSb1、SSd向SSb2转化。醋炙柴胡治疗肝病更有效、更安全,其中大部分SSd转化为SSb2[11]。目前研究显示,SSb2具有强大的抗病毒作用,但还缺乏更为深入、广泛的实验研究,有必要深入了解其药理作用,研究柴胡发挥护肝以及抗肿瘤功效的有效成分。本研究采用二乙基亚硝胺(diethyl nitrosamine,DEN)制备原发肝癌模型,探讨SSb2在护肝方面的药理作用,为开发新型药物提供一定的理论基础。
1 材料与方法
1.1 药品、试剂和主要仪器
SSb2(纯度>99%,19032104),成都曼思特生物科技有限公司;DOX(1804E2),深圳万乐有限公司;DEN(180711),阿拉丁试剂有限公司;谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、谷丙转氨酶(glutamate pyruvic transaminase,GPT)、乳酸脱氢酶(lactate dehydrogenase,LDH)和甲胎蛋白(alpha fetoprotein,AFP)测试盒,南京建成生物工程研究所;兔抗小鼠沉默信息调节因子6(silent information regulator 6,SIRT6)和兔抗小鼠丙酮酸脱氢酶激酶同工酶1(pyruvate dehydrogenase kinase isozyme 1,PDK1)多克隆抗体(一抗),武汉三鹰生物技术有限公司;兔抗小鼠葡萄糖转运蛋白1(glucose transporter 1,GLUT1)单克隆抗体,美国Affinity Bioscience公司;兔抗小鼠低氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)多克隆抗体、兔抗小鼠乳酸脱氢酶A(lactate dehydrogenase A,LDHA)多克隆抗体、兔抗小鼠β肌动蛋白单克隆抗体和辣根过氧化物酶标记山羊抗小鼠IgG抗体(二抗),武汉博士德生物工程有限公司;RIPA裂解液和BCA蛋白浓度测定试剂盒,北京碧云天有限公司;ECL底物液,北京普利莱基因技术有限公司。
GZX-DH-40Í45型倒置显微镜和Leica RM2128切片机,德国Leica公司;酶标仪,美国Thermo Fisher Scientific公司;垂直电泳槽、Trans-blot电转膜系统,北京六一公司;高速离心机,湖南湘仪实验室仪器开发有限公司。
1.2 动物、造模、分组和给药处理
60只健康雄性BALB/c小鼠,体重15~25 g,华中科技大学同济医学院实验动物中心,许可证号:SCXK(苏)2017—0001。小鼠适应性喂养7 d后随机分为6组:正常对照、模型(DEN 50 mg·kg-1,ip给药)、模型+SSb2 1.5,3.0和6.0 mg·kg-1(每日1次,ip给药)和模型+DOX 1 mg·kg-1(隔日1次,ip给药),每组10只。除正常对照组外,其余组小鼠ip给予DEN 50 mg·kg-1,每周2次;第5周开始DEN给药减为每周1次,同时按分组给予SSb2和DOX,正常对照组在建模期间给予等体积生理盐水,给药持续19周。
1.3 样本制备和计算肝指数
第19周末次给药后24 h眼框取血,4℃,925×g离心10 min,取上清液分装,用于后续血清学指标检测。处死小鼠,取肝,称重,计算肝指数,肝指数=肝重(g)/体重(g)×100。
1.4 苏木精-伊红(HE)染色观察肝组织病理改变
将肝组织在4%多聚甲醛溶液中固定12 h后石蜡包埋,制成4 μm切片,常规HE染色,在倒置显微镜下观察肝组织的病理变化。
1.5 试剂盒检测血液学指标
取1.3制备的血清,按照试剂盒说明检测小鼠血清中GOT,GTP,LDH和AFP的含量。
1.6 Western印迹法检测肝组织中SlRT6和糖代谢通路相关蛋白的表达
取小鼠肝组织100 mg,置冰上间歇匀浆,裂解,将裂解液转移到1.5 mL离心管内,14 800×g离心20 min。抽取上清,按BCA法测定蛋白含量。经SDS-聚丙烯凝胶电泳后转膜(200 mA,120 min),5%脱脂奶粉室温摇床封闭2 h,分别加入配好的一抗〔SIRT6、HIF1α、GLUT1、PDK1、LDHA和β肌动蛋白(1∶1000)〕溶液,4℃孵育过夜。TBST充分洗涤,用TBST稀释的HRP标记二抗(1∶50 000)浸泡PVDF膜,37℃摇床孵育2 h。采用ECL化学发光法显色,X光胶片压片后显影液发光显色,晾干胶片。采用Gel-Pro analyzer 4.0分析软件对条带进行分析,目的蛋白的相对表达水平以目的蛋白与内参蛋白积分吸光度值的比值来表示。
1.7 统计学分析
实验结果数据用±s表示,采用SPSS17.0分析软件对数据进行统计分析,采用单因素方差分析,组间两两比较采用Tukey检验,P<0.05表示差异有统计学意义。
2 结果
2.1 SSb2对DEN诱导原发性肝癌模型小鼠肝指数的影响
表1结果显示,DEN诱导小鼠19周后,与正常对照组相比,模型组肝指数明显升高(P<0.01);与模型组相比,模型+SSb2各剂量组与模型+DOX组小鼠肝指数均显著降低(P<0.01)。
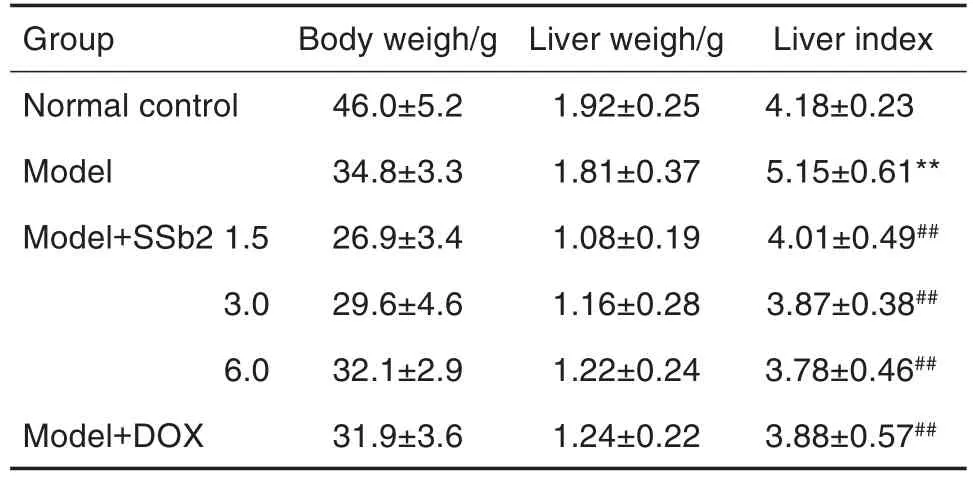
Tab.1 Effect of saikosaponin b2(SSb2)on liver index in the primary liver cancer model mice induced by diethyl nitrosamine(DEN)
2.2 SSb2对DEN诱导原发性肝癌模型小鼠肝组织病理变化的影响
如图1所示,正常组小鼠肝组织结构正常,肝索排列整齐,模型组肝细胞异形性明显,可见多发癌巢组织,肿瘤细胞排列成假腺样、腺管样结构(白色箭头所示),提示模型建立成功。而模型+SSb2和模型+DOX组癌巢数量减少。模型+SSb2 1.5 mg·kg-1组癌巢周围肝组织出现弥漫性水样变性(蓝色箭头所示),肝细胞点状坏死;模型+SSb2 3.0 mg·kg-1组肿瘤细胞胞浆出现嗜酸样改变(绿色箭头所示),灶状淋巴细胞浸润;而模型+SSb2 6 mg·kg-1组和模型+DOX组肿瘤细胞间可见大量淋巴细胞(红色箭头所示)和中性粒细胞浸润(黄色箭头所示),细胞出现片状坏死。提示SSb2对DEN诱导的肝癌有一定的抑制作用。

Fig.1 Effect of SSb2 on liver histopathology of primary liver cancer model mice induced by DEN(HE,200×).See Tab.1 for the mouse treatment.White arrows indicate tumor cells arranged in pseudoglandular or glandular tubular structures;the blue arrow shows the diffuse watery degeneration of hepatic cells;the green arrow indicates the eosinophilic change in cytoplasm of tumor cell;the red arrow indicates a large number of lymphocytes next to the tumor cells;the yellow arrow indicates a large number of neutrophils in the liver tissue.
2.3 SSb2对DEN诱导原发性肝癌模型小鼠血清GOT,GPT,LDH和AFP水平的影响
表2结果显示,与正常对照组相比较,模型组小鼠血清GOT,GPT,LDH和AFP水平显著升高(P<0.01);与模型组相比,模型+SSb23.0和 6.0mg·kg-1组和模型+DOX组小鼠血清中GOT,GPT,LDH和AFP水平均显著降低(P<0.01),模型+SSb2 1.5 mg·kg-1组GOT,LDH和AFP水平均显著降低(P<0.01),提示SSb2对小鼠肝功能损伤具有抑制作用。

Tab.2 Effect of SSb2 on levels of serum glutamic oxaloacetic transaminase(GOT),glutamate pyruvic transaminase(GPT),lactate dehydrogenase(LDH)and alpha fetoprotein(AFP)in primary liver cancer model mice induced by DEN
2.4 SSb2对DEN诱导的原发性肝癌模型小鼠肝组织中糖代谢通路相关蛋白表达的影响
Western印迹结果(图2)显示,与正常对照组相比,模型组小鼠肝组织中SIRT6蛋白表达水平显著降低(P<0.01),HIF-1α,PDK1,GLUT1和LDHA蛋白表达水平显著升高(P<0.01);与模型组相比,模型+SSb2各剂量组和模型+DOX组SIRT6蛋白表达水平明显升高(P<0.01),模型+SSb2 3.0和6.0 mg·kg-1组及模型+DOX 组 HIF-1α,PDK1,GLUT1和LDHA蛋白表达水平明显降低(P<0.01),模型+SSb2 1.5 mg·kg-1组HIF-1α,PDK1和LDHA蛋白表达水平明显降低(P<0.01),提示SSb2可能是通过上调SIRT6蛋白表达,从而抑制下游HIF-1α以及糖代谢通路因子GLUT1,PDK1和LDHA蛋白表达,进一步抑制肝癌发生发展。

Fig.2 Effect of SSb2 on expressions of proteins related to glucose metabolism pathway in liver tissue of primary liver cancer model mice induced by DEN by Western blotting.See Tab.1 for the mouse treatment.B1-B5 were the semi-quantitative results of A,respectively.SIRT6:silent information regulator 6;HIF-1α:hypoxia inducible factor 1α;GLUT1:glucose transporter 1;PDK1 :pyruvate dehydrogenase kinase isozyme 1;LDHA:lactate dehydrogenase A.±s,n=3.**P<0.01,compared with normal control group;##P<0.01,compared with model group.
3 讨论
本研究发现,SSb2给药后原发性肝癌小鼠肝指数降低,肿瘤细胞坏死增加,肿瘤生长被抑制。此外,SSb2给药组小鼠血清中GOT,GPT,LDH和AFP水平均降低,表明SSb2对DEN诱导的原发性肝癌模型小鼠肿瘤的发展具有一定的抑制作用。
目前,关于SSb2在治疗肝病方面药理作用研究较少。Lin等[12]发现,SSb2可在早期有效抑制丙型肝炎病毒进入体内,包括中和病毒颗粒、防止病毒附着和抑制病毒进入/融合。Shin等[13]发现,SSb2可能是炎症相关疾病潜在治疗药物,它可通过干扰NF-κB抑制蛋白激酶β和NF-κB抑制蛋白活化,有效抑制脂多糖诱导的促炎介质释放,从而阻止NF-κB活化。而本研究小组前期研究发现,SSb2可以通过下调NF-κB蛋白的表达以及上调SIRT6蛋白的表达,从而对脂多糖/氨基半乳糖诱导的小鼠急性肝损伤起到保护作用[14]。有研究表明,SIRT6在糖代谢过程中通过调控糖酵解影响线粒体呼吸[4]。Liu等[15]研究发现,SIRT6还可作为抑癌因子,与HCC的发生发展密切相关。Marquardt等[16]研究发现,人肝癌组织中SIRT6 mRNA和蛋白水平较正常癌旁组织明显降低,过表达SIRT6能抑制肝癌细胞体外增殖和裸鼠肿瘤形成。Zhong等[17]发现,SIRT6作为组蛋白H3赖氨酸9的脱乙酰酶,可控制多种糖酵解基因表达,尤其是可以共抑制HIF-1α。在SIRT6基因沉默的胚胎干细胞中,HIF-1α合成和稳定性增强,细胞葡萄糖摄取和糖酵解增强,有氧呼吸被抑制。这些表征与低氧条件下各种表征非常相似。此外,SIRT6敲除小鼠给予HIF-1α抑制剂后,小鼠血糖降低,提示SIRT6可能是通过HIF-1α发挥糖酵解调节作用。研究还发现,SIRT6与HIF-1α靶基因启动子结合,对组蛋白H3赖氨酸9产生去乙酰基作用,直接抑制多种葡萄糖代谢蛋白,如PDK1,LDH,PFK1和GLUT1等表达[18]。
本研究发现,DEN诱导的原发性肝癌小鼠肝组织中SIRT6蛋白表达水平显著降低,而HIF-1α,GLUT1,PDK1和LDHA表达显著升高,说明原发性肝癌小鼠肝组织SIRT6蛋白表达下调,其对HIF-1α抑制作用减弱,HIF-1α表达增强,下游糖酵解蛋白GLUT1,PDK1和LDHA的表达也随之增强。而SSb2以及阳性对照药DOX作用后,小鼠肝组织的SIRT6表达升高,而HIF-1α表达降低,糖酵解蛋白GLUT1,PDK1和LDHA表达也降低,说明SSb2可能是通过上调SIRT6蛋白表达,从而抑制HIF1α调控的糖酵解通路,最终实现对肝癌细胞增殖抑制。但本研究尚未观察SSb2是否直接通过SIRT6发挥调控作用,需深入研究。
综上所述,SSb2可抑制DEN诱导的原发性肝癌小鼠肝癌的发展,其机制可能与抑制SIRT6介导的糖代谢通路相关蛋白的表达有关。

