骨巨细胞瘤中H3F3A G34W 蛋白表达阴性病例的基因突变类型分析*
龙亚康,王苏杰,王芳,马伟峰,吴小延
510515 广州,南方医科大学 公共卫生学院(龙亚康、马伟峰);510060 广州,中山大学肿瘤防治中心分子诊断科(龙亚康、王苏杰、王芳、吴小延)
骨巨细胞瘤(giant cell tumor of bone, GCTB)是一种溶骨性肿瘤,占所有原发性骨肿瘤的4% ~ 5%,约占良性骨肿瘤的20%[1],多发于青壮年(20 ~ 55岁)四肢长骨骨端[2-3],儿童及青少年发病率较低,约为1.8% ~ 10.6%[4]。该病男性多见,男女发病率为(1.1 ~ 1.5)∶1.0[5]。组织学上,GCTB 以单核基质细胞为特征,核圆形至梭形,有单核巨噬细胞样细胞和破骨细胞样多核巨细胞。部分单核基质细胞表现出成骨细胞前体表型,这些细胞被认为是GCTB的肿瘤细胞,而单核巨噬细胞样细胞和破骨细胞样多核巨细胞则被认为是非肿瘤成分[6-7]。GCTB 有时会表现出继发性变化,例如动脉瘤样骨囊肿(aneurysmal bone cyst,ABC)变化、泡沫状组织细胞聚集和反应性骨或软骨质形成。GCTB 需要与来自各种类型的具有破骨性巨细胞的骨病变区分,包括软骨母细胞瘤、非骨化性纤维瘤、棕色肿瘤(甲状旁腺功能亢进)、巨细胞修复性肉芽肿、原发性 ABC 和骨肉瘤,尤其是巨细胞丰富型肿瘤。
组蛋白H3.3 由位于不同位点的两个基因编码:1 号染色体上的H3F3A 和17 号染色体上的H3F3B。先前的一项研究揭示了GCTB 中频繁发生H3F3A p.G34W 突变及软骨母细胞瘤中的H3F3B p.K36 M 突变[8]。随后的研究表明,大约85%到95%的GCTB 携带H3F3A p.G34W 突变,并且一小部分(约1% ~ 2%)携 带H3F3A p.G34L、p.G34M、p.G34R 或p.G34V 突变[9-11]。抗H3.3 G34W 突变抗体现在可用于免疫组织化学染色,但无法用于其他罕见突变[12]。在本研究中,我们对15 例经免疫组织化学染色评估H3F3A G34W 蛋白的表达为阴性的GCTB 病例进行H3F3A DNA Sanger 测序分析,探讨H3F3A G34W 蛋白阴性表达的GCTB 中H3F3A 的突变类型,为这些突变的诊断意义提供理论依据。
1 资料与方法
1.1 临床资料
收集2017 年1 月至 2022 年8 月中山大学肿瘤防治中心收治的确诊为GCTB 的15 例患者, 经免疫组织化学染色评估H3F3A G34W 蛋白表达均为阴性。患者肿瘤组织通过活检、刮除或切除获得,采用中性福尔马林固定,常规石蜡包埋。15 例GCTB 中,男7 例,女8 例,男女比例为1∶1.14,年龄15 ~ 55 岁。GCTB 的诊断均符合2013 年世界卫生组织软组织和骨肿瘤的组织形态诊断标准、临床特征、影像学特征及基因检测等结果。
1.2 免疫组织化学染色方法
免疫组织化学染色使用4 μm 厚福尔马林固定、石蜡包埋的组织切片进行。免疫组织化学采用EnVision 二步法,一抗 H3.3 G34W 兔单克隆抗体(SD350)购自通灵公司(稀释度 1∶400),二抗购自英国徕卡公司。同时设阴性及阳性对照。使用Leica 全自动免疫组化仪(Leica Microsystems Nussloch GmbH)对H3F3A G34W 进行免疫组化染色评估。
1.3 H3F3A 突变分析
进行PCR 和Sanger 测序分析以检测H3F3A 中的基因突变。对福尔马林固定和石蜡包埋组织的标本,使用 QIAamp DNA FFPE Tissue 纯化试剂盒(FFPE DNA Kit 试剂盒, QIAGEN 公司),根据试剂盒说明书,从组织标本中分离基因组DNA (gDNA)。对于每个样品,添加180 μL 裂解缓冲液和20 μL蛋白酶K 消化。涡旋混匀后,将样品在56℃的金属浴中孵育过夜。再经过核酸纯化,洗脱获得DNA。通过NANO 2000 对从 FFPE 样本中获得的DNA进行定量和定性分析,以确定浓度和纯度。仅当A260/A280 比值大于1.8 时,才认为 DNA 适合分子分析。PCR 反应体系:2×Premix EX TapTM 12.5 μL,10 μmol/L 扩增引物,60 ng DNA 模板及5.5 μL去离子水。PCR 扩增程序:94 ℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,共32 个循环;72℃ 5 min,4℃保温。用于PCR 和测序的引物为:H3F3A 上游引物(GGCTCGTACAAAGCAGAC); H3F3A 下游引物(CAGTACATTTATTTAAGCAGTAG)。 测 序 由 ABI 3500 XL 遗传分析仪进行。使用NCBI 数据库“国家生物技术信息数据库中心”(http://www.ncbi.nlm.nih.gov/BLAST) 中 的 Basic Local Alignment Search Tool (BLAST) 进行突变分析。
1.4 高通量测序
利用苏州吉因加生物医学工程有限公司 Gene+Seq 2000 测序仪进行测序。将基因组DNA 经超声波打断成 200 bp 左右的片段后,进行末端修复加碱基A,加上接头,通过PCR 扩增制备成文库;将样本文库与探针杂交捕获,洗脱,PCR 富集目标DNA 片段,制备DNA 纳米球,加入到测序芯片上,进行高通量测序;对测序结果进行生物信息分析,得出结果。
2 结 果
2.1 H3.3 免疫组织化学结果
GCTB 病变由单核细胞和破骨细胞样多核巨细胞组成。单核细胞显示H3.3 G34W 的核表达,本研究15 例GCTB 中所有病例肿瘤细胞皆为阴性(图1A、B)。
2.2 Sanger 测序结果
通过 Sanger 测序,对15 个H3F3A G34W(p.Gly34Trp,NM_002107.4)位点免疫组织化学呈阴性的病例,进行DNA 测序分析。结果显示10 例存在少见型的突变,分别为:1 例G34R(c.103G > C,Gly 34 Arg,NM_002107.4,1/15,6.7%)(图1C),2 例 G34V
(c.104G > T,Gly 34 Val,NM_002107.4,2/15,13.3%)(图1D),7例G34L(c.103G > C /104G > T及c.103G > T/104G > T ,Gly 34 Leu,NM_002107.4,7/15,46.7%)(图1E、F),其余5 例均为野生型(Gly 34,5/15,33.3%)。另外,G34L 有两种不同的碱基突变形式GGG > CTG及GGG > TTG。未发现有 G34W(c.103G > T,p.Gly-34Trp,NM_002107.4)的突变形式。
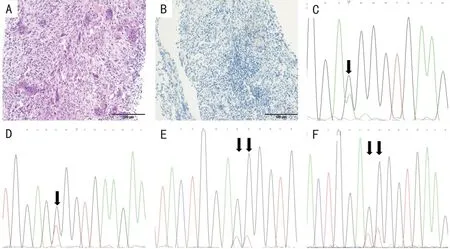
图1 骨巨细胞瘤H3F3A 免疫组织化学及基因突变检测结果Figure 1.Results of Immunohistochemistry and Gene Mutation of H3F3A in Giant Cell Tumor of Bone
2.3 高通量测序法验证Sanger 测序野生型的标本
本研究中,共有5 例Sanger 测序为野生型的样本,我们对其中3 例进行高通量测序验证,其余 2 例因核酸质量不足而无法进行进一步验证。结果发现,3 例原本是Sanger 测序野生型的标本,高通量测序结果仍为野生型(图 2)。
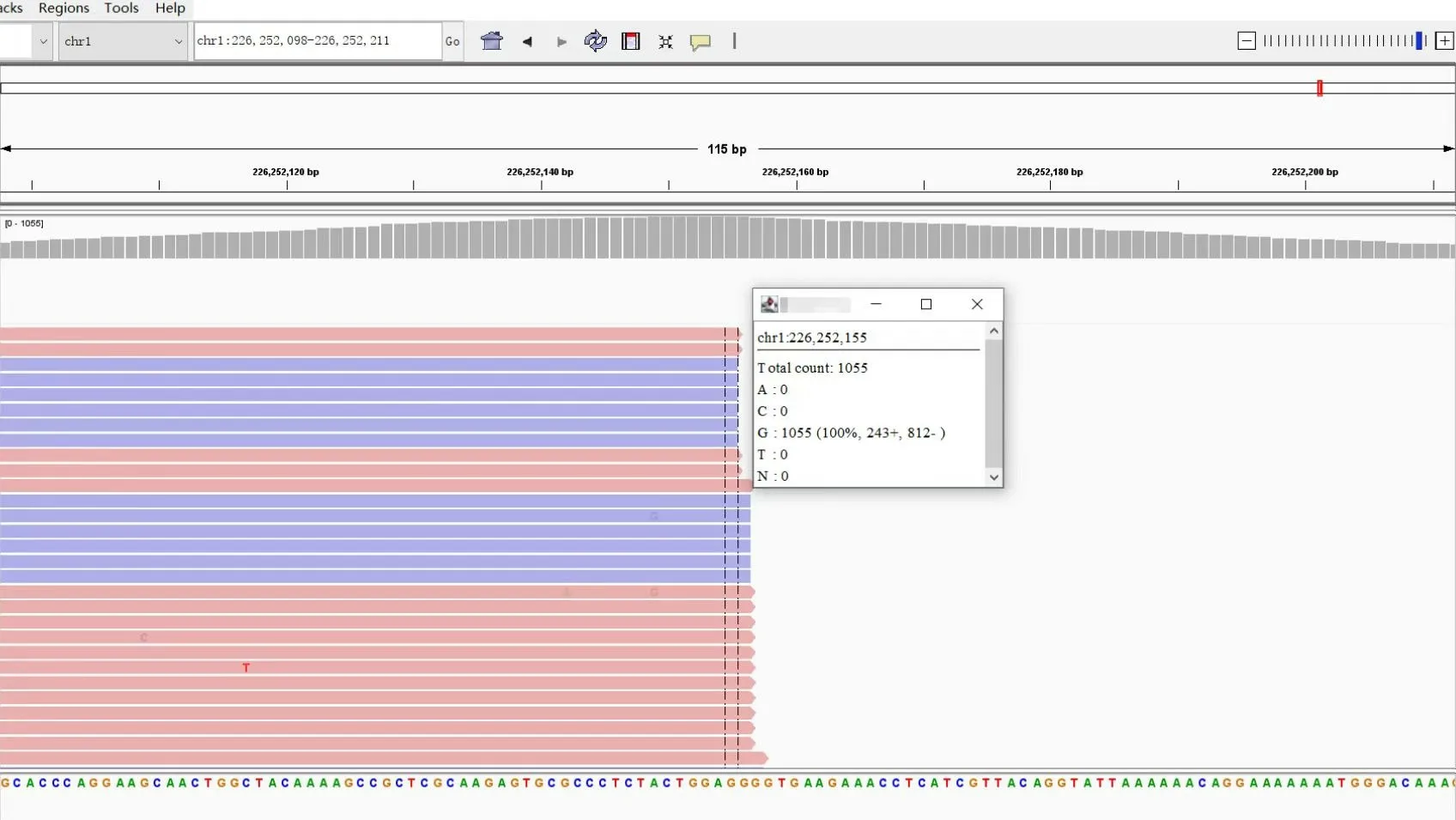
图2 骨巨细胞瘤H3F3A 高通量基因检测结果Figure 2.High Throughput Gene Detection Results of H3F3A in Giant Cell Tumor of Bone
3 讨 论
在GCTB 中,以往研究在位于染色体1q21 上的H3F3A基因里发现了杂合性的特定突变,编码蛋白质组蛋白H3.3[10]。这些突变可在 92% 的GCTB中检测到,并且仅存在于具有成纤维细胞样外观的肿瘤细胞群中,而不存在于巨细胞及其前体细胞中[12-13]。突变频繁发生于编码甘氨酸34 号密码子的103 位碱基。组蛋白 H3.3 的改变可能通过改变破骨细胞 RANKL(核因子Kappa-B 受体活化因子配体)的基本信号的表达导致破骨细胞激活异常[14-15],从而影响GCTB 的发展。
在骨吸收抑制剂denosumab 治疗后,GCTB 可能出现一系列形态变化,与治疗前差距较大,denosumab 治疗后的GCTB 特征包括OLGC 缺失、病变内大量骨沉积和胶原基质,以及无核梭形细胞取代单核肿瘤细胞的增殖,这些细胞在形态学上与GCTB几乎没有相似之处[16-17]。如果不了解denosumab 的先前治疗,这部分GCTB 可能被误诊为良性纤维骨病变或骨肉瘤等骨肿瘤[18-19]。因此,H3F3A 突变的分子检测对于 GCTB 与其他骨肿瘤的鉴别诊断具有重要的意义。
GCTB 中H3F3A 的突变检测,以往研究显示[12-13],可以使用免疫组织化学和单克隆兔抗体,该抗体靶向组蛋白3 上的突变位点G34W。该抗体检测H3F3A 突变的GCTB 时,单核细胞群表现明显强核染色,而包括破骨巨细胞在内的所有其他细胞核均为阴性。免疫组织化学是一种易于应用的方法,但使用该抗体的局限性在于它只能检测最常见的Gly34Trp 突变,少数GCTB 含有其他无法通过该方法检测的 Gly34 突变。 此外,应仔细考虑含有骨碎片的样品,因为抗原结构可能会受到脱钙过程的影响。
研究显示,一小部分 GCTB(1% ~ 2%)具有 H3-F3A p.G34L、p.G34M、p.G34R 或 p.G34V 突变[9-11]。Yamamoto 等[20]研究发现,原发性GCTB 免疫组化H3.3 G34R 阳性并伴有 H3F3A p.G34R 突变,及 H3.3G34V阳性并伴有 H3F3A p.G34V 突变,而所有 H3.3 G34W阳性的 GCTB 和非 GCTB 病变的 H3.3 G34R 和 G34V的免疫组织化学均为阴性。这些结果表明,除 H3.3 G34W 外,H3.3 G34R 和G34V 的免疫组织化学染色可能是 H3F3A 基因型诊断 GCTB 的高度特异性替代标志物。然而,有文献指出,H3.3 G34V 抗体和G34L突变蛋白之间会出现交叉反应,会成为诊断GCTB 的一个潜在陷阱,同时指出,H3G34 突变特异性抗体并不是脑肿瘤中H3.3 突变的完美替代物[21]。
我们采用Sanger 测序对15 例H3F3A G34W蛋白表达为阴性的GCTB 病例进行检测验证基因突变类型,发现其中10 例GCTB(10/15,66.7%)有G34R/V/L 罕见的突变类型。之前有研究显示[22],免疫组织化学和Sanger 测序两种方法结果一致的比例为 86%(43/50),而结果不一致的比例为14%(7/50)。对于不一致的样本,有的样本通过Sanger测序检测为野生型,而通过免疫组织化学检测出c.103 G > T 突变阳性,反之亦有。 这种差异可能是由于 Sanger 测序的敏感性低。通常,至少需要20%的肿瘤样本携带该突变,Sanger 测序才会检测到突变的等位基因,而免疫组织化学方法只需要部分细胞即可检测出来。对于无法通过免疫组化或Sanger 测序获得结果的病例,可以使用下一代测序方法进一步进行检测验证。免疫组织化学灵敏且快速,可在数小时内完成诊断,对大多数情况很有用,因为c.103G > T, p.Gly34Trp (NM_002107.4,NP_002098.1)覆盖了大约92%的阳性,如果免疫组化结果为阴性,可以进行 Sanger 测序进行验证分析。
本研究中,有5 例标本H3F3A G34W 蛋白表达和Sanger 测序结果均为阴性,由于免疫组化抗体种类受限,只能检测G34W 蛋白突变类型,而一代测序的灵敏度相对比较低,只能检测肿瘤细胞含量20%以上的突变,因而致低频突变容易产生误诊。鉴于以上两种方法会有漏检的情况,本研究对5 例野生型标本进行高通量测序,2 例标本因核酸质量不足而无法进行进一步验证,剩余3 例标本高通量测序结果仍为野生型。高通量测序因其灵敏度高,近几年在各种突变检测中不断被开发利用,对低频突变尤其占优势。
综上所述,通过免疫组织化学和Sanger 测序分析15 例 GCTB 病例,我们证明Sanger 测序是一种准确可靠的方法,可识别 c.103G > T (G34W) 和c.103G > C (G34R)等多种GCTB 中的H3F3A 基因突变形式。Sanger 测序似乎更准确,因为Sanger测序可以识别免疫组织化学阴性的病例。免疫组织化学可以用作第一种方法,它既快速又具有成本效益,同时具有高特异性和灵敏度。以上两种方法可以用于初步检测,但是,当检测结果为阴性或弱阳性时,建议使用高通量测序验证。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

