超声干预引导下经外周静脉置入中心静脉导管连续原发性导管异位复位1例
李雅婧,刘 腾,张雪花,窦健萍
解放军总医院第一医学中心介入超声科,北京 100853
经外周静脉置入中心静脉导管(peripherally inserted central catheter,PICC)因其留置时间长、并发症少、维护方便的特点,在临床上广泛应用于中长期静脉输液治疗的患者[1]。末端瓣膜式耐高压注射型PICC(Power PICC SOLO)具有高流速、无肝素封管、防止空气栓塞和血液反流等优点[2],同时,其耐高压特性(可耐受300 psi,1 psi=6.895 kPa)可满足临床增强检查时高压团注药物的需求,特别适用于肿瘤化疗患者。虽然,PICC具有诸多优点,但在置管术中及留置期间的并发症仍不可避免,其中,置管术中导管异位最为常见[3]。PICC导管异位主要分为原发性(术中)和继发性(留置期间)两种[4]。Schweickert等[5]的研究显示,PICC原发性导管异位发生率高达10%~60%。一旦发生原发性导管异位,需即刻进行导管复位,若复位失败,需拔除导管,重新置管。若不能及时发现导管异位,导管使用过程中会发生血栓形成、液体渗漏等并发症[6],严重时需拔除导管,甚至中止治疗。本文报道1例PICC连续原发性导管异位于超声干预引导下复位成功。
1 病历资料
患者男性,50岁,因间断腹痛于2021年10月26日就诊于大同市第五人民医院,肠镜检查可见距肛门55 cm处病变,穿刺活检,病理结果提示结肠中分化腺癌。既往体健,否认传染病、高血压、心脏病、精神性疾病,否认外伤史、手术史、输血史,否认药物、食物、花粉过敏,疫苗注射史不详。2021年10月27日腹部计算机断层扫描(computer tomography,CT)见胰尾占位,考虑胰腺癌。2021年11月4日正电子发射断层(positron emission tomography,PET)-CT检查提示胰腺癌、腹盆腔腹膜多发转移、腹腔积液、肋骨转移。为进一步明确诊断和治疗,2021年11月12日就诊于解放军总医院第一医学中心,2021年11月15日行胰腺病灶穿刺活检,病理结果提示胰尾中分化腺癌,拟行静脉化疗,2021年11月22日于超声引导下行Power PICC SOLO置管术,导管为巴德公司生产的5 F双腔Power PICC SOLO,超声仪为巴德视瑞5超声仪,PICC置管流程参照《输液治疗护理实践指南与实施细则》[7]。患者去枕平卧,右上臂外展与躯体呈90°[8],穿刺部位为右上臂中1/3区域,穿刺静脉为贵要静脉,测算导管-静脉比<45%[9]。一次性穿刺成功,导管置入长度45 cm,置入过程顺利,未出现送管阻力和送管困难,抽回血顺利,超声探查颈静脉内未见导管影,初步判断送管成功,撤出导丝,连接输液接头,固定导管后行胸部X线检查以明确导管走行及导管尖端位置。
置管后胸片定位是确认PICC导管尖端位置的金标准[10],根据美国静脉输液治疗护理学会(infusion nursing society,INS)制定的标准,导管尖端应位于上腔静脉与右心房的上壁交界连接点(cavoatrial junction,CAJ)或靠近CAJ的上腔静脉下段[11]。本例患者胸片可见PICC导管锁骨下静脉异位,导管在锁骨下静脉与锁骨、第一肋骨交汇处折返后再次折返,尖端止于第一次折返处(图1)。右肩下垫枕抬高,术肢外展与躯体呈90°,去除敷料,大面积消毒铺巾,建立无菌区。超声科医师配合导管复位,应用开立S60彩色多普勒超声仪探查右锁骨下静脉及PICC导管,将超声探头定位于导管第一次折返外侧5 cm处,在超声监视下回撤导管至尖端可见。回撤长度20 cm,生理盐水清洁湿润外露导管,待外露导管室温下恢复硬度后抽吸20 ml生理盐水连接导管,嘱患者头偏向对侧,边推注生理盐水边缓慢送管,送管过程中超声探头实时监视导管尖端位置。经两次送管,导管顺利通过锁骨、第一肋骨与锁骨下静脉交汇处。导管尖端送至右静脉角处时遇阻力,抬高床头、持续推注生理盐水、超声探头追踪导管尖端的同时按压颈静脉,适时调整按压位置和角度使导管下行,头臂静脉内可见下行导管影,抽回血正常,超声探查同侧颈静脉未见导管影。固定导管,再次行胸片检查确定导管尖端位置,提示右侧颈静脉导管异位(图2)。患者呈平卧位,抬高床头45°[1],消毒铺巾建立无菌区,超声监视下回撤导管尖端至右锁骨下静脉内,术肢向头侧上移,与躯体呈160°[12],超声探头监视导管尖端的同时按压颈静脉[13],边持续缓慢推注生理盐水边送管两次,均未成功。术肢下移与躯体呈15°后上抬术肢,术肢位于躯体上方与躯体呈60°,嘱患者头偏向对侧,再次超声探头监视导管尖端的同时按压颈静脉,边持续缓慢推注生理盐水边送管,同时利用术肢上抬形成的重力作用,适时调整按压位置和角度使导管下行,送管顺利,超声探查头臂静脉内可见下行导管影,抽回血正常。超声再次探查同侧颈静脉未见导管影。固定导管,再次行胸片检查,结果提示导管位于上腔静脉内,尖端平第六胸椎下缘水平(图3),导管复位成功[7]。截至2022年1月8日,患者PICC导管应用47 d,未见静脉炎、穿刺点渗液等并发症,超声检查未见血栓形成,抽回血顺利,导管功能良好。
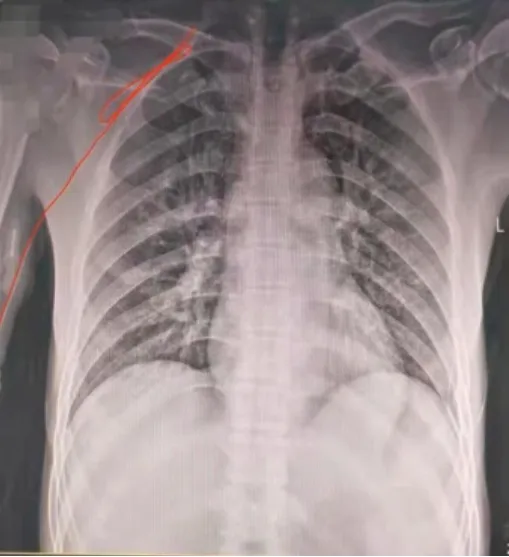
图1 导管锁骨下静脉折返

图2 右颈静脉导管异位

图3 导管进入上腔静脉
2 讨论
2.1 PICC导管异位原因及诊断手段
导致PICC导管异位的原因包括静脉选择、置管长度测量、局部血管解剖变异、体位、病情、操作者技术水平等[14]。目前,临床识别、诊断导管异位的手段包括数字减影血管造影(digital subtraction angiography,DSA)、X线、超声、心电图检查等[15-17],其中,X线因其诊断有效性、费用较低及普及性,成为临床识别、诊断导管异位的金标准,其不足在于存在职业暴露。DSA存在职业暴露[15]、费用昂贵、有创的不足,临床极少用于识别导管异位。心电图有助于将导管尖端置于CAJ,可识别导管置入过深(心脏内异位)。随着超声引导下PICC置管技术开展,置管成功率明显提高,同时可识别PICC原发性导管异位,尤是颈静脉异位,可即刻实施复位。
2.2 超声对PICC导管复位的实时监视、干预、引导
超声探查血管及导管具有实时、连续、动态、可视、精准、无辐射等优点[18-19]。本例患者导管连续异位于锁骨下静脉和颈静脉,分析原因:锁骨下静脉异位是由于锁骨、第一肋骨和锁骨下静脉交汇处狭窄[20],阻力增大所致。超声干预引导下可直观显示导管在锁骨下静脉内折返点(即受阻点)、导管走行、尖端位置,也可测量折返部分导管长度,为回撤导管长度提供依据。复位时,超声可实时追踪导管尖端运动轨迹。送管遇阻力时,可探查鉴别关联静脉及关联静脉与送管阻力的关系,同时,可利用超声探头按压关联静脉,实时调整按压角度,增加局部阻力,以使导管顺利进入上腔静脉。
超声波不能穿透骨组织,所以超声不能探查导管是否进入上腔静脉及到达上腔静脉的位置。锁骨下静脉异位导管复位以超声可见头臂静脉内下行导管影为依据判断导管复位成功。本例患者复查胸片提示导管异位于颈静脉,分析原因:导管在头臂静脉内折返,受骨组织阻碍,超声未能探查识别。外出复查胸片时,受患者活动影响,PICC导管上行进入同侧颈静脉,发生连续导管异位。在颈静脉导管异位复位中,超声追踪、引导送管、超声探头颈静脉局部加压、结合患者体位调整等措施复位成功,PICC导管尖端位于第六胸椎下缘水平。
2.3 超声干预、引导下多种复位措施联合应用可提高复位成功率
本例患者发生连续原发性导管异位,复位成功得益于超声干预、引导和多种复位措施的综合应用。经验丰富的超声科医师应用超声实时、动态、监视、追踪导管和超声探头局部加压增加阻力,可精准识别、追踪导管,鉴别关联静脉,寻找最佳加压位置,增加局部阻力的同时避免长时间压迫颈静脉导致的迷走神经反射。联合抬高床头45°、术肢上移与躯体呈160°、漂浮送管、重力送管等复位措施,肩下垫枕同时术肢外旋外展90°可缓解锁骨、第一肋骨对锁骨下静脉的影响,复位时头偏向对侧基于曾应用头偏向对侧复位成功颈静脉异位的经验。Power PICC SOLO导管为聚氨酯材质,室温下较硅胶材质硬,进入体内随体温软化,利用聚氨酯的这个特点,回撤部分导管后,使用生理盐水清洁,等待体外恢复硬度,有利于送管。
综上所述,原发性导管异位在PICC置管中较为常见,因导管材质、血管变异、选择静脉、体位、病情、操作者经验技术等原因,导管异位多种多样,各有特点。超声在及时识别、诊断原发性导管异位中发挥着重要作用,同时,可以利用超声的诸多优势,精准干预原发性导管异位的复位,配合其他复位手段,提高导管复位成功率,值得临床推广。

