微泡菌昆布多糖酶Lam128A 的酶学性质及酶解产物抗氧化活性
李鹤宾,王杨,银小倩,胡青松,吴婷,朱艳冰*
(1.厦门医学院药学系,福建厦门361023)(2.集美大学海洋食品与生物工程学院,福建厦门 361021)
昆布多糖(Laminarin)是一种水溶性天然多糖,主要来源于海带(Laminaria digitata)等褐藻细胞,是褐藻的重要贮藏多糖,约占其干重35%[1,2]。昆布多糖是一种带有β-1,6-侧链的线性β-1,3-葡聚糖分子,其结构特征随藻类不同而存在差异[3]。昆布多糖可作为糖化和发酵后生物燃料生产的初始物质,属于可再生生物质[4]。昆布多糖的降解产物具有抗氧化、抗凝血、抗细胞凋亡和抗肿瘤等生物活性,具有广泛的应用前景[5-7]。目前已有许多方法应用于昆布多糖降解,例如光催化降解[8]、γ射线辐射降解[9]和酶水解[10]。由于酶法降解具有专一性强、效率高、反应条件温和、产物易于控制,且最大限度地减少对糖分子修饰等特点,成为昆布多糖降解的优选方法。
昆布多糖酶(EC 3.2.1.39)又称为内切β-1,3-葡聚糖酶,是一种专一性水解β-1,3-葡聚糖中的β-1,3-糖苷键的酶类[11]。昆布多糖酶来源广泛,包括细菌、真菌、植物和软体动物等,其中微生物是该酶的重要来源。植物来源昆布多糖酶主要归属于糖苷水解酶17 家族(GH17),而细菌来源昆布多糖酶主要归属于GH16。目前已经报道的产昆布多糖酶的微生物包括强烈炽热球菌(Pyrococcus furiosus)[12]、类芽孢杆菌(Paenibacillussp.)[13]、纤维化纤维菌(Cellulosimicrobium cellulans)[14]、海洋红嗜热菌(Rhodothermus marinus)[15]、米黑根毛霉(Rhizomucor miehei)[16]、烟曲霉(Aspergillus fumigatus)[17]等。
在前期研究中,从腐烂海带中分离到海洋微泡菌ALW1(Microbulbifersp.ALW1)[18,19],该菌株的全基因组分析显示,基因Lam128A预测编码昆布多糖酶,本文进行微泡菌昆布多糖酶Lam128A 的克隆表达、酶学性质及酶解产物的抗氧化活性研究,为昆布多糖酶Lam128A 和昆布寡糖的进一步开发利用提供理论基础。
1 材料与方法
1.1 主要材料与试剂
海洋细菌Microbulbifersp.ALW1、E.coliDH5α、Pichia pastorisGS115 以及pPIC9K 质粒均为本实验室保藏。10 kDa 的超滤离心管为Millipore 公司产品;TaqDNA 聚合酶、T4DNA 连接酶、dNTPs、NotI、EcoR I、BCA 蛋白质测定试剂盒为TaKaRa 公司产品;质粒DNA 小量纯化试剂盒购自天根生化科技有限公司;DEAE-Sephrose Fast Flow 阴离子交换树脂为GE Healthcare 公司产品;昆布多糖、普鲁兰多糖、可溶性淀粉、木聚糖购于Sigma-Aldrich 公司;石耳葡聚糖购于ELICITYL-OligoTech 公司;其余化学试剂均为分析纯级产品。
1.2 主要仪器与设备
Avanti J-25 冷冻离心机,美国Beckman 公司;Epoch2T 微量酶标仪,美国BioTek 公司;冷冻干燥机,美国Thermo Fisher Scientific 公司;恒温水浴锅,上海精宏实验设备有限公司。
1.3 实验方法
1.3.1 昆布多糖酶Lam128A 的序列分析
利用ExPASy 中的ProtParam 工具对昆布多糖酶Lam128A 的DNA 和蛋白质序列、理论分子量和等电点等理化性质进行预测分析。采用信号肽预测工具SignalP v4.1 对昆布多糖酶的信号肽进行预测。在碳水化合物活性酶(Carbohydrate-Active Enzyme,CAZy)数据库中寻找不同家族来源的特征昆布多糖酶的蛋白质序列,利用MEGA7.0 构建微泡菌昆布多糖酶Lam128A 的系统发育树。
1.3.2 昆布多糖酶Lam128A 的克隆及其在毕赤酵母中的表达
以微泡菌ALW1 的基因组为模板,利用正向引物Lam128A-F(5'-ATTTGCGGCCGCTATGACTGCAGTG CAACCC-3',下划线为NotI 位点)和反向引物Lam128A-R(5'-CCGGAATTC GCGATTGCGGATTTTG TCC-3',下划线为EcoRI 位点)扩增昆布多糖酶Lam128A 基因,将目的基因克隆到pPIC9K 载体中,并经测序验证DNA 序列后,利用毕赤酵母GS115 细胞表达目的蛋白。将含有昆布多糖酶Lam128A 基因的毕赤酵母GS115 接种于YPD 种子培养基(20 g/L 胰蛋白胨、10 g/L 酵母提取物、20 g/L 葡萄糖、pH 值6.0)中,30 ℃、220 r/min 培养18 h。将菌液按1%接种量接入BMGY 培养基(20 g/L 蛋白胨、10 g/L 酵母提取物、100 mmol/L 磷酸钾、1.34 g/L YNB、4×10-5%生物素、10%甘油,pH 值6.0)中,30 ℃、220 r/min 进行培养,当OD600达到3.0~5.0 时,静置使菌体沉降。弃去上清,加入100 mL BMMY 培养基(20 g/L 蛋白胨、10 g/L 酵母提取物、100 mmol/L 磷酸钾、1.34 g/L YNB、4×10-5%生物素、0.5%甲醇,pH 值6.0)重悬菌体,继续进行培养(30 ℃、220 r/min)。每隔24 h,按体积比0.5%向培养基中加入甲醇,进行昆布多糖酶的诱导表达。培养7 d 后,4 ℃条件下8 000×g离心20 min,获得的上清液即为昆布多糖酶的粗酶液。
1.3.3 重组昆布多糖酶(rLam128A)的分离纯化
利用10 ku 的超滤膜对粗酶液样品进行浓缩,浓缩液经50 mmol/L Tris-HCl 缓冲液(pH 值7.0)透析后,上样于DEAE-Sephrose Fast Flow 阴离子交换层析柱(1.5×10 cm)。用相同缓冲液以1 mL/min 的流速进行流洗,待流出液的OD280趋近于零后,用含0.05~1.0 mol/L NaCl 的50 mmol/L Tris-HCl 缓冲液(pH 值7.0)缓冲液以1 mL/min 的流速对结合蛋白进行线性洗脱。在280 nm 处监测洗脱液,并进行昆布多糖酶的活力测定,收集有酶活性的样品,并利用50 mmol/L Tris-HCl 缓冲液(pH 值7.0)进行透析。利用BCA 蛋白质测定试剂盒测定样品的蛋白质浓度,并进行SDS-PAGE 分析。
1.3.4 昆布多糖酶的活力测定
采用3,5-二硝基水杨酸(DNS)法测定昆布多糖酶的活力[20]。取450 μL 浓度5 mg/mL 昆布多糖底物溶液(溶于50 mmol/L 醋酸盐缓冲液,pH 值5.5),加入50 μL 昆布多糖酶(0.5 mg/mL),于45 ℃条件下反应30 min 后,加入500 μL DNS 试剂,沸水浴处理10 min 后,在540 nm 处测定反应液的吸光值。在上述条件下,每分钟水解底物产生1 μmoL 还原糖(以葡萄糖计)所需的酶量为1 个酶活力单位(U)。
1.3.5 重组昆布多糖酶的底物特异性分析
以5 mg/mL 的昆布多糖、普鲁兰多糖、可溶性淀粉、木聚糖和石耳葡聚糖为底物来测定酶的活力,研究酶对不同类型糖苷键的水解能力。分别将50 μL 酶溶液(0.5 mg/mL)加入450 μL 相应底物溶液(溶于50 mmol/L 醋酸盐缓冲液,pH 值5.5),45 ℃反应30 min后,利用DNS 法测定酶的活力。
1.3.6 温度对重组昆布多糖酶活性和稳定性的影响
以5 mg/mL 昆布多糖为底物,测定不同温度(25~65 ℃)下rLam128A 的活力,以最高酶活力为100%,研究酶的最适反应温度。将rLam128A 置于不同的温度(25~60 ℃)下处理1 h,测定酶的残余活力,以未经热处理的酶活力为 100%,研究温度对rLam128A 稳定性的影响。
1.3.7 pH 值对重组昆布多糖酶活性和稳定性的影响
配制不同pH 值的缓冲液:50 mmol/L 醋酸盐缓冲液(pH 值3.0~6.0)、50 mmol/L 磷酸盐缓冲液(pH 值6.0~7.0)、50 mmol/L Tris-HCl(pH 值7.0~9.0)、50 mmol/L甘氨酸-NaOH(pH 值9.0~11.0),在不同pH 值条件下测定酶的活力,以最高酶活力为100%,研究昆布多糖酶rLam128A 的最适反应pH 值。将昆布多糖酶rLam128A 在不同pH 值条件下(pH 值3.0、5.0、11.0)、25 ℃处理120 h,每隔24 h 检测昆布多糖酶rLam128A的残余酶活力,以未处理的酶活力为100%,研究pH值对昆布多糖酶rLam128A 稳定性的影响。
1.3.8 重组昆布多糖酶的动力学参数测定
用50 mmol/L 醋酸盐缓冲液(pH 值5.5)配制浓度为0~18 mg/mL 的昆布多糖溶液,将昆布多糖酶rLam128A 分别与不同浓度的昆布多糖反应,测定酶的活力。利用Lineweaver-Burk 双倒数作图法,计算昆布多糖酶rLam128A 的最大反应速度(Vmax)与米氏常数(Km)。
1.3.9 化学试剂对重组昆布多糖酶稳定性的影响
将昆布多糖酶rLam128A 分别利用终浓度为1 mmol/L 或10 mmol/L 的不同金属离子、终浓度为2 mmol/L 或10 mmol/L 的金属螯合剂乙二胺四乙酸(EDTA)和还原试剂二硫苏糖醇(DTT)、终浓度为0.2%(m/V或V/V)或2%(m/V或V/V)的去垢剂[Triton X-100、Tween 20、Tween 80、十二烷基硫酸钠(SDS)、十六烷基三甲基溴化铵(CTAB)]、终浓度为2 mol/L或5 mol/L 的变性剂尿素,在25 ℃处理1 h 后,测定rLam128A 的残余酶活力,以未经化学试剂处理的酶活力为100%,研究化学试剂对rLam128A 稳定性的影响。
1.3.10 酶解产物的制备及抗氧化活性研究
利用50 mmol/L 醋酸盐缓冲液(pH 值5.5)配制10 mg/mL 的昆布多糖溶液,100 mL 底物溶液中加入2.6 U 重组昆布多糖酶,40 ℃反应12 h,用沸水浴处理10 min。4 ℃条件下8000×g离心20 min,利用10 ku的超滤离心管对所得上清液样品进行浓缩,收集滤过液,冷冻干燥至粉末。参考Zhu[18]等的方法,对酶解产物清除DPPH 自由基、ABTS 自由基、·OH 自由基的能力及酶解产物的还原能力进行测定,研究酶解产物的抗氧化活性。
1.3.11 数据处理
每组试验设置3 次平行,数据应用Excel 软件计算平均值,利用SPSS Statistics V17.0 软件进行差异显著性分析(p<0.05)。
2 结果与讨论
2.1 微泡菌昆布多糖酶Lam128A 的序列分析
微泡菌ALW1的昆布多糖酶Lam128A基因的开放阅读框由1545 bp 组成,编码具有514 个氨基酸的蛋白质,预测的理论分子质量为54.46 ku,理论pI 值为4.16。1-23 个氨基酸残基预测为信号肽。系统进化分析显示,Lam128A 与Lentinula edodes来源的昆布多糖酶(BAL27560.1)在同一分支(图1),后者是GH128家族的代表,说明本研究的微泡菌昆布多糖酶归属于GH128 家族。
2.2 昆布多糖酶Lam128A 的体外表达与底物特异性
利用聚丙烯酰胺凝胶电泳对表达蛋白进行检测,重组昆布多糖酶rLam128A 的大小在70 ku 左右(图2a),大于理论预测值,可能是由于蛋白质的糖基化修饰。酶的底物特异性分析显示,微泡菌rLam128A 除了对昆布多糖(β-1,3,β-1,6)有较好的水解性能外,对普鲁兰多糖(α-1,4,α-1,6)、可溶性淀粉(α-1,4)、木聚糖(β-1,4)和石耳葡聚糖(β-1,6)底物的水解效果不明显(图2b)。rLam128A 对上述多糖的活性谱表明,rLam128A 主要作用于含有β-1,3-糖苷键的昆布多糖,表明其是一种β-1,3-葡聚糖酶。rLam128A 的底物特异性与Flavobacteriumsp.来源的昆布多糖酶相似[21],但与来自Vibrio.campbellii的昆布多糖酶不同,后者对海带二糖(β-1,3)有强烈的偏好,但也催化纤维二糖(β-1,4)和龙胆二糖(β-1,6)[22]。

图2 昆布多糖酶Lam128A 的体外表达(a)及底物特异性(b)Fig.2 Expression of laminarinase Lam128A (a) and its substrate specificity (b)
2.3 重组昆布多糖酶的酶学性质
测定不同温度下rLam128A 的活力,发现酶的最适反应温度为45 ℃(图3a)。该酶在25~45 ℃处理1 h后,残余酶活性在95%以上;在50 ℃处理1 h 后,酶活力保留39.37%(图3b)。rLam128A 与来自Arca inflata的昆布多糖酶类似[23],在55 ℃下失活(表1);而S.cerevisiae来源的昆布多糖酶只在小于37 ℃的情况下稳定[24](表1);Aplysia kurodai来源的昆布多糖酶AKLam33 在45 ℃下温浴15 min 后,残余酶活力仅剩50%[25](表1)。在不同pH 值缓冲液中测定昆布多糖酶的活力,酶的最适反应pH 值为5.5(图3c)。4 ℃条件下,分别在pH 值3.0、5.0 和11.0 条件下处理96 h 后,残留酶活力仍有60%以上(图3d),说明在强酸和强碱环境下,微泡菌rLam128A 的pH 稳定性都非常好。rLam128A 在极端酸性和碱性条件下的pH 值稳定性优于来自Streptomyces matensis[26]和Mitsuaria chitosanitabida[27]的昆布多糖酶(表1)。微泡菌重组昆布多糖酶的动力学参数Km和Vmax分为4.34 mg/mL 和0.21 U/mg。

表1 一些表征的昆布多糖酶的热稳定性和pH 稳定性Table 1 Thermostability and pH stability of some characterized laminarinases

图3 温度和pH 对rLam128A 活性和稳定性的影响Fig.3 Effects of temperature and pH on the activity and stability of rLam128A
2.4 化学试剂对重组昆布多糖酶稳定性的影响
测定不同金属离子对rLam128A 稳定性的影响,结果如图4a 所示。1 mmol/L K+对酶活力有微弱促进作用;Na+、Mg2+和Ba2+对酶活力有促进作用,随着浓度升高促进作用增强。与之类似的,郑必胜等[28]的研究表明,Ba2+对裂褶菌来源的酶具有促进作用。10 mmol/L的Ca2+对酶活力有促进作用,而低浓度对酶活力无影响。Cu2+、Zn2+、Cd3+、Al3+和Fe3+对酶活力产生不同程度的抑制作用,Lee 等[11]的研究也表明,Cu2+和Zn2+对昆布多糖酶具有抑制作用。1 mmol/L 的金属离子中,Cu2+的抑制作用最强;10 mmol/L 的金属离子中,Al3+的抑制作用最强,酶活力基本丧失。

图4 化学试剂对rLam128A 稳定性的影响Fig.4 Effects of chemical reagents on the stability of rLam128A
测定其他化学试剂对rLam128A 稳定性的影响,结果如图4b 所示。还原试剂DTT 对酶活力有促进作用,且随浓度的升高促进作用明显增强,而螯合剂EDTA对酶活力影响不大。除了SDS 和CTAB,rLam128A 对测试的其他去垢剂表现出一定的稳定性,2%的Tween 20 和Tween 80 室温处理1 h,可以保留不低于60%的酶活力,而同样条件下经Triton X-100 处理后,酶活力保留38.57%。rLam128A 对尿素表现出一定的稳定性,5 mol/L 尿素室温处理1 h,可保留50.44%残余酶活力。
2.5 酶解产物的抗氧化活性
研究表明,分子结构、单糖单元的数量、支化度和长度,都可能影响昆布多糖的抗氧化活性[29]。昆布多糖经昆布多糖酶水解的产物主要为单糖、二糖和五塘等小分子单糖和寡糖[30]。本研究中,利用重组昆布多糖酶rLam128A 制备昆布多糖酶解产物,并进行产物的抗氧化活性分析。结果显示,当质量浓度为12.50 mg/mL时,酶解产物对DPPH 自由基的清除率达到63.62%,而昆布多糖对该自由基的清除率仅为14.40%(图5a),酶解产物对DPPH 自由基的半抑制浓度IC50为7.12 mg/mL。当质量浓度达到2.40 mg/mL 时,酶解产物对ABTS 自由基的清除率达到84.45%,而昆布多糖对该自由基的清除率仅为3.27%(图5b),酶解产物对ABTS 自由基的半抑制浓度IC50为1.01 mg/mL。昆布多糖及其酶解产物均对·OH 自由基表现出良好的清除效果(图5c),酶解产物对·OH 自由基的半抑制浓度IC50为2.40 mg/mL,低于昆布多糖。由图5d 可知,随着质量浓度的增大,昆布多糖及其酶解产物的还原能力均增强,但相较于昆布多糖,酶解产物的还原能力更强。综上,rLam128A 水解昆布多糖,获得的酶解产物具有更高的抗氧化活性。
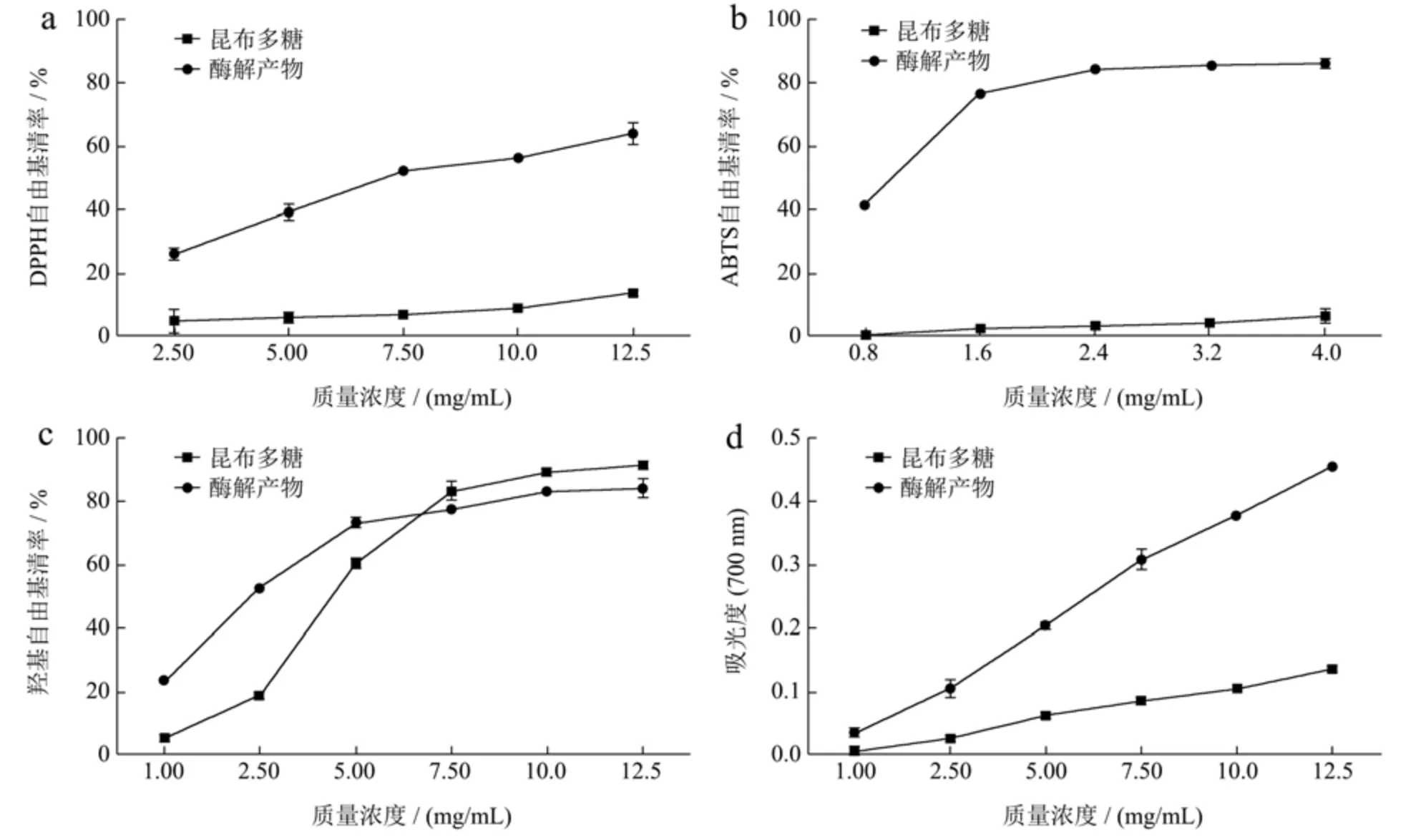
图5 昆布多糖及其酶解产物的抗氧化活性Fig.5 Antioxidant activities of laminarin and its enzymatic hydrolysis products
3 结论
本研究中,从海洋细菌Microbulbifersp.ALW1 中克隆昆布多糖酶Lam128A 基因,并在毕赤酵母中进行表达,获得的重组昆布多糖酶rLam128A 具有良好的温度稳定性,以及强酸和强碱环境中的稳定性。rLam128A能特异性水解昆布多糖,且水解产物的抗氧化能力提高。重组昆布多糖酶rLam128A 成为可能的工具酶,促进昆布多糖的高值化开发利用。

