生物利用度模型在纳米载药中的研究与应用
谢世英,赵英源,* ,薛文杰,周婧婕,谢思凡,王雪琴,张慧茹,小田裕昭
(1.河南工业大学生物工程学院,河南郑州 450001)(2.名古屋大学大学院生命农学研究科,爱知名古屋464-8601)(3.河南工业大学国际教育学院,河南郑州 450001)
药物的生物利用度(Bioavailability)是指药物分子进入机体后,从介质中释放的活性成分经口腔、胃、肠消化后被小肠上皮细胞吸收进入人体循环的程度,反映所给药物进入人体循环的比例[1,2]。药物经口服后在人体内的消化过程如图1 所示[3],其生物利用度体现了机体物理化学和生化过程的复杂性,主要包括药物成分从介质中释放、吸收、分布、代谢和排泄等过程。药物经摄入发挥药效需要克服人类机体的天然屏障,以药物经口服给药为例:首先,药物进入胃部的强酸性环境,接触胃蛋白酶的酶解系统;其次,药物通过十二指肠进入小肠,即进入人体的主要酶系消化场所;在经历了人体的两个主要消化部位后,药物需要被小肠中的肠上皮细胞吸收,才能到达血液送至靶细胞[4]。良好生物利用度的前提是具有充足的药物分子被小肠上皮细胞吸收并输送至人体循环,小肠上皮细胞对药物的吸收量可通过生物可给率进行评估。生物可给率(Bioaccessibility)是指生物活性制剂进入机体后,可被小肠上皮细胞吸收的活性成分的量[5]。然而在目前技术条件下,尚无较为准确可靠的方法进行药物体内生物可给率测定;为此,研究人员开发了技术成熟且可靠的体外模拟药物释放法,用以探究活性成分在人体内的释放动力学,获得相应的生物可给率,为药物生物利用度的研究提供重要依据[6]。
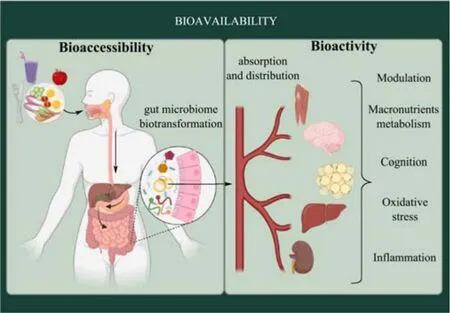
图1 药物和食物等经口服后在人体内的消化过程[3]Fig.1 The digestion process of drugs and food in the body after oral administration[3]
大多数天然或化学合成药物分子因其结构特殊性而不易稳定存在、水分散性弱、不耐酸碱、对光和热敏感[7]。由于首过效应,这些药物分子进入体内往往仅有很少部分能够顺利进入体循环作用于全身,导致了生物利用度低,从而限制了它们在各方面的应用。纳米技术的兴起和不断发展,为活性分子的有效应用开辟了新路径,现已广泛应用于医药、食品、生物等领域。纳米药物递送系统是指由大小为1~100 nm 的天然或合成的高分子和无机纳米载体,以不同的形式形成的载药纳米分散系统,该载体系统具有良好的生物相容性[8,9]。经过几十年的发展,载药载体在种类、数目、功能及药物研发领域的应用具有重大的突破。目前纳米载体的种类及数目发展由最早开始研究的纳米脂质体扩充到纳米凝胶、聚合物胶束、树枝状聚合物、纳米磁性颗粒[10],除此之外还包括当下较为流行的可对温度、pH 值、酸碱、磁场等具有智能响应型的纳米载体[11,12]。
本论文以纳米载体药物为前提,对药物生物利用度的药物缓释模型、体外模拟消化模型、细胞模型和体内药物代谢动力学等方法进行总结,同时探讨提高生物利用度的方法和今后应用展望。
1 生物利用度的研究模型
药物经纳米载体递送到达体内发挥药效,首先需从制剂中充分释放,因此药物分子的生物可给率是研究生物利用度和药代动力学的重要基础。生物可给率常用的定量方法为体外模拟释放。生物利用度的定量方法可简单分为体外(in vitro)和体内(in vivo)两类,体外研究方法常见为体外模拟消化和细胞模型,体内研究方法即测定活性分子的动物体内药物代谢动力学。
1.1 模拟药物释放模型
药物释放是指在规定条件下,药物从缓释制剂、控释制剂、肠溶制剂及透皮贴剂等制剂中释放的程度[13]。药物活性成分自口腔到达胃肠道后必须从载体基质中释放并溶解在生物体内部环境溶液中,与溶液中的成分相互作用从而被小肠上皮细胞吸收;而纳米载体的材料、物理化学特性(形态、大小、电荷、负载程度等)以及消化酶系等均会影响活性成分的释放[3]。目前可通过模拟药物释放获取药物的释放动力学,常用的纳米载体体外模拟药物缓释的检测方法有:透析袋法和反向透析袋法[14]、扩散池法[15]、流通池法[16]、外翻肠囊法[17]和样品分离分析法[18]等,其中样品分离分析法又包括离心/超速离心法搅拌法、超滤法和离心法等[19]。
体外模拟药物释放试验中,应尽可能减小纳米载体对药物成分分析的影响。透析袋法(Dialysis Bag Method)可以巧妙解决药物释放后药物与载体的分离问题,是目前最为常用的药物缓释试验方法[14]。透析袋通常是由人工或生物半透膜制成的袋状,透析袋膜的相对分子质量和内外释放介质体积的比例是透析袋法检测成功的主要影响因素[20]。不同规格的透析袋具有不同的截流分子量(Molecular Weight Cut-off,MWCO),可截留特定大小的分子,分子量较小的物质可透过膜孔不断扩散至透析膜外,直到袋内外两边的浓度达到平衡为止;因此,可利用透析袋这一特性充分分离载体与被释放的药物,一般试验要求MWCO 约为药物分子大小的100 倍[21]。常见的透析袋法是将待测物质加入装有释放介质的透析袋内,药物透过透析膜进入外部释放容器后进行取样检测,如图2a 所示[20]。该方法具有取样方便、能够及时分离药物分子与载体等优点,但搅拌装置在运行状态无法充分搅拌透析袋内部,无法充分模拟体内的蠕动状况。Kumar 等[22]在研究聚乙二醇化低分子量壳聚糖包载百里香醌的纳米胶囊时,采用透析法进行体外药物释放测定,并设计不同pH 值(胃部pH 值~1.5 和血液pH 值~7.4)的缓冲介质进行对照分析,其研究结果显示该纳米体系缓释性能良好,且在血液中的缓释性能优于胃部。反向透析袋法(Reverse Dialysis Bag Method)与常规的透析袋法相反,将待测物质分散在外部释放介质容器中,释放出的药物分子进入透析袋,检测样品分时段取自透析袋内部,同时立即添加等量的释放介质[14],如图2b 所示[20]。相对于常规透析法,反向透析法中的待测物质可以得到充分地释放和稀释,并扩散至内部环境,但取样较为繁琐[23]。

图2 透析袋法(a)和反向透析袋法示意图(b)[20]Fig.2 Diagram of dialysis bag method (a) and reverse dialysis bag method (b)[20]
扩散池法(Diffusion Cell Method)由接受池(Acceptance Cell)和供给池(Supply Cell)组成,两池之间通过天然生物膜或人工合成膜隔开[15,19],如图3所示[24]。扩散池包括立式、卧式和流通式扩散池三种,其中立式扩散池在药物递送系统领域应用最为广泛[24]。根据立式扩散池配置的不同可以分为Franz 扩散池、K-C 扩散池(Keshary-Chien)和J-L(Jhawar-Lordi)扩散池[15]。K-C 扩散池在接收池内设有搅拌系统用以提高流体混合效率,从而增加受体室中溶解介质体积较大(>15 mL)时的内容物均匀性,是为克服Franz扩散池的溶液流体动力学差、混合差以及供给池与接收池之间的温度差等局限性而设计;J-L 扩散池是在Franz 扩散池的基础上扩大化,配备有1 L 的USP 溶解容器作为接收池,大大增加了有效接触面积,其研发主要应用于栓剂药物的溶出度试验[15]。目前,扩散池法多用于局部给药和经皮给药等药物的药物缓释性能测试或药物透皮性能测试[15,25]。该法可通过选用不同的生物皮肤或膜,模拟和测量药物在不同阶段的吸收和代谢状况;但离体后的生物组织不易保存,且过度处理会损坏膜性能,从而影响试验结果[15,24]。

图3 立式Franz 扩散池示意图[24]Fig.3 Diagram of vertical Franz diffusion cell[24]
外翻肠囊法(Everted-Gut Technique)是通过体外孵育小肠研究营养物质、药物等在肠管吸收情况的一种实验技术[26]。首先取麻醉实验动物一段小肠,将其黏膜外翻,两端结扎,内充以适量液体;随后,置于待测样品溶液中进行孵育,在固定的时间间隔从肠道两侧取样,以确定药物的扩散率[14,26]。该方法可在真实的小肠环境模拟药物的吸收状况,为避免小肠组织活性丧失,应提供与正常的生理环境相似的培养液、适当的温度与振摇速度、通气等培养条件;具有操作简单、可控、重复性高等特点[27];但仍存在不足,例如试验要求在短时间内完成、外翻过程易损坏肠道组织形态,且离体后的组织脱离了机体的完整调节系统,导致试验结果与实际存在差异[14,28]。
样品分离分析法(Sample Separation Method)通过各种分离技术将药物与载体分离,在预定的时间间隔内将纳米颗粒从连续相中分离出,定期取上清液滤液进行累积药物释放量分析[18]。相关的分离技术包括离心搅拌法、超速离心搅拌法、超滤法和离心超滤法[18,19]。样品在分离过程中存在的机械力可能会破坏载体结构而导致药物的过度释放,从而与实际药物释放率存在较大差异;且过滤器过滤作为样品分离技术使用时,易引起过滤器堵塞和药物吸附到过滤器表面[19,21]。
药物溶出度(Drug Dissolution)是指在规定的溶剂和条件下,药物从片剂、胶囊剂、颗粒剂等固体制剂中溶出的程度[13]。根据美国药典(United States Pharmacopoeia,USP)和药品食品监督管理局(Drug and Food Administration,FDA)规定,可用于药物溶出度检测的试验设备包括往复式圆筒、流通池、桨叶式圆盘、旋转圆筒和往复式支架式装置等[29]。其中流通池法(Flow-Through Cell)是一种新型溶出度检查方法,同时可以用于获得药物的释放曲线[15]。该方法不仅在传统剂型(粉剂、颗粒剂、片剂、胶囊、肠溶片、栓剂和可注射混悬剂)中得到广泛应用,在贴剂、微球、药物释放支架、混悬剂、植入剂、纳米粒及脂质体等新剂型中的应用也逐渐普及[21,29]。流通池设备由储存器、用于溶解介质的泵、流动池和一个将溶解介质保持在(37±0.5)℃的水浴装置组成。试验时将待测样品放入流动池中,释放介质由泵流过该池,从载体中释放出的药物分子流过流动池中的过滤器,可通过在线或离线监测药物释放量;试验过程中介质的成分、pH值、流速可以根据实际情况进行改变,以更有效地模拟体内流体动力学[20,29]。但它的不足之处是设备维护昂贵,过滤器容易发生堵塞;若仪器出现故障,则需花费大量时间维修,从而影响试验进行。
1.2 模拟胃肠道消化模型
消化道是一个非常重要的人体结构,日常营养素与药物的摄取都需要依靠它。其整体可看作一个开放的管道,全长自口腔至肛门约8~9 m,由口腔、咽、食道、胃和小肠和大肠组成[30]。在食品、生物、医药等领域研发初期,常需要进行生物利用度试验对活性物质进行初步有效性判断。而胃肠道消化是最为关键的步骤,体内消化试验需在动物体内或人体内进行,往往存在实验结果重现性差、耗时耗资、取样困难、以及人道伦理等问题[31]。因此,科研人员开发了各种体外模拟胃肠道消化模型,从人体或动物受试者体内获得食物的转运时间、酶的种类、各组织器官的pH 值曲线、温度、收缩和蠕动、消化分泌率以及通过器官表面吸收水分和营养物质等数据,设计了一系列评价运载体在口腔及胃肠道模拟消化过程中的物理化学变化以及释放效果的方法和设备。
体外消化系统模型是基于对人体体内消化系统的仿生模拟而建立的,主要分为两个部分,即上消化道系统模型和下消化道系统模型。上消化道指口腔、咽、食管、胃、小肠(十二指肠、空肠和回肠),下消化道指大肠(盲肠、阑尾、结肠、直肠和肛管)、肛门。目前大部分模型主要模拟人体上消化道的口腔、胃部、小肠的一个或几个部位。体外消化模型包括静态消化模型和动态消化模型。
1.2.1 静态消化模型
静态体外消化模型在实验室最为常用,通常可在实验室以简单且基础的实验设备(锥形瓶、烧杯、离心管等)搭建而成,在设备中加入相应的模拟消化液进行模拟试验[32]。反应容器放置在温度为37 ℃的水浴或空气浴中,再结合磁力搅拌或者摇晃等物理机械条件,以及人工调节相应的pH 值即可进行体外静态模拟消化[33]。通常静态消化模型仅模拟消化道单个部位的消化状况,可根据实验需求加入不同消化液模拟体内消化情况。口腔可通过机械研磨器模拟咀嚼,唾液(Simulated Saliva Fluid,SSF)一般由唾液酶、0.1594%(wt.%,质量分数)NaCl、0.020% KCl、0.02%黏蛋白、0.02% NaN3(抗菌剂)组成,同时设定pH 值6.5~7.5和温度37 ℃;胃部可通过水浴摇床振荡2 h 模拟胃蠕动,胃液(Simulated Gastric Fluid,SGF)一般由0.32%胃蛋白酶、7 mol/L HCl、0.2% NaCl、0.02% NaN3(抗菌剂)组成,同时保持pH 值1~2 和温度37 ℃;肠液(Simulated Intestinal Fluid,SIF)可由0.68% K2HPO4、5 mmol/L CaCl2、10 mg/mL 胆盐、0.4 mg/mL 脂肪酶、0.02% NaN2(抗菌剂)组成,同时设定pH 值6.5~7.5和温度37 ℃;小肠的消化过程可通过维持恒定的pH值,同时水浴振荡2 h 进行模拟[34-36]。
INFOGEST 模型是最具代表性的经标准化的体外静态胃肠道消化研究模型,于2014 年由致力于研究充分模拟人类口腔、胃和小肠所需条件的国际科学院联盟提出[37,38],其模型示意图如图4 所示[3]。该组织对静态消化模型的胃肠液配制、温度、pH 值、离子成分、酶种类和含量、消化时间等进行标准化,具有经济性高、操作简易、可重复性高、体内-体外相关性高等优点,且使用该模型时参数值也可稍作调整[38,39]。现已广泛应用于监测蛋白质、淀粉和脂类在不同胃肠道区域的消化动力学,以及评估疏水性生物活性物质在胃肠条件下的稳定性、释放和生物可及性[39,40]。但也存在不足之处,如胃部pH 值为动态变化过程,食物进入胃部时其结构受体内胃部瞬时 pH 值影响很大,而INFOGEST 模型的pH 值为固定值,模拟胃肠道消化时忽略了这一过程,从而导致食物成分吸收的生物可给性或动力学不准确;另外,INFOGEST 模型试验周期可长达七天,在此期间添加的酶可能失活,从而影响系统的消化能力[37,39]。为克服INFOGEST 模型的不足,研究员们研发了一种半动态体外消化模型INFOGEST 2.0,该模型配备有动态调节pH 值、胃液分泌、酶分泌和胃排空系统,从而更真实地反映物质在胃中的消化过程[39]。

图4 静态INFOGEST 消化模型和动态SHIME 消化模型示意图[3]Fig.4 Diagram of static INFOGEST digestion model and dynamic SHIME digestion model[3]
静态消化模型具有设备简便、易操作、低成本和进行多样品分析等优点,但不同课题组间设定的活性物质用量、酶的添加量、pH 值、搅拌速度和时间均存在差异,导致各组之间结果可比性差[41]。与动态消化模型相比较,静态模型无法模拟体内胃部对物质的剪切、混合等物理过程,忽略了胃肠道pH 值和消化液分泌的动态变化过程,无法真实地模拟整体胃部消化情况而更适用于局部消化试验[42]。
1.2.2 动态消化模型
相对于体外静态消化模型,体外动态消化模型组成复杂,设备要求高而昂贵,但更加真实地模拟了体内消化环境,提供了酶、pH 值实时控制、充足的蠕动条件、压力等条件。体外动态消化模型有单室消化模型和多室消化模型。常见的单室模型有侧重模拟胃底和胃窦的DGM(Dynamic Gastric Model)模型、侧重胃部食物分解的HGS(Human Gastric Simulator)模型、可再现人体或动物结肠环境的ARCOL(Artificial Colon)模型等[41,43]。其中DGM 消化模型最为常用,因此动态单室模型主要介绍DGM 模型。多室消化模型有侧重胃和小肠消化的DIDGI®模型,模拟胃、十二指肠、空肠和回肠四个部位的TIM(TNO Gastrointestinal Model)模型、可模拟人体肠道微生物生态系统的SHIME(Simulator or the Human Intestinal Microbial Ecosystem)模型等[44]。其中TIM 模型最为常用,而SHIME 是目前模拟体内胃肠道系统最为全面的模型[30],因此多室动态模型主要围绕TIM 模型和SHIME模型展开。
DGM(Dynamic Gastric Model)模型是目前使用最多的单室模型,可模拟胃部的胃底和胃窦消化环境[43],其模型结构如图5a 所示[44]。DGM 模型桶体外壳为乳胶材质,内部设立两个相连的区域,分别对应胃底和胃窦。其中胃底为主体部分,部分消化物在该区域受到系统周期性加压而模拟动态消化;消化物到达胃窦区域时,桶体的上下运动为消化过程提供了高强度剪切力和研磨力,使得该模型具有高混合效率和充分降低颗粒大小的能力;另外DGM 模型内部设有阀门,通过计算机控制胃排空时间实时模拟胃排空[37]。
TIM(TNO Gastrointestinal Model)模型于上世纪90 年代初由荷兰TNO(Netherlands Organization for Applied Scientific Research)营养与食品研究中心研发,包括胃、十二指肠、空肠和回肠四个隔室[44],其模型结构如图5b 所示[45]。胃和十二指肠的分泌物由特定的蠕动泵控制;每个隔室通过将37 ℃的水泵入隔室内外壁之间的空隙来模拟人体温度,内壁通过连续的压缩和扩张对人体胃部蠕动进行复刻;每个隔间的pH 值由计算机监测,并通过pH 值电极进行控制[37]。研究人员在TIM 模型基础上进行改进,研发了不同用途的TIM模型,包括TIM-1、TIM-2、TING-TIM 和TIM-AGC模型,其中TIM-1 最为常用,模拟了包括胃、十二指肠、空肠和回肠四个隔室;TIM-2 是利用志愿者的粪便获取信息而设计的大肠消化系统;TING-TIM 是在TIM-1 模型基础上进行简化,并提高了容量,其胃部与TIM-1 相同,小肠部分由三个隔室简化为单个,并且没有回肠出口;TIM-AGC 则配备有更加先进的胃模型[30,45]。TIM 在模拟人体生理环境上具有可重复性高、可控和灵活等优点,通过时间和位置变化实时控制消化液的收缩、胃排空时间、pH 值、胃液分泌速度、吸收速率和水分准确地模拟动态胃肠道消化(GI)环境,对食品成分和药物进行充分地消化;除此之外,TIM模型还可以通过计算机控制胃的蠕动收缩和膜筛分技术模拟不同年龄阶段人群(婴儿、青少年、成年人、老年人)和动物物种的平均胃肠道状况、生物变异和疾病状况[30,31]。

图5 动态单室DGM 消化模型(a)和多室TIM 消化模型示意图(b)[45]Fig.5 Schematic diagram of dynamic single-chamber DGM digestion model (a) and multi-chamber TIM digestion model(b)[45]
SHIME®(Simulator of the Human Intestinal Microbial Ecosystem®)模型由比利时根特大学(Ghent University)根据原始的模拟成年人胃肠道的SHIME 模型研发而得,是目前报道的第一个模拟了几乎整个胃肠道(胃、十二指肠、回肠、升结肠、横结肠和降结肠,不包括口腔阶段)的体外多室系统[31],其基本结构如图4 所示[3]。胃部和十二指肠隔室采用填充式原理模拟食物吸收和消化的不同步骤,由蠕动泵按每天3次的频率向胃中泵入一定数量的SHIME营养介质和胃酶,并在小肠中添加胆汁。回肠、升结肠、横结肠和降结肠隔室是四个连续搅拌的釜式反应器,通过接种来自粪便的微生物建立了稳定的微生物群落,具有恒定体积和pH 调节系统[46]。反应器通过接种来自的粪便微生物系统模拟升结肠、横结肠和降结肠,因此该模型不仅从物理化学角度进行了全面模拟,还模拟了人体肠道微生物生态系统,是最为接近人体内部环境的体外消化模型[31]。但同时也存在经济性差、实用性差等问题,不适用于普通实验室研究,因此该模型目前多应用于食品和发酵领域,在医药领域的应用还有待研发。
1.3 细胞培养模型
生物利用度试验中常用的细胞培养模型有Caco-2细胞模型、MDCK 狗肾细胞、HT29 人类结肠癌细胞、肠上皮细胞IEC-18、HIEC 原代人类肠道上皮细胞等[47,48]。其中Caco-2 是体外模拟肠道吸收最为常用的细胞系,来源于人的结肠癌细胞,在体外培养条件下可自发进行上皮样分化,形成与小肠上皮细胞相同的微绒毛结构并紧密连接,结构和功能类似于人小肠上皮细胞,并含有与小肠刷状缘上相关的酶系,形态学、标志酶的功能表达及渗透特征都与小肠柱状上皮细胞很相似[14,49]。在Caco-2 细胞中,主要的药物转运体如寡肽转运体PEPT1、P-糖蛋白MDR1、多药耐药相关转运蛋白(MRP2)和有机阴离子转运多肽(OATP2B1)均有较高水平表达,能够快速得到药物的跨膜转运属性;此外,Caco-2 细胞还表达一些肠道常见的糖苷酶、氨肽酶、酯酶和代谢酶,可考察存在代谢的情况下药物的转运情况,因此广泛用于食品和药物等在肠道上皮的吸收和运输机制[50,51]。
Caco-2 细胞模型可以反映药物分子在体内肠道上皮细胞的被动和主动等转运途径,被认为是研究新药渗透性、转运体机制和相互作用的“黄金标准”[48]。但单层Caco-2 细胞一般需要3 周时间来完成细胞分化,因此实验周期较为漫长;且由于缺乏黏液层,相对于人体肠上皮细胞其跨膜电阻值(Transmembrane Resistance Value,TEER)通常偏高,细胞旁渗透性比人类上皮细胞低,以及所能反映的细胞被动转运旁路仍不全面,因此在模拟药物的转运吸收仍然存在局限性[48,50]。为提高Caco-2 细胞系的实验效率,研究人开发了不同的改进方案,包括在细胞生长培养液中添加牛血清、铁、激素和生长因子等来加速Caco-2 细胞生长,缩短实验周期;另外,目前已开发出结合三维模型(Three-Dimensional Models)加速培养周期为期4 天的Caco-2 细胞体系[48];Caco-2 细胞与Raji 细胞诱导分化的微褶皱M 细胞(Microfold Cells)的共培养模型[51],如Caco-2/HT29-MTX 共培养物[52];人工添加黏液层[53]等方法。
1.4 动物研究模型
通常药物进入体内后,人体会对药物进行吸收、分布、代谢,最终排出体外。体外消化模型虽然解决了体内动物实验经济性、复杂性、周期长、伦理性等方面的不足,但数据的可靠性无法替代体内分析。一般情况下,体内生物利用度的评估方法是将已知剂量的待测药物或其他生物活性分子通过不同的给药途径输送至器官和生理功能与人类相近的动物(鼠、狗、猪等)体内,并在一定的时间间隔内测定血或尿中待测物质浓度,获得药物在体内的药物代谢动力学参数,如时药曲线下面积(AUC)、最大血药浓度(Cmax)、达到Cmax的时间(Tmax)等。获得参数可进一步用于确定药物的分布情况、作用机制、用药量、给药时间间隔、靶向性能等。
纳米载体自发展至今,不断延伸向各类疾病药物的开发利用,动物试验也是评价一种新型纳米载体系统的性能必不可少的项目。为了更准确地研究药物的在人体体现的药理性质,往往需要建立合适的动物病理模型,例如常见的肿瘤模型和糖尿病模型等。以乳腺癌为例,其癌症肿瘤具有不同的分型和细胞株,相应的乳腺癌分型模型的建立方法也各不相同。刘昱芃[54]在研发应用于乳腺癌治疗的纳米载体时,将生长状态良好的4T1 细胞株接种于雌性Balb/c 小鼠的乳腺脂肪垫上,成功构建了乳腺癌原位模型。吴凯琪[55]则通过给健康小鼠皮下注射处理过的MDA-MB-231 细胞株成功建立了三阴乳腺癌皮下异种移植模型。糖尿病分为I型糖尿病和Ⅱ型糖尿病,且常伴有各类并发症,进行体内药物生物利用度研究时,需要根据药物的预期治疗目的建立病理模型,糖尿病动物模型常用链脲佐菌素、四氧嘧啶、地塞米松等诱导药物诱导建立[56]。Toragall等[57]研究壳聚糖-海藻酸钠-脂肪酸包载叶黄素纳米载体的药物代谢动力学时采用化学药物诱导法,通过对大鼠进行腹腔注射链脲佐菌素成功建立了糖尿病大鼠模型。根据链脲佐菌素注射计量不同,可以建立带有不同并发症的糖尿病小鼠。冷昌龙等[58]将50 mg/kg 的链脲佐菌素采用多次小剂量给药法连续注射4 d,并给与高糖高脂饮食成功构建了糖尿病肾病模型。彭伟康等[59]以60 mg/kg 剂量单次尾静脉注射给药成功建立了糖尿病性白内障小鼠。
虽然研究生物利用度方法多种多样且可根据实际需求进行参数改变,但在医药研发领域,仅有药物释放模型、静态胃肠道消化模型、细胞培养模型和动物研究模型较为常见,动态胃肠道消化模型在该领域的利用仍待研发。
2 提高生物利用度的方法
生物利用度的研究是证明食品与药物等对人体具有保健或治疗作用的重要参数。但大部分药物在进入体内运输至全身时,所剩药物量不足以达到治疗需求。为此,研究者开发了不同的提高生物利用度的方法。传统药物剂型如片剂、注射剂、混悬剂、乳剂等在一定程度上改善了生物利用度,但依然存在不少药物无法达到应用要求。近几十年兴起的纳米载体载药策略从以下各个方面改善了生物利用度低的问题:增强药物的稳定性[60];避免药物其受光、热、氧的影响[61];提高药物的溶解度[60,62];控制药物的释放速率,延长作用时间[62];降低药物胃肠道降解、提高药物吸收率[60];靶向释药[63]。
2.1 提高药物的溶解度
溶解度是指溶质分子在特定溶剂中可溶解的最大限度。溶质的物理特性(分子大小、形状、结晶度等)和化学特性(分子结构和官能团种类等)均会影响溶解度的大小;除溶质本身性质外,溶剂的极性、温度、离子强度、反离子的存在和酸碱度等对溶质的溶解能力也具有影响[64,65]。医药领域中许多热点活性分子均具有溶解能力差的缺陷,导致生物利用度低而不能满足实际应用需求。对此,研究人员开发了提高药物溶解度的方法,包括物理改性、化学改性和载体递送途径等。物理改性法通过物理机械力作用将活性分子进行微粉化减小颗粒尺寸,使得有效表面积增加达到溶解度增大的效果[65]。可以通过添加极性基团(如酮、羧酸等)对水溶性差的药物进行化学改性,使得氢键数量增加,从而提高溶解度[66]。载体递送方法包括将溶质分子制成环糊精络合物、磷脂复合物、固体分散体、聚合物纳米颗粒、固体脂质纳米颗粒、纳米乳、脂质体、聚合物胶束、固体自乳化给药系统等[63]。生物活性物质叶黄素具有广泛的治疗疾病潜力和典型的低溶解度特性,改善叶黄素生物利用度最为流行且有效的方法是载体递送途径,同时保护叶黄素不受外界环境损耗,靶向递送至治疗部位[66,67]。固体分散体制剂广泛应用于中草药活性成分的开发,该方法将活性成分在固体状态下通过熔融、溶剂或熔融-溶剂技术分散到惰性载体中,最终达到过饱和,使得活性成分的溶解量增加;同时惰性载体的存在阻碍过饱和溶液的晶体生成,可维持较长时间的过饱和状态,体系稳定性增加[68]。
2.2 控制释放
纳米载体的控制释放是指将药物与纳米载体材料结合形成新的纳米载药系统,当该体系进入体内后,可定向释放并控制药物从载体中的释放速率,以维持其在靶点部位中的有效浓度,从而达到延长药物作用时间、降低给药剂量、减少给药次数和提高生物利用度的目的[69]。传统的控制释放方法包括将活性成分制成片剂、栓剂、胶囊剂、膜剂、软膏剂等,存在用药剂量大、生物利用度低、副作用大、代谢速度快和患者依从性差等不足,已无法满足当下临床需求。现今最为流行的纳米递送技术解决了传统药物释放制剂存在的缺陷。以目前研发较为成功的载体纳米脂质体为例,因其出色的释放性能和材料低毒性而备受青睐,如脂质体紫杉醇[70]和脂质体阿霉素[71]等制剂已成功获得上市批准。脂质纳米粒同为脂类纳米载体,药物的释放通过降解、侵蚀或扩散实现,其机制取决于脂类及其组成、温度或表面活性剂、颗粒大小和pH 值[72]。但值得注意的是在高温或高浓度表面活性剂存在的情况下,脂质纳米粒具有突释效应(突释效应是指制剂在短时间内释放出大量的活性成分,使体内血药水平迅速增长而引起不良反应)[72]。因此开发释放性能良好的制剂对用药安全至关重要。
2.3 靶向释药
靶向释药是指药物分子在载体的作用下精准且高浓度递送释放至靶器官,从而达到高效低(无)毒的治疗效果。纳米载体的靶向策略包括直接在目标部位给予纳米载体、利用磁场将磁性纳米载体引导到目标部位、主动靶向和被动靶向[9]。由于疾病产生的感染、炎症等往往会在体内进行系统性的传播,因此直接在目标部位给药较为困难;磁性靶向目标部位虽然能一定程度上增加患病部位细胞对药物的吸收,但依赖于磁场强度、颗粒的理化性质、血液供应、目标组织的深度和血流速度等[9,73]。主动靶向是在纳米载体的表面载入配体分子(如:小分子、抗体、肽、转铁蛋白、多糖、低分子量维生素等),使其能主动与特定的受体结合,保留在目标部位并能被病变细胞主动吸收,具有特异性、高亲和力和高选择性[9,74]。被动靶向设计多用于肿瘤治疗,是使特定分子量大小的纳米载体可以通过炎症区、肿瘤组织或缺血组织的漏斗状血管外渗,从而增强纳米载体的渗透性,增加药物在疾病部位的积累,产生滞留效应。但低分子量药物的纳米载体会导致药物在靶点扩散至血液循环,引起毒性反应;该方法适用于分子量超过40 ku 的纳米载体[8,9]。
为实现药物的精准靶向递送,近几年研发出的刺激响应型纳米递送系统具有突破性进展。根据刺激条件的不同可分为内部刺激响应型和外部刺激响应型。内部刺激响应型靶点包括pH 值、酶、受体和氧化还原状态等;外部刺激响应型因素包括磁性、热、光(可见光、紫外光、红外光等)和超声波等[75,76]。另一种有前途的靶向释药方法是在前药设计基础上结合脂质的递送系统[72]。前药设计的目的包括增加药物的代谢稳定性;掩盖药物的不良气味;降低药物副作用或毒性;干扰转运,使药物定向靶细胞[72]。因此,将前药的设计结合具有靶向作用纳米载体可起到双重靶向作用,从而达到治疗目的。
2.4 其他
纳米载体对药物生物利用度所做的贡献远不止于上述所提,目前所研发的纳米载体类型已成千上万种。此外,为提高药物的生物利用度,纳米载体的研发往往对药物是多方面起保护和运输作用。如具有亲脂性的类胡萝卜素类天然功能性食品或药物分子,大部分存在溶解度较低和理化性质不稳定等不足,而通过纳米载体包载递送是当下较为流行的解决方案之一,其不仅可增加药物分子的溶解性和稳定性,且具有靶向递送功能,从而大大增加这类药物分子的生物利用度[77]。
3 结论与展望
生物利用度是检验纳米载体药物系统的安全性和高效性重要指标。本文主要从生物利用度的模型构建、研究方法、提高生物利用度的途径等方面进行综述。生物利用度检测方法主要包括体外药物释放试验、体外模拟消化试验、细胞培养模型和体内动物试验,各类体外试验方法均在一定程度上解决了体内动物试验存在的不足,但数据的可靠性和准确性仍无法替代体内真实情况,因此还需不断完善。至今,纳米载体药物系统研发主要从改善药物溶解度、控制药物释放和靶向释放药物等方面改善药物生物利用度,但目前已上市的高效纳米载体药物系统仍只占少部分。本文对生物利用度常见的研究模型和提高生物利用度的方法的总结,将为今后纳米药物递送体系的体外和体内生物利用度模型的应用和拓新提供参考。

