永存三叉动脉CT 血管造影与磁共振血管造影的表现及临床意义
陈梓盼,陈晓东,罗文暄,何 滨,管修汉,陈济琛,黄东玲,罗泽斌,罗树君
(广东医科大学附属医院,1.超声科;2.放射科,广东湛江 524001)
永存三叉动脉(PTA)又名原始三叉动脉、持续性三叉动脉,是一种颈内动脉海绵窦段与基底动脉的胚胎性吻合,是颈内动脉系统与椎-基底动脉系统之间最常见的异常交通动脉,属罕见的脑血管变异,发病率约为0.1%~0.6%[1]。PTA 一般无明显的临床症状,当动脉压迫邻近结构时可引起相应的症状如三叉神经痛、动眼神经和外展神经麻痹等。正确诊断该血管变异可为PTA 患者的临床诊断、治疗以及一些潜在并发症的预防等提供重要的信息。目前对于PTA 的影像表现报道较少,尤其同时对比分析PTA 的CT 血管造影(CTA)及磁共振血管造影(MRA)表现的文献更少。本研究对比分析了7 例PTA 患者的CTA 和MRA 影像学资料,以期为临床提高对PTA 影像征象的认识,减少错诊、漏诊提供参考。
1 资料和方法
1.1 一般资料
收集2018 年12 月至2019 年12 月在深圳市石岩人民医院接受CTA 和/或MRA 检查并诊断为PTA的7 例患者资料,其中男1 例,女6 例,年龄52~78 岁,平均68.6 岁。患者主要以不明原因的头晕、头痛、面神经麻痹、动眼神经麻痹等就诊,或怀疑脑梗死就诊。
1.2 扫描方法
CT 扫描,采用西门子SOMATOM Sensation 64层螺旋CT,非离子造影剂碘必乐(370 mgI/mL),扫描范围自颈2 椎体至颅顶。CTA 扫描参数:120 kV,220 mAs,层厚0.6 mm。先行头颅CT 平扫,在肘正中静脉以3.5~4.0 mL/s 速率注射造影剂60~80 mL,随后以相同速率跟注生理盐水20 mL,应用对比剂团注跟踪技术,监测点放在左颈总动脉分叉处,触发阈值100 Hu,延迟时间2 s。
MR 扫描,采用3.0T 磁共振扫描仪(GE MR750美国),8 通道头颈联合相控阵线圈,矩阵为512×512,扫描层厚6 mm,间隔1.5 mm。所有患者均行平扫及MRA 扫描,横断位T2 加权(T2WI)采用快速自旋回波序列扫描(TR 4854 ms,TE 113 ms),横断位T1 加权(T1WI)采用自旋回波序列(TR 400 ms,TE 10 ms),矢状位T1WI 扫描(TR 400 ms,TE 10 ms)。MRA检查采用三维时间飞跃法血管成像技术(3D-TOF MRA,TR 25 ms,TE 6.9 ms,层厚1.4 mm)。
1.3 图像处理
对CTA 和MRA 的原始图像进行容积再现(VR)和最大密度重组(MIP),结合原始图多方位观察血管走行,根据PTA 的定义确诊。由两名有经验的放射科副主任医师在PACS 工作站上采用双盲法分析图像并对PTA 动脉分型,意见有分歧时,经两人共同协商后达成一致。
1.4 PTA 分型方法
1.4.1 Saltzman 分型法[2]I 型:双侧小脑上动脉(SCA)和大脑后动脉(PCA)由PTA 供血,双侧后交通动脉(PCoA)发育不全或消失,常伴PTA 吻合点下方基底动脉(BA)发育不良;II 型:双侧SCA 由PTA 供血,双侧PCA 由PCoA 供血;III 型:一侧PCA 由PCoA供血,而另一侧PCA 则由PTA 供血。
1.4.2 Weon 分型法[3]I、II 型与Saltzman 分型法一致;III 型:同侧PCA 由PCoA 供血,对侧PCA 由PTA 供血;IV 型:同侧PCA 由PTA 供血,对侧PCA 由PCoA 供血(III 型和IV 型对应着Saltzman 分型法的III型,是后者的细分);V 型:其他的PTA 变异亚型,包括PTA 末端吻合于小脑上动脉、小脑下前动脉及小脑下后动脉等。
1.4.3 Salas 分型法[4]依据PTA 与展神经的关系,把PTA 分为外侧型(岩部型)和内侧型(蝶鞍型/中间型)。
1.5 吻合口以下基底动脉发育不良分级法[5]
吻合口以下基底动脉发育不良分级:0 级,正常;1 级,略细小;2 级,细小,但VR 图像上仍能显示;3级,非常细,VR 图像未见,薄层原始图可见;4 级,未发育即缺如。
1.6 PTA 血管分段方法
笔者根据本研究描述需要,以鞍背后缘或岩骨尖后缘为界,往前为近段(前段),往后为远段(后段,即桥前池段)。
2 结果
7 例中晕厥查因1 例,怀疑脑梗死2 例,右面神经麻痹症状1 例,怀疑脑动脉供血不足2 例,动眼神经麻痹查因1 例。5 例行MR 平扫+MRA 检查(4 例同时行CT 平扫检查,2 例同时行CTA 检查),1 例行MR 平扫+CT 平扫+CTA 检查,1 例行CT 平扫+CTA 检查。PTA 发生在左侧3 例、右侧4 例。见表1。
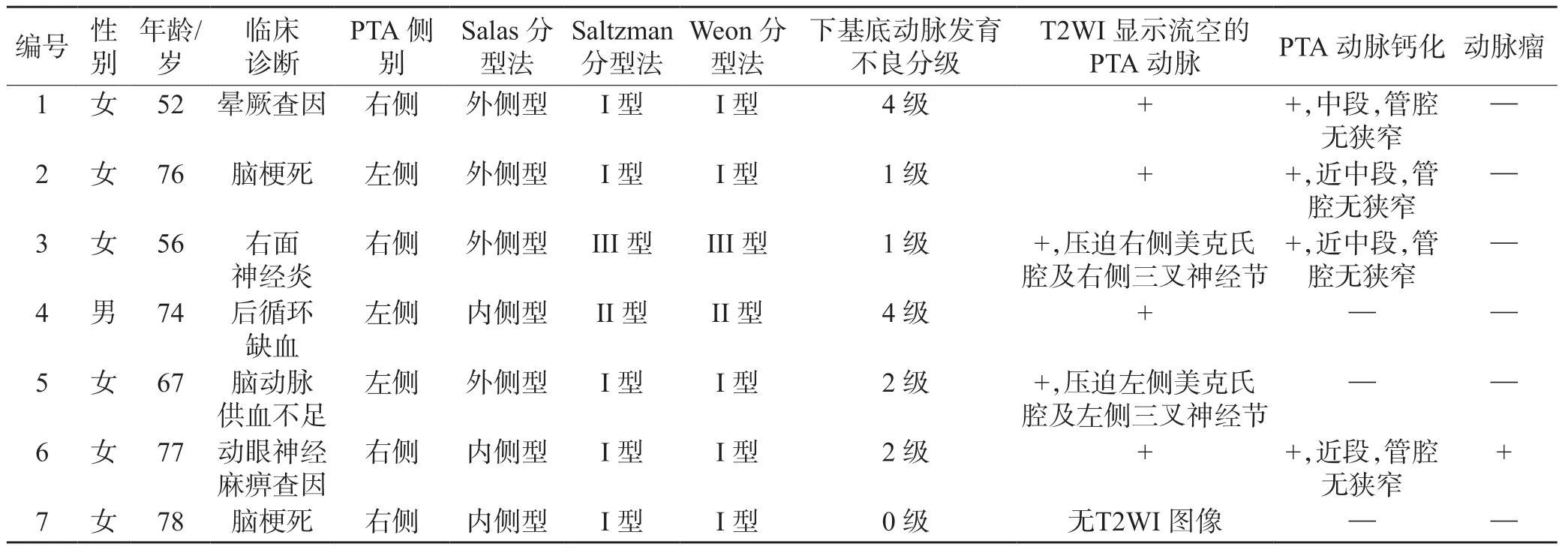
表1 7 例PTA 患者的临床资料及影像表现
根据Saltzman 分型法,I 型5 例,II 型1 例,III型1 例。根据Weon 分型法,I 型5 例、II 型1 例、III型1 例、Ⅳ型及V 型均0 例。根据Salas 分型法,内侧型3 例、外侧型4 例。吻合口以下基底动脉发育不良分级:0 级1 例、1 级2 例、2 级2 例、3 级0 例、4 级2 例。6 例有MR 平扫横断位T2WI 图像,鞍背或岩骨尖区及桥前池区均可见迂曲流空效应血管影。4 例PTA 可见血管钙化,均在近段,管腔未见明显狭窄。1例出现PTA 血管动脉瘤形成(病例6),发生于PTA 近段,距离颈内动脉PTA 开口处约5.0 mm,CTA 横断位测量动脉瘤大小约5.3 mm×3.5 mm,瘤颈部宽度约4.6 mm。病例典型图见图1、2。
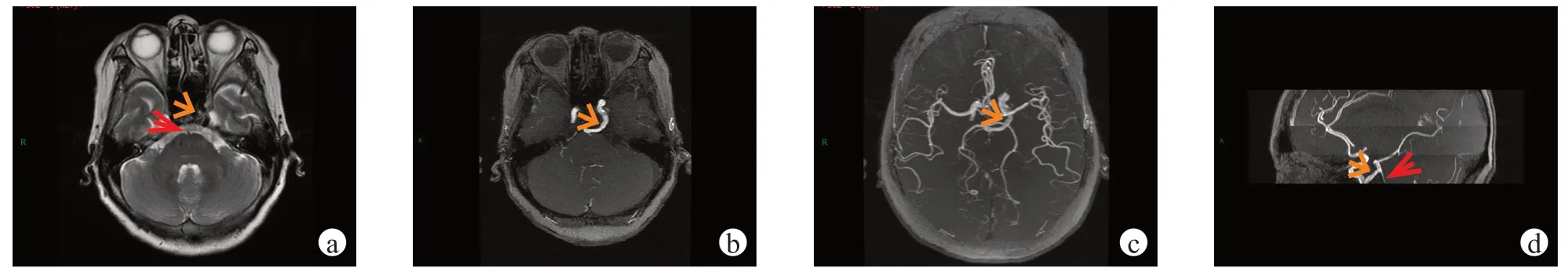
图1 女性,67 岁,头晕1 a 余查因。Saltzman 分型及Weon 分型均为I 型,Salas 分型为外侧型。图a 为横断位T2WI 序列;图b、c 为MRA 横断位最大密度投影法重建图;图d 为MRA 矢状位最大密度投影法重建图。图a 示PTA 呈流空效应低信号血管影(橙色箭),与左侧颈内动脉海绵窦段后方相连通,向后延伸至桥前池与基底动脉吻合,左侧美克氏腔受压变窄;图b~d 示PTA 血管(橙色箭)从左侧颈内动脉海绵窦段后部发出,绕蝶鞍外侧向后与基底动脉汇合,汇合点以下基底动脉细小发育不良(2 级,红色箭),双侧后交通动脉缺如,PTA 供应双侧小脑上动脉及双侧大脑后动脉
3 讨论
3.1 PTA 发病率及发生机制简述
PTA 在成人脑血管畸形的发生率极低,属罕见的胚胎遗留血管,基于MRA 及脑血管造影(DSA)发现率为0.1%~0.6%[1,6]。颈内动脉与基底动脉的胚胎性交通动脉从头侧到尾侧依次为三叉动脉、耳动脉、舌下动脉和寰前节间动脉。正常情况下,在胚胎大小为14 mm 时,上述胚胎性交通动脉开始退化,功能由后
交通动脉和椎动脉代替。如果这些动脉没退化,则演化为成人的永存颈内-椎基底动脉吻合动脉,其中PTA出现率最高,约85%~87%[7]。
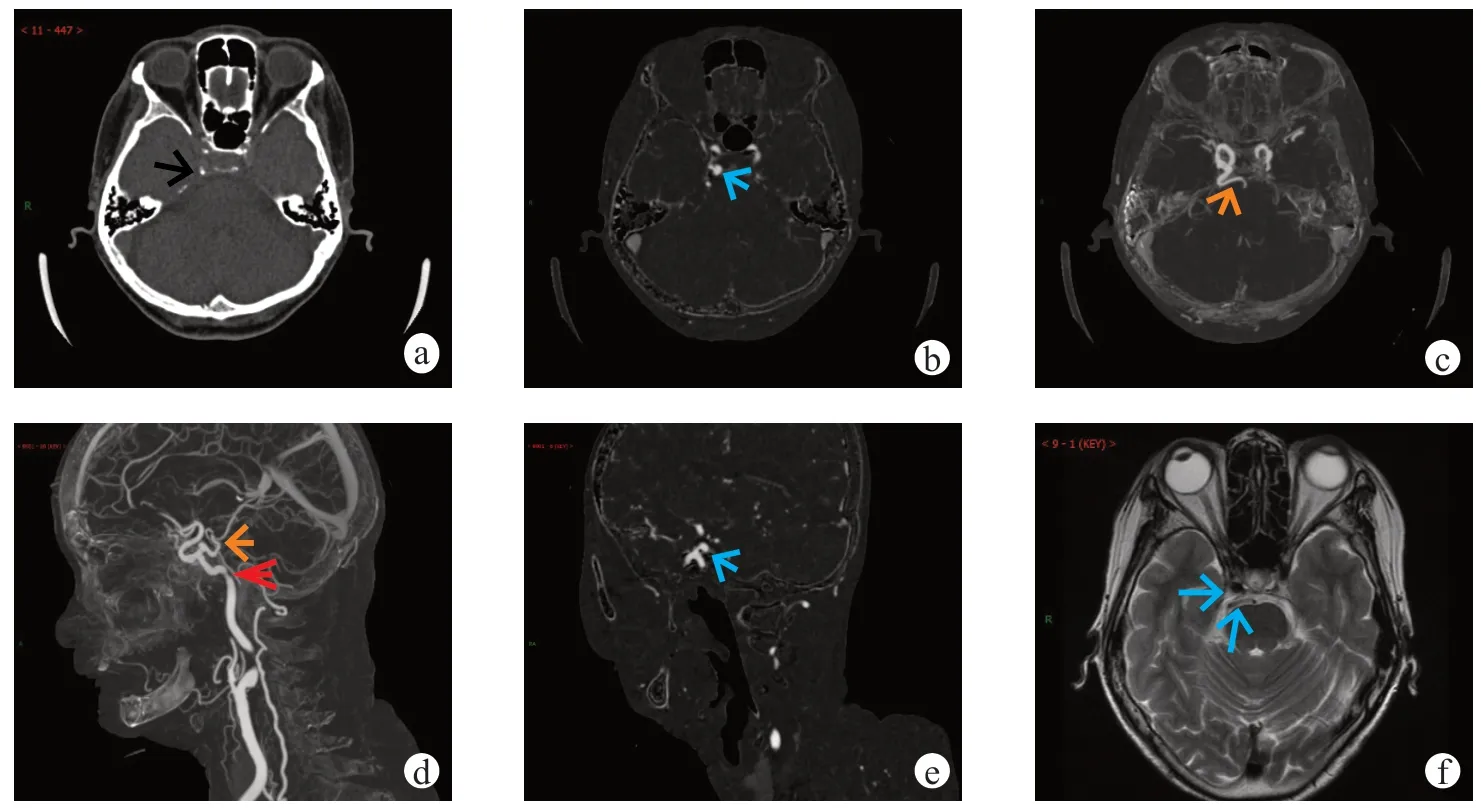
图2 女性,77 岁,动眼神经麻痹1 月余查因,临床初步印象为待排动脉瘤。Saltzman 分型及Weon 分型均为I 型,Salas 分型为内侧型。图a 为横断位CT 平扫(层厚1 mm);图b 为横断位CTA 薄层原始图(层厚为1 mm);图c 为横断位CTA 最大密度投影法重建图;图d 为矢状位CTA 最大密度投影法重建图;图e 为斜矢状位CTA 薄层重建图(层厚为1 mm);图f 为横断位T2WI 序列。图a 示PTA近段可见钙化(黑色箭);图b 示PTA 动脉瘤形成(蓝色短箭),距离PTA 颈内动脉开口处约5.0 mm,横断位测量大小约5.3 mm×3.5 mm,瘤颈部宽度约4.6 mm;图c、d 示PTA 血管(橙色箭)从右侧颈内动脉海绵窦段后部发出,绕蝶鞍内侧向后与基底动脉汇合,汇合点以下基底动脉细小发育不良(2 级,红色箭),双侧后交通动脉缺如,PTA 供应双侧小脑上动脉及双侧大脑后动脉;图e 示PTA 动脉瘤形成(蓝色短箭),与图b 同;图f 示PTA 呈流空效应低信号血管影(蓝色长箭),与右侧颈内动脉海绵窦段后方相连通,向后迂曲延伸至桥前池与基底动脉吻合
3.2 PTA 不同的分型方法
目前PTA 的分型方法常用的有3 种,分别为Saltzman 分型法、Weon 分型法、Salas 分型法。(1)Saltzman 分型法。1958 年Saltzman 首次以影像学表现和循环特征为依据将PTA 分为3 型。本组中I 型最多,其次为II 型和III 型,各1 例,这与文献报道基本一致[8-9]。但是越来越多的学者认为该分型中的III 型定义为I 型和II 型的混合型,概念不明确,且该分型方法无法阐述PTA 的全部解剖特点,不能准确评价一些PTA 病例变异[10]。(2)Weon 分型法。Weon 分型法的I、II 型与Saltzman 分型法的I、II 型一致。而将PTA仅供应单侧大脑后动脉者归为III、Ⅳ型,其中III 型为PTA 供应对侧大脑后动脉,Ⅳ型为PTA 供应同侧大脑后动脉;III、Ⅳ型是仅次于I 型的常见PTA 类型;V 型与其他分型不一样,其PTA 不是吻合于基底动脉,而是直接吻合于椎-基底动脉的分支,如小脑上动脉、小脑下前动脉、小脑后下动脉等。这种类型是PTA 中比较少见的类型,国内外的病例报道也不多[11]。Weon分型法相对Saltzman 分型法,其类别更丰富齐全,对PTA 的解剖特点阐述更明确。本研究中I 型5 例,II型1 例,III 型1 例,Ⅳ型及V 型均未发现。(3)Salas分型法。1998 年Salas 等提出了PTA 的另一种分型方法,其依据为PTA 与展神经的关系,分为外侧型(岩部型)和内侧型(蝶鞍型)[4]。多数PTA 属于外侧型,内侧型比较少见。本研究中外侧型4 例,内侧型3 例。该方法与前述两种方法的区别在于其主要着眼于PTA 的走行及毗邻关系,而非PTA 血管吻合变异情况。
基底动脉近端发育不良是PTA 的常见合并症[6]。Weon 等[3]研究中,基底动脉发育不良的发生率为62.5%,本研究中PTA 合并基底动脉发育不良为6 例(85.7%),略高于Weon 等报道。其中4 例均为略细小,2 例缺如。基底动脉发育不良与PTA 关系密切,且可能是后循环缺血的诱因之一[3]。故笔者认为在现有的3 种分类方法基础上,把基底动脉发育情况考虑到PTA 分型中形成一种新的分型方法,或许会更贴合临床诊治需求。
3.3 PTA 的临床症状
目前尚无证据表明PTA 是否会引起某些相应的临床症状。有些文献认为PTA 的存在改变了前后循环的血流分布,如后循环发育不良及对前循环产生“盗血”现象等,可能会引起后循环供血不足,前循环一过性脑缺血、脑梗死等症状[12-13]。Engelhardt 等[15]认为存在PTA 的患者临床表现多由合并疾病决定,PTA 只能通过影像检查发现而不能直接作为某类疾病的诊断要素,甚至有些文献认为PTA 的存在给颈内动脉-椎基底动脉系提供了一条沟通吻合的途径,可以减少脑缺血梗死病变的发生[15-16]。本组病例中5 例有不同程度的脑血管病变临床症状,但均合并颅脑多发缺血灶,其中1 例合并右侧基底节急性脑梗死,因此很难判断患者的脑血管病变临床症状是由PTA 引起的还是合并脑血管病变引起的。另外,PTA 与穿经海绵窦的动眼神经、滑车神经、三叉神经和展神经关系密切,可能会引起邻近相应受压神经的神经痛或神经持续性麻痹[16]。本组1例患者为三叉神经痛症状,1 例患者为动眼神经麻痹症状,可见PTA 压迫美克氏腔及三叉神经节,均未发现相应部位的异常病变,笔者推测这些症状可能由PTA引起。另外,PTA 动脉瘤形成并破裂可引起颅内动脉瘤破裂或颈内动脉海绵窦漏的临床症状。
3.4 PTA 的影像检查方法选择
PTA 以往主要依靠DSA 检出,但其为有创性检查、辐射大,而且由于视角局限很难准确判断PTA 分型。本研究结果表明MRA 和CTA 均可清楚显示PTA及作出准确分型。MRA 的优点在于无创、无辐射,且不用打造影剂,可以节约成本,减轻患者经济负担及避免造影剂引起的不良反应;缺点在于其空间分辨率较低,扫描时间长,血流较慢的血管和管腔纤细的血管信号较弱无法显示。另外,MRA 难以显示PTA 血管钙化和动脉粥样硬化斑块等[17]。CTA 的优点在于扫描速度快,易于显示PTA 血管钙化和动脉粥样硬化斑块等;缺点在于有辐射性,需要打造影剂,在增加患者经济负担的同时增加了患者的肾脏负荷,并且有可能发生造影剂相关不良反应。本组病例中,5 例行MRA检查(2 例同时行CTA 检查)确诊,2 例行CTA 检查确诊。因此,CTA 与MRA 两种检查手段均可准确检测出PTA。
3.5 PTA 影像特点
PTA 血管与颈内动脉及基底动脉等颅内血管的形态及密度/信号基本一致,因此,明确PTA 的起点、行程及止点即可明确诊断。从本文结果可见,CTA 与MRA 均可清楚显示PTA 的起点、行程及止点,对PTA可以作出明确诊断,并可清楚显示PTA 血管腔的情况,如是否存在狭窄或动脉瘤等。
PTA 血管从颈内动脉海绵窦段背部开口,向后经鞍背延伸进入桥前池与基底动脉吻合,走行较迂曲,管径由前往后逐渐变细,若中间管腔局部增粗,远端管腔比近端粗大的情况,则需注意动脉瘤形成或瘤样扩张发生可能。PTA 血管发生动脉瘤较少见[18-19],但亦有文献报道PTA 容易并发动脉瘤,且好发于PTA 与颈内动脉的吻合口处,但少见于PTA 与基底动脉的吻合口处[20-21]。本研究中出现1 例PTA 动脉瘤,位于近段,距离颈内动脉PTA 开口处约5.0 mm,这与柏天军等[9]报道的PTA 动脉瘤位置相似。但本研究中的PTA 动脉瘤位置更靠近PTA 颈内动脉开口处,推测可能是由于该处血流速度快,冲击力大以及PTA 血管壁本身较薄弱等[19,22]。PTA 血管管腔可发生钙化。本研究中有4 例发生钙化,均位于近段,可能也是受该段血流冲击力大等血流动力学因素影响。另外,本研究病例中PTA 近段发生钙化的,相应的颈内动脉虹吸段均可见钙化,推测PTA 近段的钙化可能与颈内动脉虹吸段钙化相关。
本研究中将PTA 血管以鞍背后缘或岩骨尖后缘为界分为近段(前段)和远段(后段,即桥前池段),基于以下几点考虑:(1)近段位于鞍背或岩骨尖内,PTA血管与周围骨质的对比不如远段PTA 与周围脑脊液的对比明显,尤其是鞍背骨质变化较多的情况下(如鞍背骨质硬化或蝶窦气化延伸到鞍背等),这种对比在平扫T2WI 图像上会更明显,使得远段相对近段更容易识别。(2)近段为硬脑膜外,远段为硬脑膜内,若发生某些病变如PTA 动脉瘤破裂,则引起的临床症状会不同。(3)近段与远段走行的解剖结构不同,细化分段更便于影像特征的准确描述。
PTA 血管在MR 平扫上显示为流空效应的血管影,尤其在横断位T2WI 图像显示较明显。头部MR 平扫时,若在T2WI 横断位图像上观察到起源于颈内动脉海绵窦段且与基底动脉吻合的流空血管影,需注意有PTA 存在的可能,若同时观察到该迂曲血管与基底动脉吻合点以下的基底动脉缺如或发育不良,则更加强烈提示PTA 的存在,进一步行MRA 或CTA 检查可明确诊断。本研究有1 例在平扫的基础上行MRA 后确诊为PTA。
3.6 鉴别诊断
在正确认识PTA 后,PTA 在MRA 或CTA 上往往都能得到正确的诊断,基本不需要与其他病变鉴别,但需注意有时候一侧后交通动脉缺如,另一侧后交通动脉走行迂曲延伸至鞍背区域时,需要与PTA 鉴别。后交通动脉起源于颈内动脉交通段,而PTA 起源于颈内动脉海绵窦段后部,据此可把两者区分开来。

