基于Illumina Hiseq高通量测序红曲霉转录组学分析
岳倩倩,赵永霞,王先桂,周礼红
(1.茅台学院 实验实训教学中心,贵州 遵义 564507;2.遵义医科大学 药学院,贵州 遵义 563003;3.贵州大学 生命科学学院,贵州 贵阳 550025)
红曲霉(Monascus)作为一种药食用丝状真菌,其次级代谢产物包括天然红曲色素、γ-氨基丁酸、莫纳可林(Monacolin)K、桔霉素等[1-2]。红曲色素作为一种聚酮类代谢产物,现已有110多种被发现[3],根据其溶解性可分为醇溶性和水溶性2种[4]。红曲色素具有食品着色剂的生物安全性和适用性[5],已被用于研制具有功能特性的调味品[6]、酒类[7]、肉制品[8]和面制品[9]等。除此之外,红曲色素具有羟基、醚键、羰基等官能团和共轭结构,具有抗突变[10]、抗癌[11]、抗肥胖[12-13]、抗氧化[14]、降血压[15]和抗阿尔兹海默症[4]等多种生物活性,使得红曲色素在功能性食品、制药等方面有更广的应用前景。
氮源作为重要的能源物质,对真菌生长发育过程中大分子物质有调控作用,已有关于构巢曲霉(Aspergillus nidulans)、粗糙脉胞菌(Neurosporacrassa)中氮代谢调控机制的研究[16-17]。岳倩倩等[18]考察不同的无机氮源对红曲霉菌丝生长和产色素的调控情况发现,铵态氮对红曲霉生长和产色素有促进作用,亚硝态氮则有抑制作用,但其氮代谢调控机制尚不清楚。
随着第二代测序技术的出现,组学技术应运而生。到目前为止,主要的组学方法包括基因组学、转录组学、蛋白质组学、代谢组学等[19-20]。其中,转录组学因其具有灵敏度高、费用低、针对性强、对其筛出的遗传标记可直接进行应用等优点而率先取得进步[21]。因其可以用于深度挖掘新基因、确定代谢途径及进化分析[22-23],已被广泛应用于生物学、医学、农学等领域。如稻曲病菌有性生殖中光诱导基因的转录组分析[24]、大青转录组测序及生物信息学分析[25]等。为深入研究氮源对红曲霉生长和产色素的调控机制,本研究分别以铵态氮、亚硝态氮为氮源培养安卡红曲霉(Monascus anka)菌株GZUM-25,采用Illumina二代测序平台对红曲霉GZUM-25进行转录组测序分析,分析不同氮源条件下调控红曲霉菌丝生长和产色素的差异表达基因,并对基因进行GO功能富集及KEGG通路富集分析,以期为后续红曲霉基因的深度挖掘提供信息资源和理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
安卡红曲霉(Monascus anka)GZUM-25:本实验室分离保藏。
1.1.2 培养基
沙氏琼脂改良培养基[25]:麦芽糖5 g/L,蛋白胨10 g/L,酵母膏5 g/L,琼脂20 g/L,葡萄糖20 g/L,pH自然,121 ℃高压灭菌25 min。液体培养基中不添加琼脂。
察氏培养基[25]:NaNO33g/L,K2HPO41g/L,MgSO·47H2O 0.5 g/L,KCl 0.5 g/L,FeSO40.01 g/L,蔗糖30 g/L,琼脂20 g/L,121 ℃高压灭菌25 min。
调控培养基:向察氏培养基中分别添加1%的NaNO2、(NH4)2SO4两种不同的无机氮源,用于红曲霉菌株培养。
1.1.3 化学试剂
麦芽糖、葡萄糖、酵母膏、蛋白胨(均为生化试剂):奥博星生物技术有限公司;NaNO2、K2HPO4、MgSO4·7H2O、KCl、FeSO4(均为分析纯):重庆北碚精细化工厂;(NH4)2SO4(分析纯):重庆川江化工有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
LDZX-50KBS立式高压蒸汽灭锅:上海申安医疗器械厂;SW-CJ-1F超净工作台:苏州净化设备有限公司;DH-360A电热恒温培养箱:北京科伟永兴仪器有限公司;THZ-82A数显气浴恒温振荡器:金坛市晶玻实验仪器厂;Trizol总核糖核酸(ribonucleic acid,RNA)抽提试剂盒、TruseqTMRNA sample prep试剂盒、Dynal M280磁珠:美国Invitrogen公司;NanoDrop2000:美国Thermo Scientific公司。
1.3 试验方法
1.3.1 红曲霉样品制备
将安卡红曲霉菌株GZMU-25接种到沙氏琼脂改良培养基上,30 ℃恒温培养10 d。将已活化的安卡红曲霉菌株GZMU-25用10 mL无菌水洗下后,将孢子悬液分别转移到含1%NaNO2和1%(NH4)2SO4的调控培养基中,分别编号为MP1、MP2,30 ℃、230 r/min条件下振荡培养7 d。培养结束后,将菌丝用无菌镊子挑出,用液氮速冻保存于-80 ℃冰箱。
1.3.2 总RNA的提取
采用总RNA提取试剂盒提取经液氮冷冻保藏的菌丝球总RNA,通过NanoDrop2000对所提RNA的浓度和纯度进行检测,采用琼脂糖凝胶电泳检测RNA完整性,Agilent 2100测定RNA完整值(RNA integrity number,RIN),挑选满足测序要求的RNA样本进行转录组测序。
1.3.3 文库的构建和Illummina Hiseq测序
利用带有Oligo(dT)的磁珠与poly A进行腺嘌呤(adenine,A)-胸腺嘧啶(thymine,T)配对,从样本MP1、MP2总RNA中分离出信使核糖核酸(messenger ribonucleic acid,mRNA),加入fragmentation buffer,将mRNA随机断裂成碱基长度为200 bp左右的小片段。在逆转录酶的作用下,加入六碱基随机引物,以mRNA为模板反转录合成第一链互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),随后进行第二链合成,形成稳定的双链结构。对双链cDNA进行末端修饰、片段大小选择,最后选择富集合格的文库进行Illummina Hiseq测序。
1.3.4 序列分析和功能注释
通过Illummina Hiseq测序得到包含测序接头序列、低质量读段、N(无法确定碱基信息)率较高序列及长度过短序列的原始测序数据,采用软件SeqPrep、Sickle对原始数据进行阅读框(reads)中接头序列的去除、3'端低质量碱基的修剪及含N比率>10%reads的去除。利用bowtie将修剪后的测序数据比对到基因组上,检测外显子之间的可变剪切信息,并将最终得到的序列与Nr、GO、KEGG数据库进行对比,并对其功能进行注释。
2 结果与分析
2.1 红曲霉转录组测序与转录分析
对原始数据进行统计分析,结果见表1。由表1可知,从样品MP1中得到的阅读框(reads)总数和碱基总数分别为62 127 568条和9 381 262 768 bp;从样品MP2中得到的reads总数和碱基总数分别为52 725 002条和7 961 475 302 bp。对原始数据进行质量修剪后,样品MP1得到的Clean reads和Clean碱基总数分别为61 233 790条和9 145 916 108 bp;样品MP2得到的Clean reads 和Clean 碱基总数分别为51 890 476条和7 746 137 365 bp。样品MP1和MP2的鸟嘌呤(guanine,G)胞嘧啶(cytosine,C)含量分别为53.29%、53.10%,Q20碱基比例分别为98.59%、98.53%,Q30碱基比例分别为95.78%、95.64%。通过与参考基因组对比后,样品MP1和MP2得到的Uniquely mapped总数分别为45 194 295、35 139 204,占比分别为73.81%、67.72%。结果表明,该转录组样本测序质量较高,可进行下一步样品中差异基因的分析。

表1 转录组测序结果统计Table 1 Statistics of transcriptome sequencing analysis results
2.2 红曲霉样本间差异基因的分析
使用edgeR软件,根据gene read count数据进行差异表达计算,按照错误发现率(false discoveryrate,FDR)<0.05且差异倍数(fold change,FC)对数值的绝对值(|log2FC|)≥1为标准,对样品差异基因进行筛选,结果见图1。
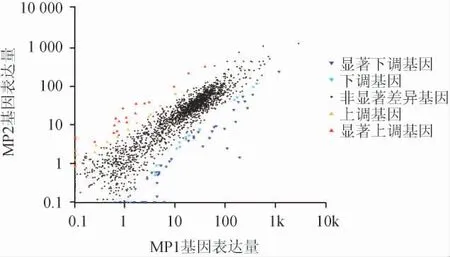
图1 红曲霉样本间差异表达基因散点图Fig.1 Scatter plot of differentially expressed genes between Monascus samples
由图1可知,样本MP1与MP2中共存在2 117个基因,其中存在显著差异基因有95个,37个基因属于显著上调,58个基因属于显著下调。
2.3 红曲霉样本间差异表达基因的GO功能富集分析
使用Goatools软件对红曲霉样品间差异表达的基因进行GO功能显著性富集,利用GO数据库,以P≤0.05为筛选标准,按照基因参与的生物学过程(biological process,BP)、构成细胞组分(cellular component,CC)、实现的分子功能(molecular function,MF)等将MP1、MP2样品存在的差异表达基因进行比对分析,结果见图2。由图2可知,在样本MP1和MP2中,差异基因参与了生物学过程、细胞组分和分子功能。将95个差异基因分别映射到46个代谢通路中,在分子功能中,主要富集通路为铁离子连接(iron ion binding)和单氧化酶活性(monooxygenase activity),均有5个差异基因参与,均占差异表达基因总数的5.26%。其次是氧化还原酶活性(oxidoreductase activity)、血红素结合(heme binding)等。在细胞组分中,主要富集通路为葡萄糖苷酶II复合物(glucosidase II complex)、细胞表面(cell surface),参与的差异表达基因数均为1个,均占总差异表达基因总数的1%。在生物学过程中,主要富集通路为葡萄糖代谢过程(sucrose metabolic process)、淀粉代谢过程(starch metabolic process)、细胞碳水化合物代谢过程(cellular carbohydrate metabolic process),参与差异表达的基因数分别有3个、3个、4个,占总差异表达基因总数的3.16%、3.16%、4.21%。
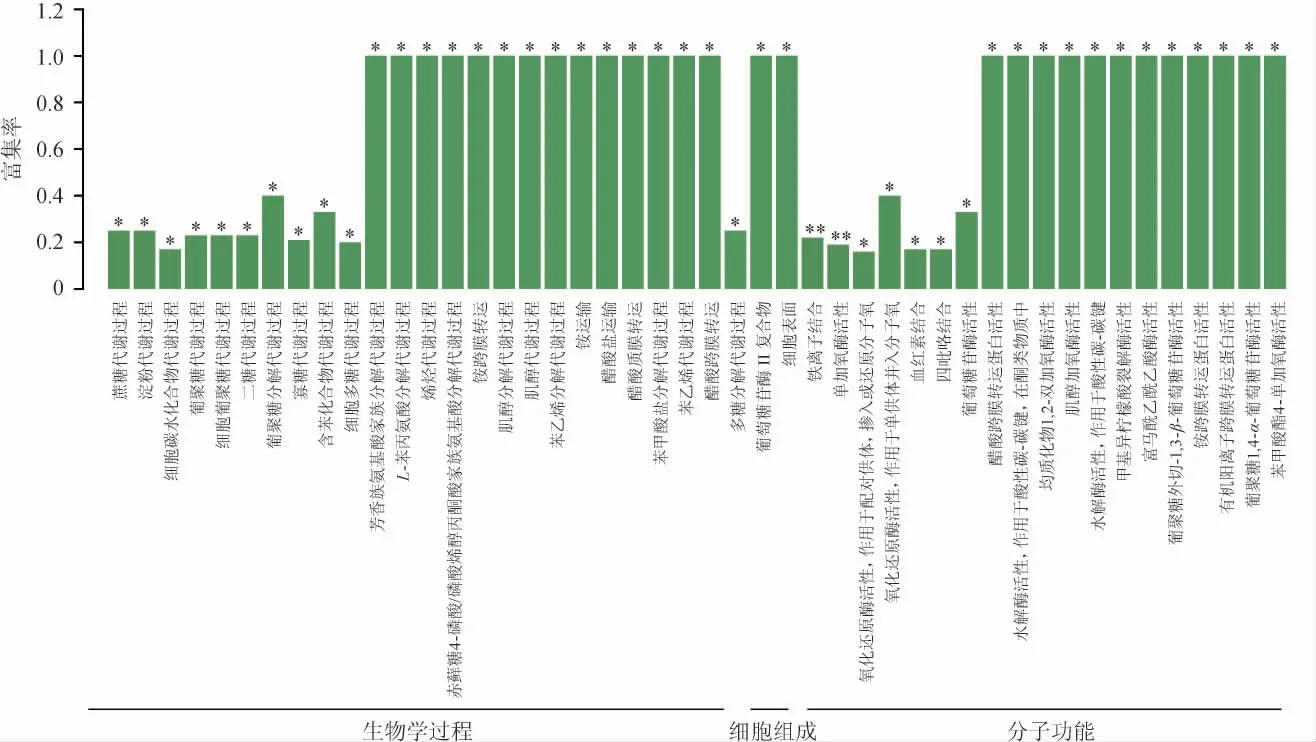
图2 红曲霉样本间差异表达基因的GO功能富集结果Fig.2 GO functional enrichment results of differentially expressed genes between Monascus samples
2.4 红曲霉样本间差异表达基因的KEGG通路富集分析
以P≤0.05作为筛选差异基因在KEGG通路显著富集的标准,使用软件KOBAS对红曲霉样本间差异基因进行KEGG通路富集分析,结果见图3。由图3可知,在样品MP1和MP2中,95个差异基因中有11个基因注释到KEGG 17条通路中。包括磷酸肌醇代谢(inositol phosphate metabolism)、氨基苯基酸酯降解(aminobenzoate degradation)、淀粉和蔗糖代谢(starch and sucrose metabolism)、氯代环己烷和氯苯降解(chlorocyclohexane and chlorobenzene degradation)、紧密连接(tight junction)、缬氨酸、亮氨酸和异亮氨酸生物合成(valine,leucine and isoleucine biosynthesis)、酪氨酸代谢(tyrosine metabolism)等。在以上差异表达基因富集通路中,磷酸肌醇代谢(inositol phosphate metabolism)、淀粉和蔗糖代谢(starch and sucrose metabolism)、苯乙烯降解(styrenedegradation)以及氨基苯基酸酯降解(aminobenzoate degradation)差异基因参与数目最多,均为2个,可推测以上4条通路在红曲霉菌丝生长和色素产生方面存在重要作用。
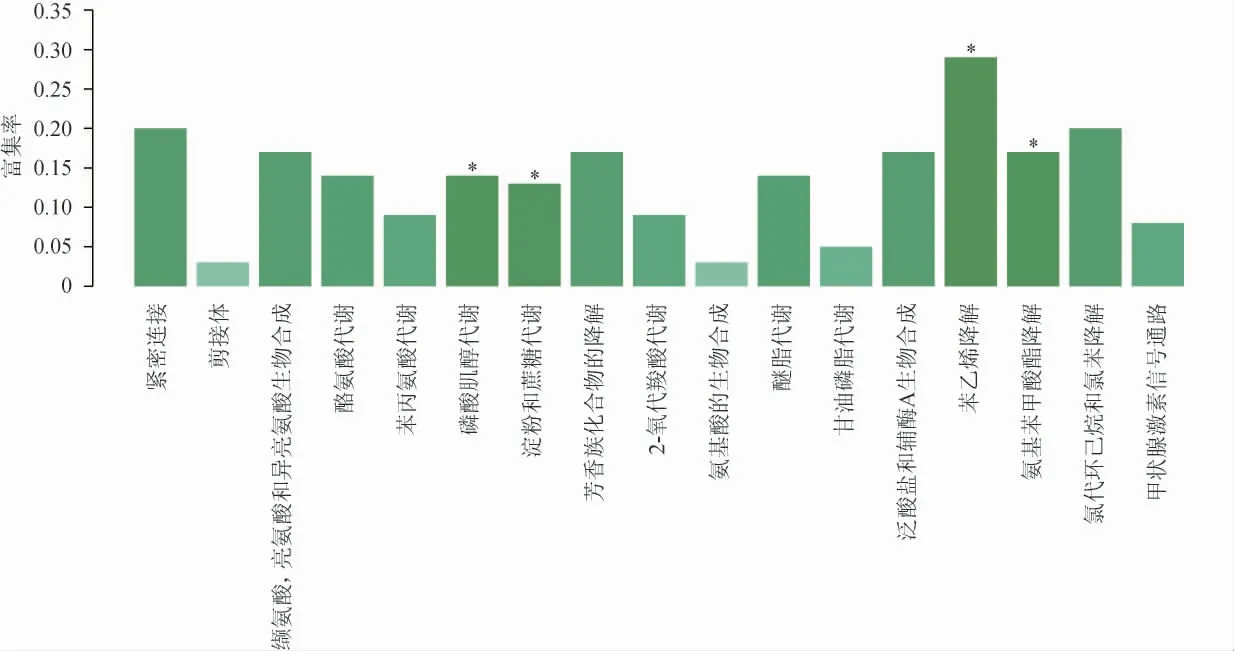
图3 红曲霉样本间差异表达基因的KEGG通路富集分析结果Fig.3 KEGG pathway enrichment analysis results of differentially expressed genes between Monascus samples
3 结论
以铵态氮、亚硝态氮为氮源培养安卡红曲霉(Monascus anka)菌株GZUM-25,采用Illumina二代测序平台对红曲霉GZUM-25进行转录组测序分析发现,铵态氮和亚硝态氮培养下的安卡红曲霉GZUM-25基因组中有95个差异表达基因,其中,上调基因有37个,下调基因有58个。通过GO功能富集及KEGG通路富集分析发现,差异基因主要富集的功能为生物学过程、细胞组分和分子功能,富集的通路为磷酸肌醇代谢、淀粉和蔗糖代谢、苯乙烯降解、氨基苯基酸酯降解。本研究为红曲霉相关功能基因的挖掘提供了理论支持。

