雄黄抑制食管癌细胞增殖、侵袭并诱导细胞铁死亡
陈发章,王 君,徐海珍,郭占芳,杨如意
(青海大学1.医学院、2附属医院中西医结合科,青海 西宁 810001)
食管癌(esophageal cancer,EC)是消化系统恶性肿瘤之一,全世界每年约有57万新发病例及50万死亡病例[1]。EC的发病具有明显的地域性,统计显示,欧洲、美洲和大洋洲的EC发病率相对较低,而非洲和亚洲的EC发病率较高,中国EC发病率是全球最高的国家之一,也存在明显的地域差异,多发于农村、山区等贫困地区[2]。尽管食道切除、放射治疗、化疗和分子靶向药物等治疗方法取得了巨大进展,但其5年生存率仍不到20%[3]。因此,寻找新的治疗药物势在必行。
雄黄(realgar,REA)分子式为As2S2或As4S4,是一种含有砷化合物的中药,其在中医中被广泛应用已有多年的历史[4]。研究表明,REA具有镇痛、消炎、提高免疫力等作用,且对多种血液系统肿瘤、胃癌、宫颈癌、乳腺癌、子宫内膜癌、卵巢癌等具有抑制肿瘤生长,促进凋亡的作用[5]。最新研究证实,雄黄纳米颗粒通过抑制基质金属蛋白酶MMP-2、9表达和血管生成,在小鼠乳腺癌移植瘤中抑制肿瘤细胞的迁移、侵袭[6]。这些研究证明,REA是一种潜在的抗肿瘤药物,对肿瘤细胞增殖、迁移和侵袭具有抑制效果。然而,REA对EC的干预效果尚未完全清晰。
研究表明,在一些癌细胞中存在一种铁依赖的细胞死亡形式,称为铁死亡,与细胞坏死和凋亡不同,铁死亡是亚铁与脂质过氧化反应引起的,抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的防御蛋白可能选择性地激活铁死亡[7]。GPX4通过减少磷脂过氧化氢抑制脂质过氧化,在抑制铁死亡方面发挥重要作用,此外,GPX4对于肿瘤复发也是必需的[8]。当发生铁死亡时,线粒体减少,伴随着双层膜密度的增加和结构完整性的丧失,线粒体跨膜电位降低,氧化磷酸化降低[9]。为临床利用铁死亡方式治疗肿瘤提供了理论依据。然而,铁死亡在恶性肿瘤治疗中的有效程度还远未可知。因此,本研究拟通过体外实验研究雄黄对EC铁死亡的影响,为其应用于临床治疗EC提供理论依据和研究基础。
1 材料与方法
1.1 细胞株人食管癌细胞系Eca109、KYSE150细胞购于武汉普诺赛生命科技有限公司。
1.2 主要试剂及仪器雄黄干粉(编号SA4101)购自湖北诺纳科技有限公司;CCK-8试剂盒(批号BS350A)购自上海Biosharp公司;结晶紫(批号C8470)购自北京索莱宝科技有限公司;基底胶(Matrigel,批号356234)购自美国Corning;丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GPXS)酶联免疫吸附测定(ELISA)试剂盒(批号分别为ZC-32524、ZC-32619、ZC-33229、ZC-33141)购自上海茁彩生物科技有限公司;GPX4兔克隆抗体、E-cadherin兔克隆抗体、Slug兔克隆抗体、N-cadherin兔克隆抗体、β-actin兔克隆抗体(批号分别为A13309、A3044、A1057、A19083、AC026)购自武汉abclonal;生物素化山羊抗兔IgG(批号ab6721)购自英国abcam;BCA蛋白浓度测定试剂盒(批号P0009)购自上海碧云天生物技术有限公司;ECL发光试剂盒(批号KF001)购自美国Affinity;酯酸双氧铀、枸檬酸铅(批号分别为GS02624、GZ02616)购自北京中镜科仪技术有限公司;普鲁士蓝染色试剂盒(批号M021)购自上海歌凡生物科技有限公司;DMI1型倒置生物显微镜(德国LEICA公司);spectra max PLUS 384型酶标仪(美国Molecular Devices公司);JY200C型电泳仪(北京君意东方电泳设备有限公司);TE22型蛋白质转膜仪(美国Hoefer公司);Panthera型数码三目摄像显微镜(麦克奥迪实业集团有限公司);JEM-1400FLASH型透射电子显微镜(日本JEOL公司)。
1.3 药品制备磷酸盐缓冲生理盐水溶解雄黄干粉,磁力搅拌器搅拌使其充分溶解12 h,后经0.2 μm过滤器过滤混悬液,4 ℃储存备用,部分样本送往兰州大学化学实验室测定溶液中砷的浓度,经ICP发射光谱法测定得知溶液中砷的浓度为5.498 mg·L-1。
1.4 细胞培养将细胞株Eca109、KYSE150在RPMI 1640培养基(含10%胎牛血清)中培养,细胞培养条件为5% CO2、37 ℃,以1 ∶5-1 ∶20的比例传代,每隔3~5 d传代1次。
1.5 CCK-8法检测细胞增殖按100 μL·孔-1将Eca109、KYSE150细胞接种于96孔板中,并于每孔中加入不同浓度的雄黄(0、10、20、40、60、80、100 μmol·L-1)培养24、48、72 h,加入CCK8试剂(10 μL·孔-1)37 ℃孵育2 h,用酶标仪在450 nm下测量各孔的吸光度(A)。细胞抑制率/%=[1-实验组A/对照组A]×100%。
1.6 克隆形成实验检测克隆形成能力按150个·孔-1将对数生长期Eca109、KYSE150细胞接种于6孔板中,每3 d更换1次培养液。置于37 ℃、5% CO2中培养24 h,加入不同浓度的雄黄(0、10、20、40、60、80、100 μmol·L-1)培养,4%多聚甲醛固定,0.1%结晶紫染色,结果按平板平均菌落数计算,设置3个重复。
1.7 划痕实验检测细胞迁移能力按4×103个/孔将ECA109或KYSE150细胞接种于96孔培养板中,分别设置空白组、1/2IC50组、IC50组、2IC50组,放置在37 ℃、5% CO2培养箱中过夜,无菌枪头进行划痕,在0和24 h拍摄划痕区域的图像,每组设置3个重复。
1.8 Transwell小室实验检测细胞侵袭ECA109或KYSE150细胞分别设置空白组、1/2IC50组、IC50组、2IC50组。将稀释(1 ∶5)的基质胶加入Transwell上室中,200 μL细胞悬浮液添加到上室,500 μL含有20% FBS的培养基添加到下室。药物作用后,将小室置于37 ℃、5% CO2下培养 24 h,4%多聚甲醛固定,0.1%结晶紫染色,每孔选取5个视野在光学显微镜下拍照,统计各组迁移细胞数目。
1.9 免疫荧光染色检测细胞GPX4、E-cadherin、Slug、N-cadherin表达对数生长期Eca109、KYSE150细胞以5×104个/孔接种于24孔板,分别设置空白组、1/2IC50组、IC50组、2IC50组,处理24 h,用4%多聚甲醛固定,然后用0.3%的Triton×100对细胞膜进行渗透。用10%牛血清液封闭细胞后,用以下一抗在4 ℃下孵育过夜:抗GPX4、抗E-cadherin、抗Slug、抗N-cadherin。然后将细胞与合适的FITC或TRITC偶联的二抗(KLP)在室温下孵育1 h,未结合的抗体被洗掉,细胞用含有DAPI的固定介质固定于玻片上,倒置荧光显微镜拍照,采用Image-Pro Plus 6.0图像分析系统测定GPX4、E-cadherin、Slug、N-cadherin表达水平。
1.10 Western blot检测细胞E-cadherin、Slug、N-cadherin蛋白表达对数生长期Eca109、KYSE150细胞接种于细胞培养瓶中,分别设置空白组、1/2IC50组、IC50组、2IC50组,处理24 h。细胞用预冷的PBS洗涤两次,后在4 ℃下3 000 r·min-1离心5 min,用全细胞裂解缓冲液在冰上裂解半小时,然后将裂解液在4 ℃下3 500 r·min-1离心20 min,收集上清液,BCA法检测蛋白浓度,用10% SDS-PAGE分离蛋白质样品,并将其电泳转移到聚偏氟乙烯膜,用5%脱脂牛奶室温封闭2 h。然后将膜与下列一级抗体在4 ℃下孵育过夜:抗E-cadherin(1 ∶1 000)、抗Slug(1 ∶2 000)、抗N-cadherin(1 ∶2 000)、抗β-actin(1 ∶10 000)。然后加入生物素化山羊抗兔IgG,室温下孵育1.5 h,洗涤,ECL显影。采用Image Pro Plus软件分析各蛋白条带的灰度值,计算蛋白相对表达量。
1.11 ELISA检测细胞内MDA、SOD、GSH、GPXS活性取对数生长期Eca109、KYSE150细胞,设置分组为空白组、1/2IC50组、IC50组、2IC50组,培养24 h后收集细胞,采用ELISA试剂盒按说明书测定细胞MDA、SOD、GSH、GPXS活性。
1.12 透射电镜检测线粒体超微结构ECA109或KYSE150细胞分别设置空白组、1/2IC50组、IC50组、2IC50组,培养24 h,细胞经固定、包埋、染色后,用透射电镜拍摄线粒体形态。
1.13 普鲁士蓝染色观察细胞内铁颗粒分布取对数生长期Eca109、KYSE150细胞,设置分组为空白组、1/2IC50组、IC50组、2IC50组,培养24 h后收集细胞,4%多聚甲醛固定,Perl试剂孵育,1%核坚固红复染3 min,PBS洗去多余核坚固红后,应用数码三目摄像显微镜采集图像,采用Image-Pro Plus 6.0图像分析系统测定所采集图像的光密度(IOD)和面积(Area),计算阳性表达面积百分率。
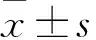
2 结果
2.1 雄黄对食管癌细胞增殖的影响CCK-8检测结果显示,随着雄黄浓度的增加,Eca109、KYSE150细胞增殖减慢,在雄黄浓度相同条件下,随着时间延长,Eca109、KYSE150细胞抑制率越高(P<0.05),雄黄作用Eca109、KYSE150细胞的IC50分别为63.683 μmol·L-1、50.344 μmol·L-1。克隆形成实验结果显示,Eca109、KYSE150细胞增殖依赖雄黄浓度增高而呈现降低趋势(P<0.01),见Fig 1。
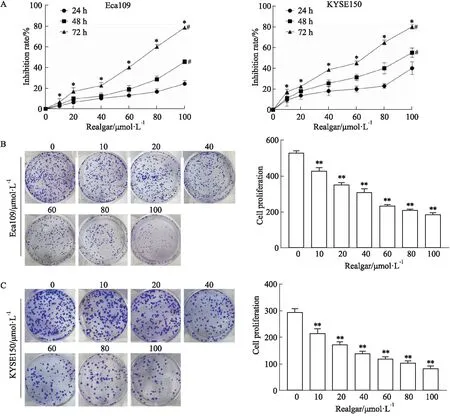
Fig 1 Effect of realgar on proliferation of esophageal carcinoma cells
2.2 雄黄对食管癌细胞迁移、侵袭的影响划痕实验结果显示,与空白组相比,雄黄1/2 IC50组、IC50组、2 IC50组明显减慢了Eca109、KYSE150细胞平面迁移的能力,24 h时空白组Eca109、KYSE150细胞几乎完全融合,而1/2 IC50组、IC50组、2 IC50组Eca109、KYSE150细胞迁移数明显减少(P<0.01)。Transwell小室实验结果显示,与空白组相比,雄黄1/2 IC50组、IC50组、2 IC50组明显降低细胞侵袭数(P<0.01),见Fig 2。
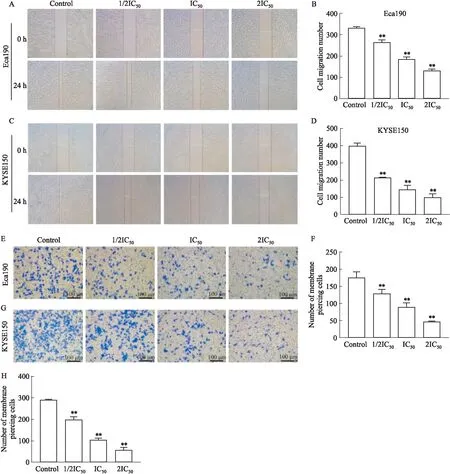
Fig 2 Effect of realgar on migration and invasion of esophageal carcinoma cells
2.3 雄黄对食管癌细胞上皮间质转化(EMT)的影响免疫荧光染色结果显示,与空白组相比,雄黄1/2IC50组、IC50组、2IC50组Eca109细胞N-cadherin、Slug表达明显降低,E-cadherin表达明显升高(P<0.01);雄黄2IC50组KYSE150细胞N-cadherin、Slug蛋白表达明显降低,E-cadherin蛋白表达明显升高(P<0.05,Fig 3D、E、F、H)。Western blot检测结果显示,与空白组相比,雄黄1/2 IC50组、IC50组、2 IC50组Eca109、KYSE150细胞N-cadherin、Slug蛋白相对表达量明显降低,E-cadherin蛋白相对表达量明显升高(P<0.05),见Fig 3。
Fig 3 Effect of realgar on epithelial mesenchymal transformation of esophageal carcinoma cells
2.4 雄黄对食管癌细胞铁死亡的诱导作用透射电镜观察结果显示,与空白组相比,雄黄1/2 IC50组Eca109、KYSE150细胞质内发生自噬,雄黄IC50组Eca109、KYSE150细胞质内少量线粒体发生肿胀、自噬,雄黄2 IC50组Eca109、KYSE150细胞胞质内大量线粒体发生肿胀、自噬,粗面内质网扩张,线粒体嵴变短变少甚至消失。普鲁士蓝染色结果显示,空白组无蓝染颗粒,雄黄1/2 IC50组、IC50组、2 IC50组Eca109、KYSE150细胞均能发现大小各异、多少不等的蓝染颗粒,与空白组相比,雄黄IC50组、2 IC50组Eca109、KYSE150细胞铁阳性表达面积百分率均明显升高(P<0.05)。免疫荧光染色结果显示,与空白组相比,雄黄1/2 IC50组、IC50组、2 IC50组GPX4荧光强度逐渐减弱,且雄黄2 IC50组Eca109、KYSE150细胞GPX4表达明显降低(P<0.01)。ELISA检测结果显示,与空白组相比,雄黄1/2 IC50组、IC50组、2 IC50组Eca109、KYSE150细胞MDA含量明显降低,SOD、GSH、GPXS活性明显升高(P<0.05),见Fig 4。
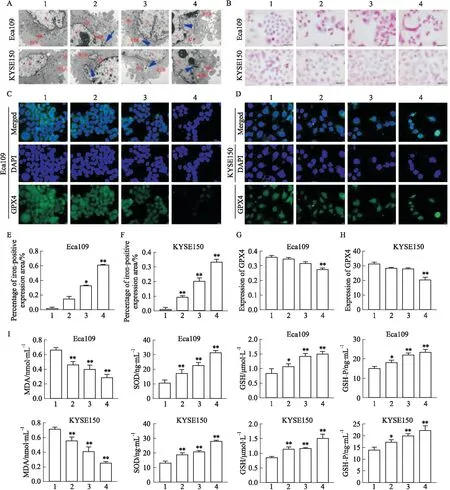
Fig 4 Induction of ferroptosis in esophageal carcinoma cells by realgar
3 讨论
目前,EC在治疗上仍是一个难题。中医认为“邪气进入”是EC发展和进展的主要原因,建议采用“毒邪”的治疗方法[10]。《神农本草经》记载雄黄味苦,平,寒,主寒热,鼠瘘,恶疮,疽痔,死肌,恶鬼,邪气,百虫,肿毒[5]。研究表明纳米雄黄能显著抑制乳腺癌细胞体外迁移、侵袭及体内肺、肝转移[6]。此外,雄黄通过阻断肿瘤细胞黏附,降低肿瘤细胞破坏基底膜的能力,从而抑制胃癌细胞的迁移和侵袭[11]。在本研究中,我们发现Eca109、KYSE150细胞增殖依赖雄黄浓度增高而呈现降低趋势,其作用Eca109、KYSE150细胞的IC50分别为63.683、50.344 μmol·L-1,因此,本研究中使用1/2 IC50、IC50、2 IC50作为雄黄处理浓度。研究已表明细胞上皮间质转化(EMT)是肿瘤转移的关键过程,E-cadherin抑制EMT,Slug促进EMT诱导的细胞迁移,N-cadherin在食管鳞癌组织中高表达,也与肿瘤转移有关[12]。在本研究中,雄黄2 IC50作用增强了食管癌细胞E-cadherin的表达,降低了细胞N-cadherin、Slug表达,且划痕实验和Transwell小室实验也表明雄黄作用明显降低了细胞迁移数和细胞侵袭数。表明雄黄具有抑制EC细胞增殖、迁移和侵袭的作用。
细胞死亡是细胞生命过程的终结,该过程对机体的生存和发展意义重大,诱导肿瘤细胞死亡是癌症治疗的主要策略,铁死亡是一种铁依赖性脂质氧化应激引起的非凋亡细胞死亡[13]。铁死亡的激活可以抑制肿瘤细胞增殖,细胞内铁水平和脂质过氧化是铁死亡的基本特征[14]。GPX4作为一种磷脂-过氧化氢谷胱甘肽过氧化物酶,可以抑制肿瘤细胞的铁死亡,GPX4在肝细胞癌和结肠癌中高表达,且GPX4高表达是弥漫性大B细胞淋巴瘤和肺腺癌的不良预后因素[8,15]。此外,Zhang等[16]研究表明,冬凌草甲素给药后食管癌TE1细胞中GPX4活性降低,且与冬凌草甲素作用后细胞内Fe2+、脂质过氧化产物、丙二醛(MDA)、细胞内活性氧(ROS)积聚相一致。Shishido等[17]也报道了类似的机制,他们证明GPX4上调是食管鳞状细胞癌的不良预后因素,5-氨基乙酰丙酸抑制GPX4在肿瘤组织中的过度表达可导致肿瘤体积缩小。本研究结果显示,雄黄2IC50可导致食管癌细胞GPX4明显下调,并降低细胞MDA含量,升高SOD、GSH、GPXS含量,雄黄作用后,Eca109、KYSE150细胞胞质内少量线粒体发生肿胀、自噬及发现大小各异、多少不等的蓝染颗粒。表明雄黄作用后Eca109、KYSE150细胞发生铁死亡,可能是一种有前途的治疗药物。此外,有报道[18]称通过激活血红素加氧酶1(HMOX1)和抑制GPX4双重机制可诱导高危神经母细胞瘤中的铁死亡。因此,雄黄作用EC细胞铁死亡的具体机制还有待进一步研究。
综上所述,雄黄可呈现剂量及时间依赖性地抑制Eca109、KYSE150细胞增殖,并抑制细胞迁移和侵袭,诱导细胞铁死亡,可能是治疗食管癌潜在药物。此外,从铁死亡方面入手深入抗癌药物的研发可能是未来进一步的研究方向。

