环状RNA在肝癌耐药中的作用及机制研究进展
黄国林,蓝晓步,秦艳娥,黎 骊,阳 洁
(1. 广西医科大学第五附属医院,南宁市第一人民医院药学部,广西 南宁 530022;2.广西中医药研究院,广西 南宁 530022;3. 广西医科大学药学院,广西 南宁 530021)
1 肝癌简介
肝癌是临床上最常见的恶性肿瘤之一,约75%~85%为肝细胞癌(hepatocellular carcinoma,HCC)[1]。2020年全球肝癌新发病例90.57万例,死亡病例83.02万例,在恶性肿瘤发生率和肿瘤致死率中分别位居第六位和第三位[1]。我国是肝癌发病率和死亡率最高的国家之一,在全球每年新增和死亡的HCC患者中有50%以上发生在我国,在我国常见恶性肿瘤发生率和肿瘤致死率中分别位居第五位和第二位[1]。乙型或丙型肝炎病毒感染、长期酗酒、非酒精脂肪性肝炎、食用黄曲霉毒素污染的食物、血吸虫病等多种因素引起的肝硬化以及有肝癌家族史的人群是肝癌的高危人群。目前,HCC治疗方法包括肝切除术、肝移植术、局部消融、经动脉化疗栓塞(TACE)、放射治疗、化疗、靶向治疗以及免疫治疗等,中医中药治疗、生物治疗也有应用。其中,手术切除是治疗早期肝癌的首选办法,也是最有效的方法。HCC起病隐匿、进展迅速,多数患者确诊时已达局部晚期或发生远处转移,难以手术且对传统的放化疗高度耐受,平均5年生存率低于10%[2]。目前,中晚期肝癌的主要治疗方法包括化疗、靶向治疗以及免疫治疗,但长期用药后往往都会产生耐药,耐药已经成为肝癌治疗亟待解决的大问题。因此,研究肝癌耐药产生的分子机制至关重要,近3年来,已有较多研究发现环状RNA(circRNAs)的异常表达与肝癌耐药密切相关(Tab 1)。
2 CircRNAs简介
CircRNAs是一类不具有5′末端帽子和3′末端poly(A)尾巴,并以共价键形成环形结构的新型非编码RNA。根据其形成机制不同,circRNAs分为以下4类:外显子circRNAs ( exonic circRNAs )、内含子circRNAs ( ciRNAs )、外显子-内含子circRNAs ( ElciRNAs)和tRNA内含子circRNAs ( TricRNA )[3]。CircRNAs一开始被认为是错误剪接的副产物或剪接中间体。然而,随着RNA测序技术的发展和生物信息学软件的改进,在各种生物体中发现了越来越多不同的circRNAs,其形成机理和生物学功能逐渐显现出来。越来越多的证据表明,circRNAs在多种肿瘤耐药中发挥重要作用,包括肝癌[4]、肺癌[5]、乳腺癌[6]等。CircRNAs的作用方式主要包括[7]:(1)吸附miRNA,circRNAs通过吸附miRNA,阻断miRNA和其靶基因相互结合,因而在转录调控中产生重要的影响;(2)与蛋白结合,circRNAs可作为蛋白质海绵,起到抑制蛋白质功能的作用;(3)编码多肽,有些细胞质中的circRNAs可以翻译多肽,具有翻译功能的circRNAs分子具有内部核糖体进入位点元件或原核核糖体结合位点;(4)影响宿主基因的转录调控,定位于细胞核中的 circRNAs可能具有调控其宿主基因转录的功能。
3 CircRNAs与肝癌的关系
CircRNsAs在肝癌的诊断、治疗、进展、预后和耐药中发挥着重要作用。Wu等[8]研究发现,与慢性肝炎或健康对照组人群样本相比,HBV相关HCC患者样本中的circ_0009582,circ_0037120和circ_0140117表达显著增加,3种circRNAs和AFP的组合可用于预测HCC伴HBV感染的发生。Chen等[9]发现,circ_0003418在HCC组织和细胞系中的表达水平下调,并且与HCC患者的肿瘤大小,TNM分期及HBsAg水平相关,敲低circ_0003418表达则促进HCC细胞的增殖,迁移和侵袭。Zhou等[10]发现,CircRNA_101237在HCC患者的肿瘤组织和血清中的表达分别高于癌旁组织和健康对照组的血清,并且与肿瘤大小、淋巴结转移、远处转移和TNM分期密切相关,血清circRNA_101237水平是肝细胞癌患者生存预后的独立预测指标。Xu等[11]研究发现,circRNA-SORE在索拉非尼耐药的HCC细胞中上调,敲低circRNA-SORE后大大增加了索拉非尼的细胞杀伤能力。Huang等[12]研究发现,circUBE2D2在HCC组织和细胞中上调,与HCC患者的预后不良呈正相关,circUBE2D2过表达致使HCC细胞索拉非尼耐药,而敲低circUBE2D2则增加HCC细胞索拉非尼敏感性。
4 CircRNAs在肝癌耐药中的作用及机制研究进展
4.1 CircRNAs在肝癌化疗耐药中的作用及机制的研究进展TACE治疗及化疗是肝癌的重要治疗手段。TACE常用的化疗药物有蒽环类(如多柔比星、表柔比星、伊达比星)、铂类、5-氟尿嘧啶、雷替曲塞等[13]。另外,以奥沙利铂为主的系统化疗被中国临床肿瘤学会(CSCO)推荐为晚期HCC的一线治疗方案。肝癌患者前期化疗可能效果良好,但长期化疗往往出现耐药。近年来,多项研究表明,circRNAs在肝癌化疗耐药中扮演重要角色。
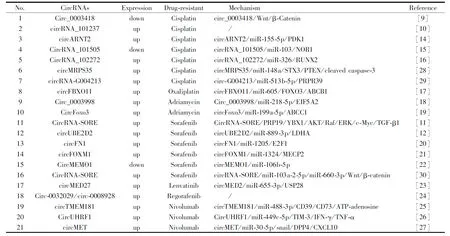
Tab 1 CircRNAs in therapeutic resistance of liver cancer
4.1.1CircRNAs在肝癌顺铂耐药中的作用及机制的研究进展 为了研究circRNAs在HCC顺铂耐药中的作用,Li等[14]通过circRNAs微阵列分析了5对顺铂耐药和顺铂敏感的HCC组织,共检测到了9 857个circRNAs,其中968个circRNAs的表达存在显著异常;与顺铂敏感的HCC组织相比,顺铂耐药HCC组织中有538个circRNAs显著上调,430个circRNAs显著下调;之后该团队选择上调最显著的5个和下调最显著5个circRNAs进行继续研究,发现circARNT2的上调与HCC顺铂耐药密切相关,其机制是circARNT2可作为miR-155-5p的海绵,在细胞内通过吸附miR-155-5p进而上调PDK1表达,抑制HCC细胞自噬,从而促使HCC细胞对顺铂产生耐药。同样的,Luo等[15]也通过circRNAs微阵列分析了4对顺铂耐药和顺铂敏感HCC组织,发现circRNA_101505在顺铂耐药HCC组织表达显著下调,机制可能与circRNA_101505通过靶向miR-103下调NOR1,进而使HCC细胞对顺铂耐药有关。Guan等[16]发现,敲低HCC细胞中的circRNA_102272降低了HCC细胞顺铂IC50,提示circRNA_102272与HCC细胞耐药密切相关;进一步的机制研究表明,circRNA_102272通过吸附miR-326,解除miR-326对RUNX2的抑制,从而使RUNX2表达上调,最终使HCC细胞对顺铂耐药。
4.1.2CircRNAs在肝癌奥沙利铂耐药中的作用及机制的研究进展 Li等[17]采用circRNAs微阵列对3对HCC患者的癌组织和癌旁组织进行分析发现,与正常组织相比,circFBXO11在HCC组织中的表达明显上调,且与预后不良有关;体外实验也表明,circFBXO11在HCC细胞的表达显著高于正常细胞,在奥沙利铂耐药HCC细胞(HepG2/OXA)的表达显著高于其亲本细胞HepG2;进一步的机制研究发现,circFBXO11可以通过吸附miR-605促进FOXO3表达,FOXO3可进一步上调ABCB1,从而促使HCC细胞对奥沙利铂耐药。
4.1.3CircRNAs在肝癌多柔比星耐药中的作用及机制的研究进展 Li等[18]为了探索circ_0003998对HCC多柔比星耐药的影响,对55例配对HCC癌组织和癌旁组织进行了研究,结果发现circ_0003998在HCC癌组织显著上调,特别是在多柔比星耐药HCC组织中上调更显著。深入研究后发现,Circ_0003998可以通过吸附miR-218-5p上调EIF5A2促使HCC细胞对多柔比星耐药。另外,Huang等[19]通过研究25例HCC癌组织发现,circFOXO3在多柔比星耐药HCC组织中表达显著高于多柔比星敏感HCC组织,体外实验证明circFOXO3可通过调控miR-199a-5p上调ABCC1来诱导HCC多柔比星耐药。
4.2 CircRNAs在肝癌靶向治疗耐药中的作用及机制的研究进展目前用于治疗肝癌的小分子靶向药物有索拉非尼、仑伐替尼、多纳非尼、瑞戈非尼、阿帕替尼、卡博替尼,其中索拉非尼、仑伐替尼、多纳非尼为晚期HCC一线治疗药物,瑞戈非尼、阿帕替尼、卡博替尼为晚期HCC二线治疗药物。肝癌靶向治疗同样面临耐药的问题,且耐药具体机制尚不明确。
4.2.1CircRNAs在肝癌索拉非尼耐药中的作用及机制的研究进展 Yang等[20]通过circRNAs微阵列分析5对索拉非尼敏感的HepG2细胞和索拉非尼耐药的SR-HepG2细胞中circRNAs的表达,鉴定出748个差异表达的circRNAs;随后敲低索拉非尼耐药HCC细胞circFN1的表达,发现敲低后其对索拉非尼的敏感性显著增加,机制研究揭示其与circFN1通过内源性海绵样作用吸附miR-1205促进E2F1表达,进而促使HCC对索拉非尼耐药有关。Weng等[21]通过比较索拉非尼耐药细胞和敏感细胞之间的circRNAs谱,鉴定出4个异常表达的circRNAs,其中敲低circFOXM1逆转了索拉非尼耐药细胞SR-HepG2和SR-Huh7的耐药性,其机制与circFOXM1吸附miR-1324上调MECP2表达有关。Dong等[22]发现,circMEMO1在HCC样本中显著下调,并且与患者的总生存期和无病生存期密切相关;敲低HCC细胞circMEMO1可减弱索拉非尼对其的生长抑制作用,而过表达circMEMO1可增强索拉非尼诱导的生长抑制;circMEMO1及其下游靶标miR-106b-5p可调节HCC细胞对索拉非尼治疗的敏感性。
4.2.2CircRNAs在肝癌仑伐替尼耐药中的作用及机制的研究进展 仑伐替尼是一种多靶点酪氨酸激酶抑制剂,通过抑制成纤维细胞生长因子受体1-4、血管内皮生长因子受体1-3、血小板衍生生长因子受体α、RET和KIT而起抗肿瘤活性。然而,原发性和获得性仑伐替尼耐药严重限制了其治疗疗效。Zhang等[23]研究发现,circMED27在HCC血清和组织中上调,并且与患者预后不良呈正相关,circMED27高表达组HCC患者的无进展生存时间明显低于circMED27低表达组;此外敲低HCC细胞circMED27可显著提高其对乐伐替尼的敏度性,circMED27能够作为ceRNA海绵吸附miR-655-3p上调泛素特异性肽酶28(USP28)的表达,从而增强HCC细胞对仑伐替尼的耐药性。
4.2.3CircRNAs在肝癌瑞戈非尼耐药中的作用及机制的研究进展 瑞戈非尼也是一种多靶点TKI,可以显着提高HCC患者的总体生存率,但也不可避免的产生耐药。Wang等[24]研究发现,与单独使用瑞戈非尼治疗相比,小檗碱和瑞戈非尼联合治疗对裸鼠HCC异种移植肿瘤的生长有更显著的抑制作用;在体外实验中,相比对照组HCC细胞(经DMSO处理),小檗碱和瑞戈非尼联合处理的HCC细胞有58个circRNAs显著上调、19个circRNAs显著下调。然而,这些差异表达circRNAs是否与小檗碱提高HCC对瑞戈非尼的敏感性有关?能否作为减少瑞戈非尼耐药的候选靶标?有待进一步深入研究。
4.3 CircRNAs在肝癌免疫治疗耐药中的作用及机制的研究进展近年来肿瘤免疫治疗发展迅猛,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)药物已成为包括肝癌等多种肿瘤治疗的重要选择。ICIs包括PD-1抑制剂、PD-L1抑制剂和CTLA-4抑制剂。目前用于肝癌治疗的PD-1/PD-L1抑制剂有纳武利尤单抗、帕博利珠单抗、卡瑞利珠单抗、信迪利单抗、替雷利珠单抗和阿替利珠单抗,CTLA-4抑制剂有伊匹木单抗。尽管免疫治疗取得了巨大的成功,但ICIs的先天性和获得性耐药性导致HCC患者的肿瘤复发和治疗失败成为限制其临床应用的瓶颈问题。目前针对ICIs耐药的研究较少,ICIs耐药机制尚不明确。

Fig 1 CircRNAs regulated mode of drug resistance of liver cancer
Lu等[25]对6名接受PD-1抑制剂(纳武利尤单抗)治疗的晚期HCC患者的穿刺活检肿瘤样本进行circRNAs测序,发现在PD-1耐药的HCC组织中24个circRNAs明显上调、20个circRNAs明显下调;其中circTMEM181的上调与PD-1耐药密切相关,其机制为HCC细胞通过外泌体传递circTMEM181作用于巨噬细胞以增加其CD39表达,CD39与肿瘤细胞上的CD73协调导致肿瘤微环境中的腺苷升高使CD8+T细胞致残,从而引起PD-1免疫治疗的耐药。Zhang等[26]研究发现,circUHRF1在PD-1(纳武利尤单抗)治疗后疾病进展组HCC患者的表达量显著高于疾病稳定组和部分缓解组,并且在人HCC癌组织中的表达高于癌旁组织;circUHRF1高表达预示HCC患者预后较差和NK细胞功能障碍(比例降低、浸润减少);HCC细胞可通过外泌体分泌circUHRF1来抑制NK细胞分泌IFN-γ和TNF-α分泌,并可通过吸附miR-449c-5p上调TIM-3的表达来抑制NK细胞功能,从而介导了HCC对PD-1抑制剂的耐药。Huang等[27]研究发现,circMET在HCC组织高表达,并且与HCC患者的总生存时间负相关;circMET通过吸附miR-30-5p上调snail蛋白,继而上调二肽基肽酶4(dipeptidyl peptidase 4,DPP4),从而诱导趋化因子CXCL10降解,最终使肿瘤微环境中CD8+T细胞侵润减少,产生免疫抑制性肿瘤微环境。在小鼠体内实验中,与单独使用PD-1抑制剂治疗组相比,PD-1抑制剂和DPP4抑制剂(西格列汀)联合治疗对小鼠HCC异种移植肿瘤的生长有更显著的抑制作用,说明由circMET介导的免疫抑制性肿瘤微环境可被DPP4抑制剂修复,DPP4抑制剂可提高PD-1抑制剂杀伤HCC细胞的作用。
5 总结与展望
我国是一个肝癌发病大国,广大肝癌患者都一定程度上从各种药物治中获益,但原发性耐药和获得性耐药严重限制了药物的治疗疗效,耐药问题迫待解决。为此,科学界,特别是我国学者近年来对此做了大量研究,涉及肝癌化疗耐药、肝癌靶向治疗耐药和肝癌免疫治疗耐药的机制研究和治疗方案探索。综上所述,circRNAs在肝癌耐药中扮演了重要角色,其异常表达可导致肝癌耐药的发生。CircRNAs主要是通过ceRNA机制吸附下游miRNAs,进而上调下游靶基因或靶蛋白的表达来参与肝癌耐药。此外,circRNAs还可以通过调控肿瘤微环境中的免疫细胞功能来参与免疫治疗药物的耐药。随着研究的不断深入,circRNAs有望成为克服肝癌耐药的重要靶点。

