菠萝皮渣纤维素纳米晶的制备及其在Pickering乳液中的环境稳定性
黄惠华 唐璐 刘钰姗 廖晶 陈星宇 肖敏萱 尹惠双
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.广东工业大学轻工化工学院,广东 广州 510006)
纳米纤维素作为某一维度为纳米尺度(小于100 nm)的生物基质材料,主要分为纤维素纳米晶(Cellulose Nanocrystals,CNCs)、纤维素纳米纤丝(Cellulose Nanofiber,CNF)及细菌纤维素(Bacterial Cellulose,BC)[1]。其中,CNCs由于具有优异的力学性能、阻隔性能、表面活性、亲水性且无毒,在新型复合材料的应用中发挥了巨大的作用[2]。CNCs的传统制备方法主要是强酸水解[3]。然而,强酸水解制备CNCs能耗大、操作繁琐且安全性不高[4]。近年来,过硫酸铵氧化法、离子液体法、酶解法、球磨法和2,2,6,6-四甲基哌啶氧化物(2,2,6,6-Tetramethyl-1-Piperidinyloxy,TEMPO)氧化法等更高效绿色的制备手段成为了CNCs制备方法方面的研究热点[5-7]。其中,TEMPO作为一种可溶、稳定的催化剂,是目前备受关注的CNCs制备手段。该方法通过纤维素阴离子改性,使次氯酸盐氧化的TEMPO分子或硝基离子渗透到微纤维之中,氧化微纤维表面的C6羟基组,再进一步将氧化产物通过机械处理制备得到CNCs[8]。与此同时,TEMPO作为催化剂能够通过洗涤废水进行回收利用,大大减少了制备成本和环境污染[9]。目前的研究表明,TEMPO/NaBr/NaClO作为TEMPO氧化制备CNCs的主要方法,在材料应用领域具有极大的发展潜力[10-11]。
Pickering乳液作为一种新型乳液材料,以固体颗粒代替传统表面活性剂作为乳化剂应用到乳液的制备当中[12]。相对于传统乳液,固体颗粒在乳化过程中形成了独特的界面屏障包裹油相,使乳液展现出良好的贮藏稳定性、生物相容性以及绿色安全性等,更能够有效抑制奥氏熟化的发生[13]。近年来,黏土、二氧化硅、石墨、纳米纤维素等固体颗粒多被用于Pickering乳液的制备,Pickering乳液在食品、材料、医药、化妆品等领域具有广泛的应用前景[14]。然而,Pickering乳液液滴的相互作用易受外部环境变化的影响,从而影响乳液的稳定性。Zhai等[15]研究了由细菌纤维素纳米颗粒稳定的Pickering乳液的稳定性,发现乳液在pH=7以上时具有良好稳定性和分散性,温度和贮存时间对乳液的稳定性均有影响。也有研究认为,颗粒大小和表面电荷会影响纳米颗粒的屏障厚度,从而影响脂质氧化速率[16]。此外,Kalashnikova等[17]发现,从棉花、细菌和绿藻中提取的纳米纤维素表现出不同的形态及纵横比,使Pickering乳液内部的网络空间结构具有差异性,进一步影响乳液的稳定。因此,不同来源及制备方法的纳米纤维素对Pickering乳液稳定性的研究显得尤为必要。
菠萝作为最受欢迎的热带水果之一,被广泛用于日常消费和深加工中。然而,随着菠萝销量的增大,菠萝皮渣残留量逐年累加,造成了严重的资源浪费和环境污染[18-19]。近年来,菠萝皮渣常被利用于提取纤维素[2]、酚类化合物[20]、蛋白酶[21]及果胶[22]等。其中,纤维素在菠萝皮渣中含量最丰富,占总质量的30%左右,具有制备纳米纤维素的巨大潜能[13]。在现有的研究中,菠萝皮渣纤维素纳米晶(Pineapple Cellulose Nanocrystals,PCNCs)通常以酸解法、过硫酸铵氧化法、酶解法等方法制备[5],通过TEMPO氧化法制备PCNCs并将其用于稳定Pickering乳液的研究较少,且与其他传统技术方法缺乏对照性。
有鉴于此,文中以菠萝皮渣纤维素为主要原料、TEMPO/NaBr/NaClO为催化体系制备TEMPO氧化菠萝皮渣纤维素纳米晶(Pineapple Peel TEMPO Oxidized Cellulose Nanocrystals,PTNc),对比传统酸解法,在表征的基础上进一步探讨PTNc对其稳定的Pickering乳液稳定性的影响,以期为PTNc在多功能材料领域的利用开发提供理论依据,促进菠萝加工副产物的高值化利用。
1 材料与方法
1.1 材料与试剂
菠萝皮渣纤维素(PPeC)由笔者所在实验室自制(纯度>90%)[13];玉米胚芽油购自山东西王食品有限公司。
盐酸(体积分数36%)、硫酸(体积分数98%),广州化学试剂厂生产;2,2,6,6-四甲基哌啶氧化物(TEMPO),阿拉丁试剂(上海)有限公司生产;溴化钠、氢氧化钠,天津市大茂化学试剂厂生产;次氯酸钠(有效氯含量≥7.5%),西亚化学科技(山东)有限公司生产;氯化钠,上海润捷化学试剂有限公司生产;所有试剂均为分析纯。
1.2 仪器与设备
BSA124S-CW型电子分析天平,赛多利斯科学仪器有限公司产品;LGJ-10型冷冻干燥机,北京松源华兴科技有限公司产品;DF-101S型磁力搅拌器,广州星烁仪器有限公司产品;JW-3021HR型高速冷冻离心机,安徽嘉文仪器装备有限公司产品;BX53型光学显微镜,日本Olympus株式会社产品;JY92-ⅡDN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司产品;Omni粒径及Zeta电位仪,美国布鲁克海文公司产品;Vector 33型傅里叶变换红外光谱仪,德国Bruker公司产品;STA449 F3型同步热分析仪,德国NATZSCH公司产品;TCS SP5型原子力显微镜,德国Leica公司产品。
1.3 实验方法
1.3.1 纤维素纳米晶的制备
1.3.1.1 硫酸水解法
参考罗苏芹等[5]的方法并加以改进。称取1 g过100目筛的PPeC于20mL硫酸(64%,体积分数)中,在45℃下磁力搅拌1.5 h至纤维素彻底被硫酸水解,加入10倍体积的蒸馏水终止反应。水解产物在8 000 r/min下高速离心洗涤2次,随后在5 000 r/min下低速离心洗涤2至3次,得到淡蓝色悬浮液,即CNCs悬浮液。将悬浮液放置于透析袋(MD55-3500)中,在蒸馏水中浸泡24h至中性,真空冷冻干燥后得到酸解纤维素纳米晶(Pineapple Peel Cellulose Nanocrystals,PPeNc),并计算得率。
1.3.1.2 TEMPO氧化法
参考Ye等[23]的方法并加以改进。称取0.5 g PPeC于50mL蒸馏水中搅拌均匀,依次加入0.008g TEMPO试剂和0.08 g NaBr,反应15 min后加入7.5 mL NaClO溶液,同时用0.5 mol/L的HCl和0.5 mol/L的NaOH调节体系pH值,将pH值维持在11左右。5h后反应结束,将产物离心(5000 r/min)洗涤数次至上清液呈中性,随后加入一定量的蒸馏水,超声粉碎得到CNCs悬浮液(超声功率400 W,超声时间10 min,其中超声3 s、间歇3 s),真空冷冻干燥后得到PTNc,并计算得率。
1.3.2 Pickering乳液的制备
参考Tang等[13]的方法,为了制备稳定的Pickering乳液,先将制备的CNCs悬浮液均稀释至1.5 g/L,再在CNCs悬浮液中缓慢添加适量的玉米油至总体积等于5mL。油水混合物在冰浴下进行超声均质处理,设置超声功率为400W,超声时间为5min,其中超声3s、间歇3s。制备好的Pickering乳液放置于室内常温下静置保存,比较PPeNc和PTNc对Pickering乳液稳定性的影响。
1.3.3 乳液稳定性研究方法
制备不同条件下的Pickering乳液,研究其稳定性。
(1)不同pH环境下乳液的制备
添 加0.1 mol/L的HCl和0.1 mol/L的NaOH入1.5 g/L的PPeNc和PTNc中,调节pH值分别至2、4、6、7、8、10、12,将不同pH值的纳米悬浮液与玉米油通过超声均质制备Pickering乳液。
(2)不同离子强度环境下乳液的制备
分别添加0、35、70、105、140mmol/L的NaCl均匀分布于1.5g/L的PPeNc和PTNc纳米悬浮液中,改变PPeNc和PTNc的离子强度,将不同离子强度的纳米悬浮液与玉米油通过超声均质制备Pickering乳液。
(3)不同油水比环境下乳液的制备
分别调节PPeNc和玉米油、PTNc和玉米油的油水比为4∶6、5∶5、6∶4、7∶3、8∶2,保持水相与油相的总体积为5mL,然后通过超声均质制备Pickering乳液。
1.4 得率计算
按下式计算PCNCs的得率:
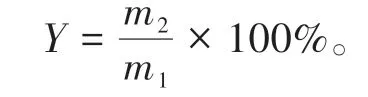
式中,Y为得率(%),m1为制备前纤维素原料的质量(g),m2为制备后PCNCs的质量(g)。
1.5 表征与分析方法
1.5.1 红外光谱分析方法
将2mg样品与溴化钾以1∶10的比例均匀混合,压片后采用傅里叶变换红外光谱仪在500~4000cm-1的波数下进行测试、分析。
1.5.2 X-射线衍射分析方法
将冻干后的样品薄膜粘贴在盖玻片表面,使用Cu-Kα辐射(λ=0.154 18 nm),在40 kV的电压和40 mA的电流下于4~50°的2θ范围内记录样品的XRD图像。其中,扫描速度为12°/min。根据Turley法计算结晶度,计算公式为
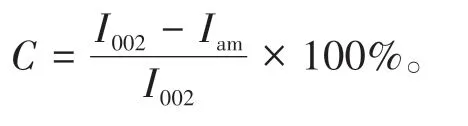
式中,C为结晶度指数(%),I002为(002)晶面衍射峰(2θ=22°~23°)的最大吸收强度,Iam为纤维素无定形区(2θ=18°~19°)的最小吸收强度。
1.5.3 热重分析方法
采用同步热分析仪进行热重分析。称取一定量的样品薄膜于样品盘中,在N2氛围下以10℃/min的升温速率从室温升至500℃。
1.5.4 原子力显微镜分析方法
将制备的CNCs悬浮液用蒸馏水稀释至0.005%(质量分数),吸取1滴稀释后的样品置于洁净的云母片表面并风干10h,采用原子力显微镜进行观察。采用NanoScope Analysis软件进行数据分析和处理。
1.5.5 Zeta电位测定方法
吸取20μL乳液用蒸馏水稀释至5 mL,通过粒径及Zeta电位仪测定Zeta电位。
1.5.6 粒径分析方法
吸取20μL乳液用蒸馏水稀释至2 mL,滴加1滴于载玻片上,在10倍物镜下进行显微观察,采用Nano Measurer 1.2软件计算液滴平均粒径。
1.6 数据处理方法
所有实验独立进行3次,并通过SPSS 22.0软件计算标准偏差,采用Origin 2018软件作图。
2 结果与分析
2.1 得率和结构分析
表1 列出了两种PCNCs的得率。可以发现,PPeNc和PTNc的得率分别为27.68%±2.93%和52.62%±3.26%,后者接近于前者的两倍,说明TEMPO氧化法可大大提升PPeC的利用率。
比较图1(a)所示PPeC、PPeNc和PTNc的红外光谱可以发现,PPeNc和PTNc均保留了纤维素原始的官能团结构。3432cm-1处的强吸收峰属于O—H的伸缩振动,2 900 cm-1处的吸收峰来自C—H的伸缩振动,1 640 cm-1处是由于纤维素吸水而产生的H—O—H特征吸收峰[24],1 376 cm-1和1 065 cm-1处的吸收峰来自O—H的弯曲振动和C—O—C的拉伸振动[25],895 cm-1处吸收峰对应于β-糖苷键的存在[26]。其中,PPeNc在1 740 cm-1和677 cm-1处出现新的吸收峰,分别对应于硫酸水解过程中纤维素表面的羟基被氧化为C==O以及SO基团的出现[5,27];而PTNc在1 740 cm-1处也出现了新的吸收峰,这是由于纤维素表面的—OH在碱性条件下被氧化为—COONa,从而在1 740 cm-1处也产生了对C==O的特征吸收[28]。
PCNCs的XRD图谱如图1(b)所示。可以发现,纤维素在2θ=15.5°,23.0°和34.5°处分别对应纤维素Iβ的(110)、(200)、(004)晶面,在2θ=12.0°附近出现对应纤维素Ⅱ的(110)晶面[29]。在2θ=23.0°附近没有出现双峰,说明PPeNc和PTNc保留了纤维素的晶型结构。通过计算可知,PPeNc和PTNc的结晶度分别为70.10%和46.70%,明显高于PPeC,这是因为PCNCs的形成破坏了非结晶区且暴露了更多的结晶区域[14]。对比PPeNc和PTNc发现,PPeNc的结晶度显著高于PTNc,这可能是由于SO2-4基团进入到非结晶区,加速了糖苷键的断裂,从而进一步提高了PPeNc的结晶度[30]。
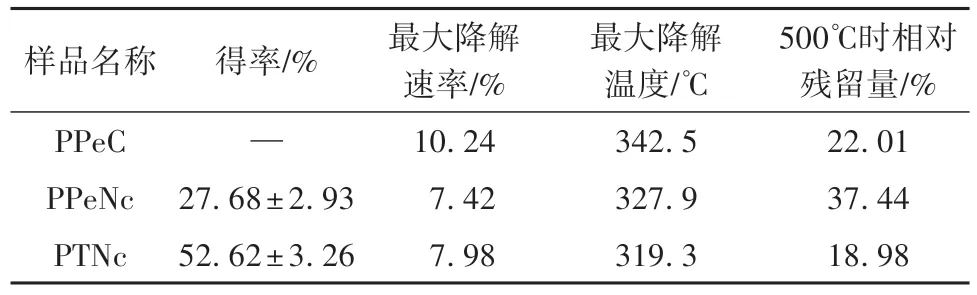
表1 PPeC、PPeNc和PTNc的得率及热重分析结果Table 1 Yield and thermal analysis results of PPeC,PPeNc and PTNc
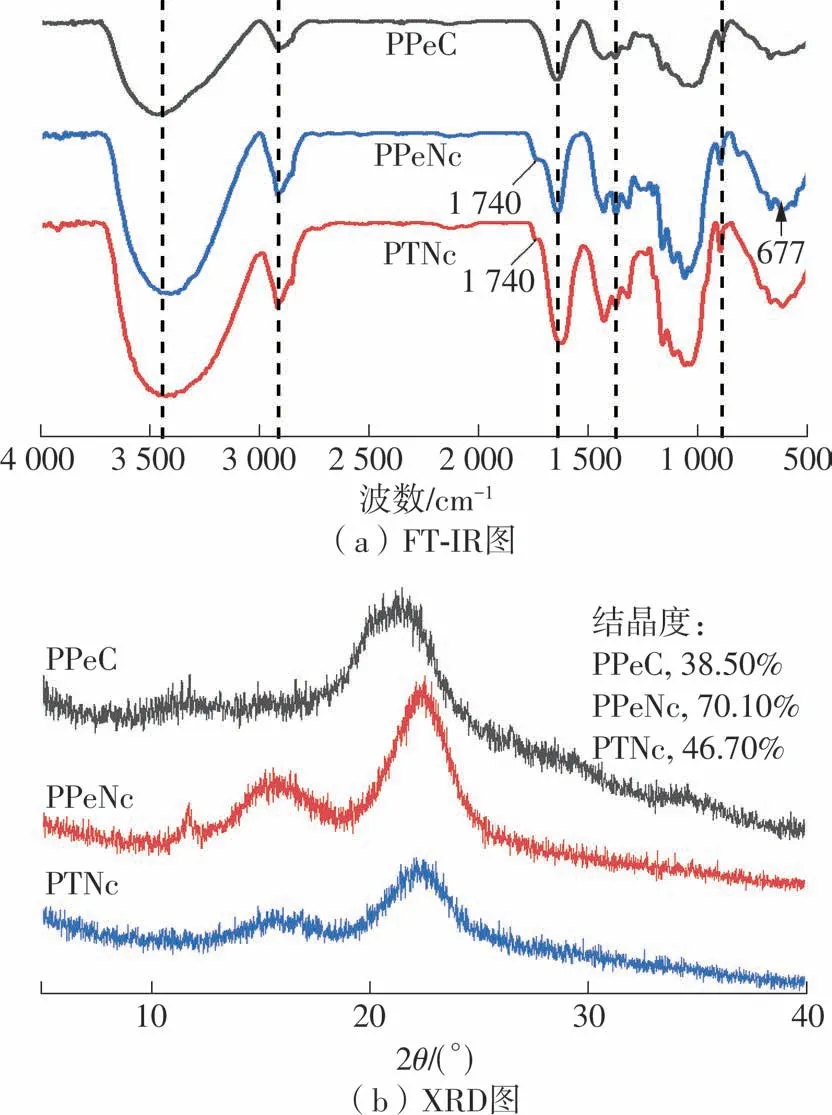
图1 PPeC、PPeNc和PTNc的FT-IR图及XRD图Fig.1 FT-IR and XRD diagrams of PPeC,PPeNc and PTNc
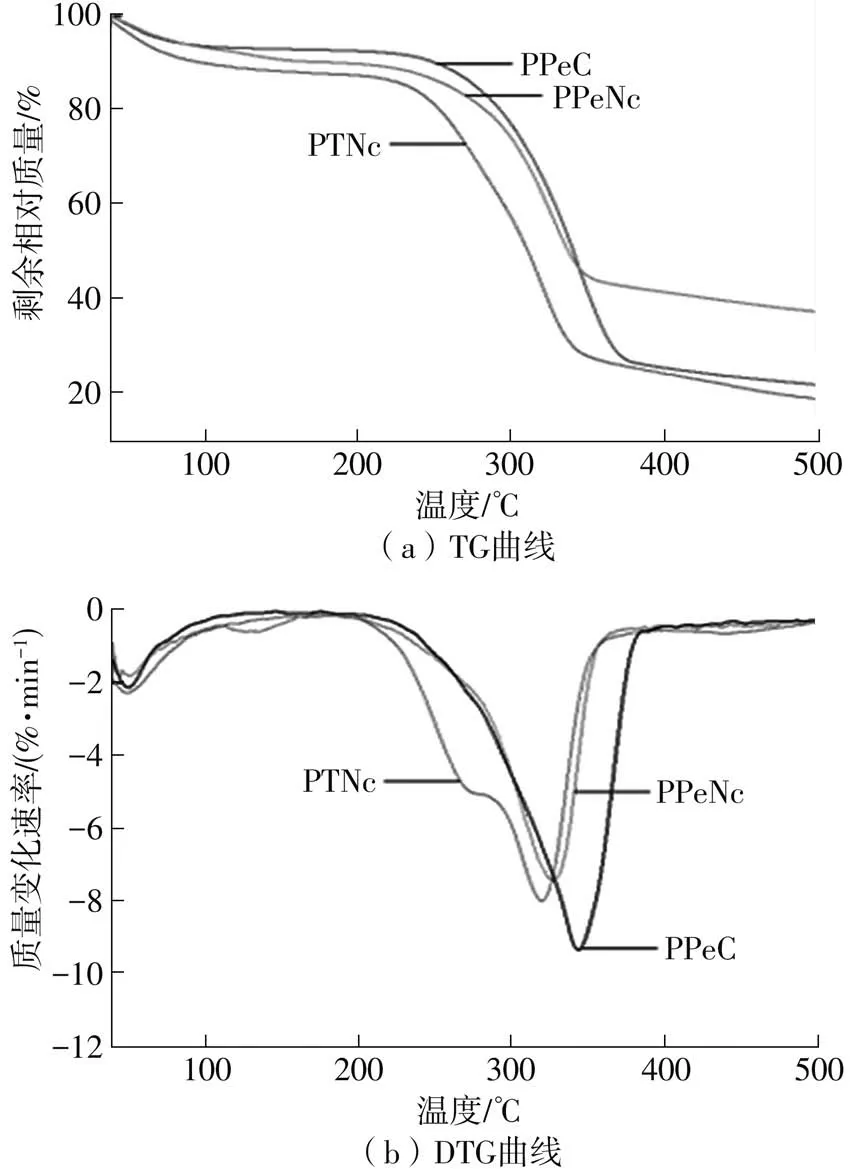
图2 PPeC、PPeNc和PTNc的TG及DTG曲线Fig.2 TG and DTG curves of PPeC,PPeNc and PTNc
2.2 热重分析
通过对比图2所示PPeNc和PTNc的TG和DTG曲线,来分析两者热稳定性的差异。由图2(a)所示TG曲线可看出,纤维素和纤维素纳米晶的降解主要分为两个阶段:①30~100℃之间物质中残留水分的蒸发;②250~370℃之间物质在高温下的降解。如表1所示,在500℃时,PPeC、PPeNc和PTNc的相对残留量分别为22.01%、37.44%和18.98%,其中PPeNc的高残留可能归因于其内部区域的硫酸化作用在加热过程中起到的阻燃作用[31]。由表1可知,PPeC、PPeNc和PTNc的最大降解速率分别为10.24%、7.42%和7.98%,对应的温度分别为342.5℃、327.9℃和319.3℃。相对于PPeC,PCNCs的最大降解速率减小,所对应的降解温度降低,热稳定性均有所下降,而PTNc的热稳定性较差,且在图2(b)所示DTG图中显示出两段降解峰,这可能是由于在TEMPO氧化过程中,除了羧基的取代外,随着氧化程度的增加,纤维素聚合程度降低,导致了游离醛基的增多。类似的现象在其他研究中也被观察到[31-32]。
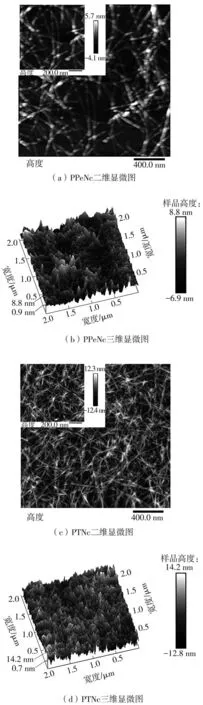
图3 PPeNc和PTNc的AFM图Fig.3 AFM diagrams of PPeNc and PTNc
2.3 原子力显微分析
PPeNc和PTNc的原子力显微图像如图3所示。从图中可以发现,PPeNc和PTNc均呈纤维网状结构,结合3D图像观察到两者均不存在明显的纳米纤维堆叠现象。但是所制备的PPeNc和PTNc在微观表征上存在明显的差别。通过NanoScope Analysis软件分析PPeNc和PTNc各自对应的长、宽、高分布,结果如图4所示。PPeNc的长度主要分布在400~500nm区间,而PTNc主要分布在500~700nm区间,在CNCs长度上明显高于前者。对比CNCs的宽度发现,PPeNc的宽度主要分布在20~30 nm区间,PTNc的宽度主要分布在10~15nm区间。计算发现,PPeNc和PTNc的平均纵横比分别为18.90和54.11。观察PPeNc和PTNc的高度分布可以发现,PTNc相对直径更大,主要集中在16.05 nm左右,而PPeNc的直径主要集中在11.66 nm左右,说明PPeNc更加纤细。以上分布结果表明,所制备的PTNc相较于PPeNc具有更高的纵横比和更大的纤维直径,这些特点使得PTNc在制备功能性膜、气凝胶微球等方面具有独特的优势[33-34]。
2.4 不同pH条件下纤维素纳米晶的稳定性
Zeta电位能够反映乳液分散体系的稳定性,一般而言,电位的绝对值大于25mV即说明样品在体系中具有较好的稳定性[35]。如图5所示,PPeNc和PTNc在不同pH值下的Zeta电位值具有明显差异。观察发现,在pH=7时,PPeNc和PTNc的Zeta电位绝对值均达到最高且高于35 mV,说明在pH=7时PPeNc和PTNc均能够保持最佳的稳定性。随着H+或OH-逐渐增多,PPeNc和PTNc的Zeta电位下降,尤其是在pH=2时电位绝对值均小于10 mV,并且出现纳米颗粒团聚的现象,分散体系极度不稳定。这一现象的原因可能是由于pH=2时H+浓度高,羟基出现质子化现象,导致纳米颗粒表面的负电荷消失所引起的[36]。在pH=12时,PPeNc和PTNc的电位相差较大,这可能与纤维素纳米晶的结晶度有关。产物结晶度越高,对H+或OH-的添加越敏感,电位变化越剧烈[37]。对比PPeNc和PTNc在不同pH值下的Zeta电位值可发现,PTNc的Zeta电位绝对值始终高于PPeNc,说明PTNc具有更好的分散稳定性,这可能与TEMPO氧化纤维素表面聚集了大量羧基基团,导致体系高度阴离子化有关[15]。
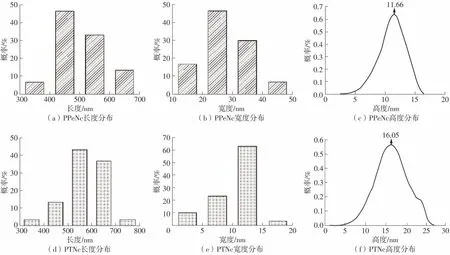
图4 PPeNc和PTNc的长、宽、高分布Fig.4 Length,width and height distributions of PPeNc and PTNc
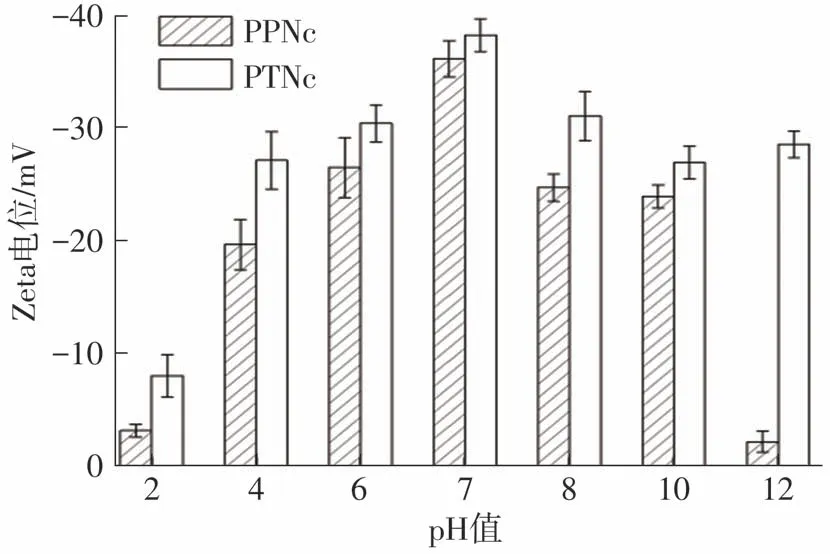
图5 PPeNc和PTNc在不同pH值下的Zeta电位Fig.5 Zeta potentials of PPeNc and PTNc at different pH values
2.5 不同因素对两种纤维素纳米晶制备的Pickering乳液稳定性的影响
2.5.1 pH值的影响
图6所示为两种纤维素纳米晶制备的Pickering乳液(PPeNc-P和PTNc-P)在不同pH值下的Zeta电位、光学图片及光学显微照片。由图6(a)可以发现:随着pH值的不断增大,利用PPeNc和PTNc两种PCNCs制备的Pickering乳液(PPeNc-P和PTNc-P)的Zeta电位绝对值均不断增大,表明其稳定性逐渐增强;而且,PTNc-P在不同pH值下均表现出相对较高的Zeta电位绝对值,这和图5的结果具有一定关系,说明PCNCs的稳定性会进一步影响到其制备的Pickering乳液的稳定性。由图6(b)所示PPeNc-P和PTNc-P的光学图片可以看出,在不同pH值下PCNCs均能良好地稳定乳液,并呈现乳白色。pH值对PPeNc-P和PTNc-P粒径大小的影响如图6(c)所示,可见,随着pH值的增大,PPeNc-P和PTNc-P的粒径均逐渐减小,乳液体系趋向于更加稳定的状态。其中,PTNc-P的粒径在PH=2~12时均低于PPeNc-P,甚至在pH=12时达到纳米级别(<1μm),表明pH值增大会对乳液的稳定性产生积极影响。这一现象可能与PCNCs表面带负电荷的基团在碱性体系中易被电离,从而使由PCNCs所构成的两相界面相互排斥力增强有关[38]。
2.5.2 离子强度的影响
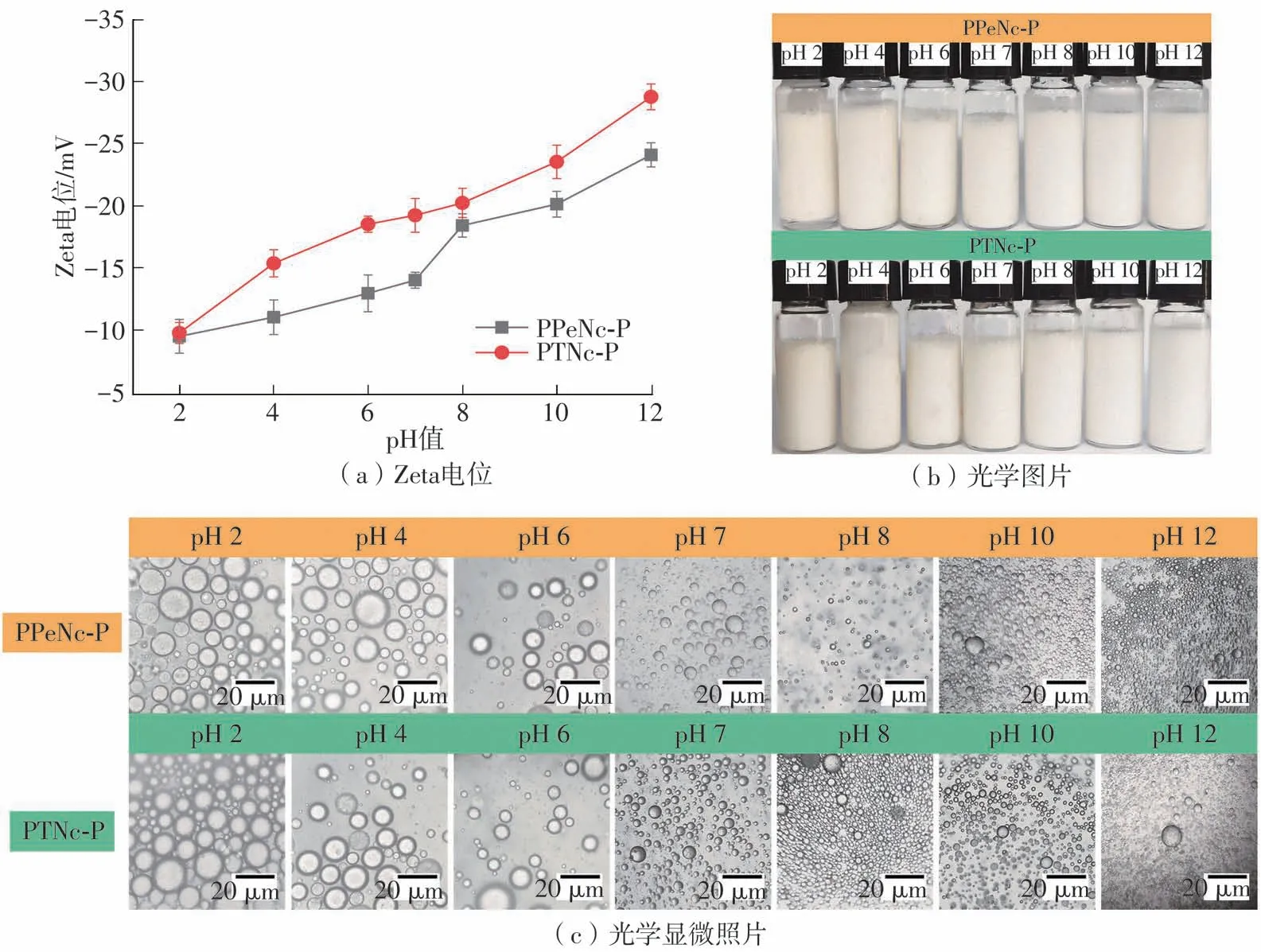
图6 PPeNc-P和PTNc-P在不同pH值下的Zeta电位、光学图片及光学显微照片Fig.6 Zeta potentials,optical images and optical micrographs of PPeNc-P and PTNc-P at different pH values
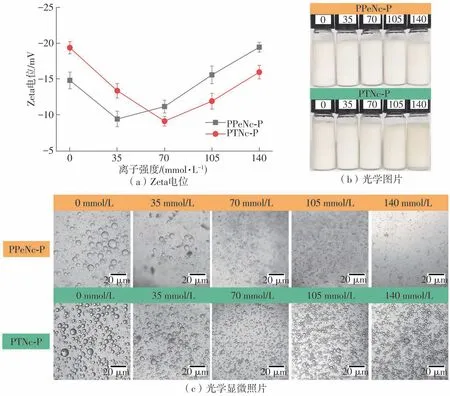
图7 PPeNc-P和PTNc-P在不同离子强度下的Zeta电位、光学图片及光学显微照片Fig.7 Zeta potentials,optical images and optical micrographs of PPeNc-P and PTNc-P at different ionic strengths
PPeNc-P和PTNc-P的稳定性与离子强度之间的关系如图7所示。由图7(b)可见,Pickering乳液没有明显分层,离子强度的变化对乳液的外观不会产生明显影响。由图7(a)和7(c)所示不同离子强度下Pickering乳液的Zeta电位和粒径可以看出:随着离子强度的增大,所制备的Pickering乳液的Zeta电位绝对值先减小后增大,这可能是因为在一定离子浓度下体系产生了静电屏蔽效应,削弱的静电排斥力促使液滴产生团聚,分散性差[39];随着离子强度的增大,乳液粒径逐渐减小,并逐渐趋于稳定,其原因在于,随着离子强度的增大,渗透压升高,界面压力变大,液滴之间的相互聚集被抑制,导致乳液粒径开始减小,稳定性增强[40]。
2.5.3 油水比的影响
油水比会影响Pickering乳液体系中PCNCs的相对浓度以及连续相黏度,从而增加颗粒界面膜的厚度,并抑制液滴在连续相中聚集的速率[41-42]。如图8(a)所示,所制备的两种Pickering乳液PPeNc-P和PTNc-P的Zeta电位绝对值随着油水比的下降呈先增大后减小的趋势,说明乳液的分散稳定性随着油水比的下降先增强后减弱,并且均在油水比4∶6时达到最高。在油水比5∶5至2∶8之间,PPeNc-P的Zeta电位绝对值低于PTNc-P,乳液稳定性较低。光学图片(见图8(b))显示,Pickering乳液被PCNCs良好地稳定,并且随着油水比的变化不会影响乳液最初的水油平衡。油水比对乳液粒径的影响如图8(c)所示,可以发现,油水比对PCNCs的粒径无明显影响,粒径均稳定在6μm左右。
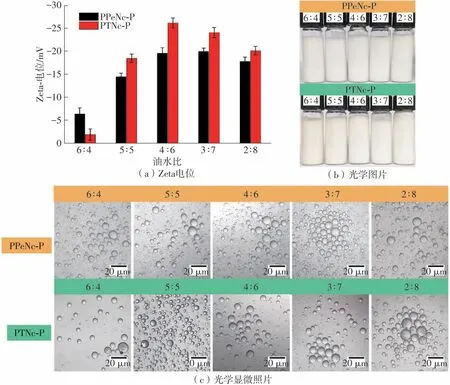
图8 PPeNc-P和PTNc-P在不同油水比下的Zeta电位、光学图片及光学显微照片Fig.8 Zeta potentials,optical images and optical micrographs of PPeNc-P and PTNc-P at different oil-water ratios
2.6 贮存稳定性
将PPeNc-P和PTNc-P在室内常温下静置数天以研究其贮存稳定性,结果如图9所示。对比发现:PPeNc-P在贮存60 d后开始产生沉降,在70 d左右乳液出现大量絮凝以及油水分离的现象,乳液彻底失稳;而PTNc-P在第70 d未发现表观上有任何明显的絮凝或油水分离现象,继续放置至第5个月,乳液依旧保持稳定。显微镜观察发现:PPeNc-P在贮存期间其液滴粒径逐渐增大,在第70 d观察到液滴大量团聚以及水包油乳液体系被破坏的现象;而PTNc-P在贮存第60 d的液滴粒径明显小于PPeNc-P,在第70 d时,极少数的液滴存在团聚,且液滴粒径没有明显变化。PTNc-P的高稳定贮存性可能是因为PTNc的纤维表面具有高密度的电离电荷,在Pickering乳液体系中产生有效的静电排斥,从而能够更好地抑制液滴之间相互聚集,维持体系的静电稳定[43]。

图9 PPeNc-P和PTNc-P的贮存稳定性Fig.9 Storage stability of PPeNc-P and PTNc-P
3 结论
文中制备了PPeNc和PTNc两种纤维素纳米晶,并考察了它们在Pickering乳液中的环境稳定性。结果表明,通过硫酸水解和TEMPO氧化均能成功制备出PCNCs,并且两者Pickering乳液的稳定性受到pH值、离子强度和油水比的影响。对比PPeNc,PTNc具有高得率、高纵横比和高分散稳定性的特点。较PPeNc-P而言,PTNc-P在pH=2~12时的稳定性更高,在离子强度小于70 mmol/L和油水比低于5∶5时均表现出更加优异的分散稳定性,并且PTNc-P的贮存稳定性远远优于PPeNc-P。综上所述,PTNc稳定的Pickering乳液在环境变化和贮存过程中表现出更加优良的稳定性,这些特点体现了PTNc-P在食品领域具有包埋并长期贮存生物活性物质的巨大潜力。

