IVF-ET中卵裂球多核胚胎发育潜力的分析
滕文顶,鲜 红,王 芳,杜昊轩,孟祥黔,张小建,单旭东
(1.成都市妇女儿童中心医院 生殖健康与不孕症科,四川 成都 610091; 2.成都西囡妇科医院 生殖医学科,四川 成都 610023; 3.四川省医学科学院·四川省人民医院生殖医学中心,四川 成都 610000;4.四川大学 华西基础医学与法医学院,四川 成都 610041; 5.成都中医药附属生殖妇幼医院 生殖医学中心,四川 成都 610041; 6.成都中医药大学 医学与生命科学学院,四川 成都 611137)
0 引 言
在体外受精和胚胎移植(In Vitro Fertilization and Embryo Transfer,IVF-ET)的胚胎培养过程中,第2天(D2)或第3天(D3)的胚胎卵裂球中部分卵裂球含有多于一个细胞核的卵裂球称为多核卵裂球(Multi Nucleated Blastomere,MNB),含有多核卵裂球的胚胎称之为多核胚胎[1].多核现象在IVF周期中较为常见,约20%~40%的胚胎和多于70%的周期存在多核现象[2-5].一般认为,多核现象产生的主要原因:培养液准备不充分;在低温下对卵子进行操作引起细胞骨架的变化[6-8].除此之外,体外操作时对卵子纺锤体的影响[9],促排卵过程中对卵巢的刺激[10]等,也被认为可能造成多核现象.陈磊等[11]研究报道 2、4细胞卵裂球多核均可影响胚胎发育及移植后妊娠结局.Ambroggio等[12]报道D2和D3存在多核的胚胎大多会发生染色体随机易位等异常现象,MNB胚胎植入前遗传学筛查(PGS)多倍体的几率增加.MNB胚胎与低着床率、高染色体异常率和高流产风险相关[10],甚至有报道多核胚胎产生连体婴儿[13].相反,Ramirez等[14]报道2细胞时存在多核的胚胎在4细胞阶段多核消失,并在冷冻解冻后移植并成功妊娠.Elif等[15]报道2-,4-,6-细胞阶段的多核胚胎发育时间长于非多核胚胎,但妊娠结局没有差异.王志强等[16]研究认为随着胚胎的不断分裂,细胞核状态也在不断发生着改变,伴随着胚胎有丝分裂的不断进行,胚胎相应的自我修复程序也在持续进行,这种修复程序可以使本次分裂过程中的多核卵裂球在下次分裂过程中得以恢复,多核可能是一种暂时和可逆转的现象.Aguilar等[17]报道认为早期卵裂球多核胚胎与低着床率没有联系,另外有研究证明MNB胚胎同样具有良好的发育潜力和临床结局[18-20].同时,本研究也发现国内有关MNB胚胎发育潜能的研究很少.显然,在IVF-ET中MNB胚胎的发育潜力和妊娠结局还存在争论.
在IVF-ET中,D3移植胚胎选择原则是优先选择优质胚胎移植,若无优质胚胎可选择情况下,也可选择非优质胚胎移植,多个研究[21-25]和我们中心[26]的数据显示非优质胚胎具有发育到囊胚的潜能,且移植后有30%以上的临床妊娠率.因此,本研究将胚胎分成优质胚胎和非优质胚胎两种亚组,再根据D2出现多核的卵裂球数目进行分组,分析比较不同组胚胎的囊胚形成率、可用囊胚形成率、囊胚染色体整倍体率及解冻囊胚周期的临床结局,以期探讨不同质量和不同MNB胚胎的发育潜力,为IVF-ET中多核胚胎的合理使用提供参考依据.
1 研究对象与方法
1.1 研究对象
2014年6月至2022年6月,在成都市妇女儿童中心医院、成都西囡妇科医院和成都中医药大学附属生殖妇幼医院生殖医学中心进行IVF-ET治疗的患者及其临床资料.
1.2 纳入标准
夫妇染色体正常,女性年龄<35岁,控制性促排卵采用黄体中期长方案,并排除内分泌疾病(高泌乳素血症、甲状腺功能异常、糖尿病等)、传染病及吸烟、酗酒、吸毒等不良嗜好的患者.
1.3 分组
根据正常受精胚胎(受精卵有两个原核,2PN)D2和D3的形态学序贯评分将胚胎分为优质胚胎和非优质胚胎两个亚组,每个亚组根据胚胎D2出现多核的卵裂球数目(一个或多个)又分为两组,每个亚组设一个对照组.组1(对照组),D2卵裂球未见多核胚胎,即非多核胚胎;组2,D2单卵裂球多核胚胎;组3,D2多卵裂球多核胚胎.各组的典型现象如图1所示.在胚胎植入前遗传学诊断/筛查(PGD/PGS)周期中,囊胚培养一般采用集体培养,即将3~5枚卵裂期胚胎共同放在一个微滴里培养,张静雯等[27]研究证实了胚胎集合微滴培养囊胚较单胚胎微滴培养有明显优势,但集体培养会导致形成的囊胚与卵裂期胚胎不能一一对应.由于PGD/PGS周期中均对每枚可利用囊胚进行遗传学检测,染色体正常与否是我们选择胚胎的主要参考依据,因此,未对样本进行优质胚胎和非优质胚胎亚分组.另外,D2多卵裂球多核胚胎的囊胚形成率和可用囊胚形成率较低,获得的可利用囊胚数较少,因此,未对D2多卵裂球多核胚胎形成的囊胚进行染色体整倍体率和临床结局分析.

(A)D2胚胎卵裂未见多核 (B)D2胚胎单卵裂球多核 (C)D2胚胎多卵裂球多核图1 三组不同多核情况胚胎Fig.1 Three groups of embryos with different multinucleated conditions
1.4 治疗方案
1.4.1 促排卵和授精
患者均采用GnRH (GnRH,r-FSH 75 IU,Merck Serono or Livzon)常规降调节长方案促排卵,通过雌激素(E2)水平和经阴道B超检测卵泡.当优势卵泡达到 18 mm 时注射人绒毛膜促性腺激素(hCG,250 μg,Merck Serono),注射hCG后36~38 h 取卵,卵子取出后转入含 1 mL 人输卵管液(Quinn’s Advantage®Fertilization HTF,SAGE 1020)的井皿中(BD Falcon 353037),置于 37 ℃,5.5% CO2, 5% O2的培养箱中培养.HTF提前加10%人蛋白替代品(Quinn’s Advantage®,SPS Serum Protein Substitute,SAGE 3010),盖油(oil for tissue culture,SAGE 4008)过夜平衡.常规IVF周期中,授精在注射hCG 39~40 h 后进行.ICSI周期中,获卵后2~3 h 去颗粒细胞,注射hCG 40~41 h 后对成熟卵子行ICSI.
1.4.2 胚胎培养和观察
胚胎采用微滴法进行培养,受精后卵子转移到卵裂液(Quinns Advantage®Cleavage Medium SAGE 1026)中继续培养,卵裂液提前加10%SPS,在 35 mm 皿中制成25 μL微滴盖油,置于 37 ℃,5.5% CO2,5% O2的培养箱中过夜平衡.授精后16~18 h 观察原核,受精卵2PN为正常受精,D2和D3继续观察胚胎发育情况.根据Racowsky等[28]等的标准对胚胎进行评分.胚胎移植在取卵后 72 h 进行.D3移植或冷冻胚胎不超过4枚,剩余胚胎继续囊胚培养.囊胚液(Quinns Advantage®Blastocyst Medium,SAGE 1029)提前加10%SPS,在 35 mm 皿中制成 25 μL 微滴盖油,在 37 ℃,5.5% CO2,5% O2的培养箱中过夜平衡.
1.4.3 胚胎冷冻与解冻
在细胞培养的第5/6天(D5/D6),使用SAGE冷冻试剂盒(SAGE 8025,SAGE 8030)对可利用囊胚进行封闭载体冷冻,冷冻和解冻都按照说明书进行.
1.4.4 胚胎染色体整倍性筛查(PGS)
取囊胚滋养层细胞5~10个,利用单细胞全基因扩增技术对取样细胞进行扩增,使用苏州贝康医疗器械公司生产的检测试剂盒和基因测序仪DA8600,采用半导体高通量测序技术对扩增产物进行全基因测序,通过生物信息软件对测序结果进行数据分析,判断胚胎是否存在染色体非整倍体异常.
1.5 分析指标
1.5.1 卵裂期胚胎评级标准
卵裂期胚胎形态学评分参考Racowsky等[28]的方法,在胚胎发育速度正常的前提下,将细胞数、碎片、卵裂球均一度三个指标整合在一起进行评级(见表1).然后,再结合细胞数目对胚胎进行评级,D2细胞数为3~6个,且D3细胞数为7~9个的Ⅰ级与Ⅱ级胚胎为优质胚胎,D3细胞数≥5个的Ⅰ级、Ⅱ级和Ⅲ级胚胎为可利用胚胎.

表1 卵裂期胚胎评级标准[28]Tab.1 The grading criteria for embryos in cleavage stages
1.5.2 囊胚期胚胎评级标准
囊胚期胚胎观察、分期和评级参照Gardner[29]分期和评分:D5或D6对3、4、5、6期囊胚进行评级,1期和2期不评级.
1)内细胞团(ICM))评级
A级为ICM包裹紧密,有很多细胞;B级为ICM细胞较分散,仅少数细胞;C级为ICM很少细胞.
2)滋养层评级
A级为很多细胞形成连续的上皮;B级为较少的细胞形成疏松的上皮;C级为仅很少几个大细胞.
D5/D6对发育到3期或3期以上囊胚,内细胞团和滋养层细胞评级至少有1个B或A可利用囊胚.
1.5.3 观察指标
囊胚形成率=2期及2期以上囊胚数/行囊胚培养的卵裂期胚胎总数×100%;可用囊胚形成率=可用囊胚数/行囊胚培养的卵裂期胚胎总数×100%;临床妊娠率=临床妊娠周期数/移植周期数×100%;着床率=孕囊数/移植胚胎数×100%;活产率=分娩活胎周期数/移植周期数×100%;流产率=流产周期数/妊娠周期数×100%;畸形率=胎儿畸形周期数/妊娠周期数×100%.
1.6 统计学处理
文中样本数据采用SPSS 21.0软件进行统计分析,定量资料组间比较采用t检验(符合正态分布且方差齐)或t’检验(符合正态分布,方差不齐),不满足正态分布的定量资料组间比较采用Wilcoxon秩和检验;定性资料组间差异比较采用卡方检验.P<0.05为差异显著,P<0.01为差异极显著.
2 结果
2.1 优质胚胎囊胚培养结果
对于优质胚胎(见表2),组2和组3的囊胚形成率均小于对照组.然而,χ2检验表明组2和对照组的分组与囊胚形成及可用囊胚形成均是独立事件(P>0.05),即D2单卵裂球多核现象不影响胚胎的囊胚形成和可用囊胚形成.组3和对照组的分组与囊胚形成及可用囊胚形成均非独立事件(分别为P=0.006和P=0.003),表明D2多卵裂球多核现象影响胚胎的囊胚形成和可用囊胚形成.

表2 MNB优质胚胎囊胚培养结果Tab.2 Results of blastocyst culture of MNB high-quality embryos
2.2 非优质胚胎培养囊胚结果比较
对于非优质胚胎(见表3),组2和组3的囊胚形成率均低于对照组.然而,组2和对照组的分组与囊胚形成是独立事件(P=0.249),这表明在非优质胚胎分组中,D2单卵裂球多核现象与对照组相比,囊胚形成率无显著差异(P>0.05).组3和对照组的分组与囊胚形成不是相互独立事件(P<0.05),即D2多卵裂球多核现象影响胚胎的囊胚形成,显著降低囊胚形成率.组2、组3的可用囊胚形成率均低于对照组,且与对照组的分组与可用囊胚形成为非独立事件(P<0.05),表明在非优质胚胎分组中,D2两种卵裂球多核现象都影响可用囊胚形成,并显著降低可用囊胚形成率.

表3 MNB非优质胚胎囊胚培养结果Tab.3 Results of blastocyst culture of MNB non-high-quality embryos
2.3 囊胚染色体非整倍体筛查结果
在PGD/PGS周期中,均对每枚可利用囊胚进行染色体非整倍体筛查,囊胚培养一般采用集体培养,即3~5枚卵裂期优质胚胎和非优质胚胎共同放在一个微滴里培养,形成的囊胚与卵裂期胚胎不能一一对应,因此,未对样本进行优质胚胎和非优质胚胎亚分组.目前所开展(PGD/PGS)周期中,有156枚非多核胚胎形成的囊胚,13枚单卵裂球多核胚胎形成的囊胚.非多核胚胎的染色体正常率为48.08%,单卵裂球多核胚胎的染色体正常率为46.15%(见图2).χ2检验结果表明,D2单卵裂球多核组和非多核组的染色体正常率无显著影响(P>0.05).因此,可认为D2单卵裂球多核胚胎经过囊胚培养后,其形成的可用囊胚与非多核胚胎形成的可用囊胚的染色体整倍体率无显著差异.另外,由于D2多卵裂球多核胚胎形成的可用囊胚样本量较少,未对囊胚染色体整倍体率进行统计学分析.
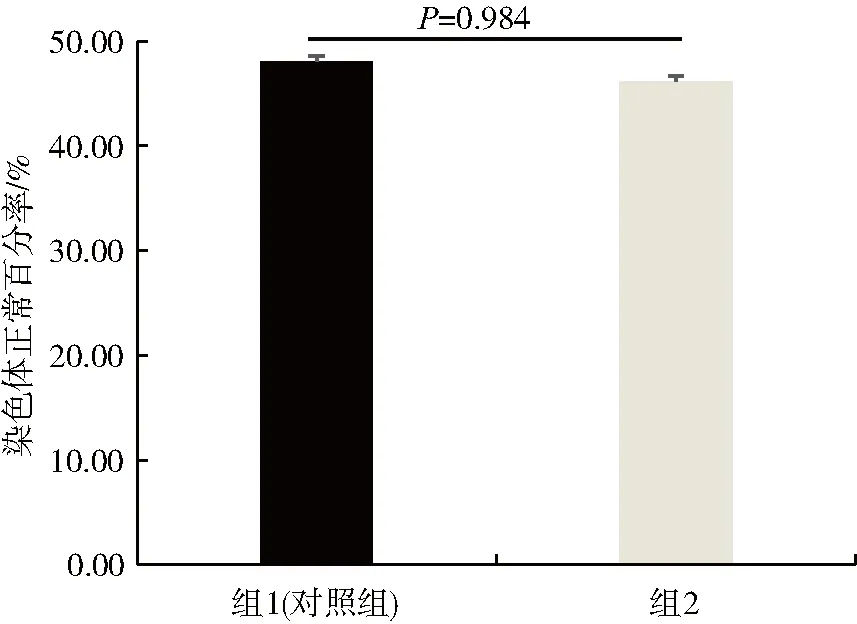
图2 胚胎染色体非整倍体筛查结果Fig.2 Chromosome aneuploidy screening results of embryos
2.4 优质胚胎临床结局
对于优质胚胎(见表4),D2单卵裂球多核胚胎组解冻48个周期,54枚囊胚移植;非多核胚胎组解冻 1 137 个周期 1 320 枚囊胚移植.两组患者年龄和平均移植胚胎数无显著差异,排除这两方面对临床结局的影响.χ2检验结果表明,D2单卵裂球多核组和非多核组的临床妊娠率、着床率、流产率和活产率均无显著影响(P>0.05).在两组中均出现畸形胎儿,但无显著差异(P=0.455),并在出生前引产.另外,D2多卵裂球多核胚胎形成囊胚的移植周期样本量较少,因此,未对其进行统计学分析.

表4 MNB优质胚胎囊胚解冻周期比较Tab.4 Comparison of thawing cycle of MNB high-quality embryos
2.5 非优质胚胎临床结局比较
对于非优质胚胎(见表5),D2单卵裂球多核胚胎组解冻42个周期,47枚囊胚移植;非多核胚胎组解冻 2 111 个周期,2 610 枚囊胚移植.两组在患者年龄和移植胚胎数上并无显著差异,可以排除这两方面对临床结局的影响.与对照组相比,D2单卵裂球多核组的临床妊娠率、着床率、流产率均低于对照组.然而,χ2检验结果表明D2单卵裂球多核组和非多核组的临床妊娠率、着床率、流产率和活产率均无显著影响(P>0.05).畸形胎儿在对照组出现,而多核组未出现.另外,D2多卵裂球多核胚胎形成囊胚的移植周期样本量较少,因此未对其进行统计学分析.
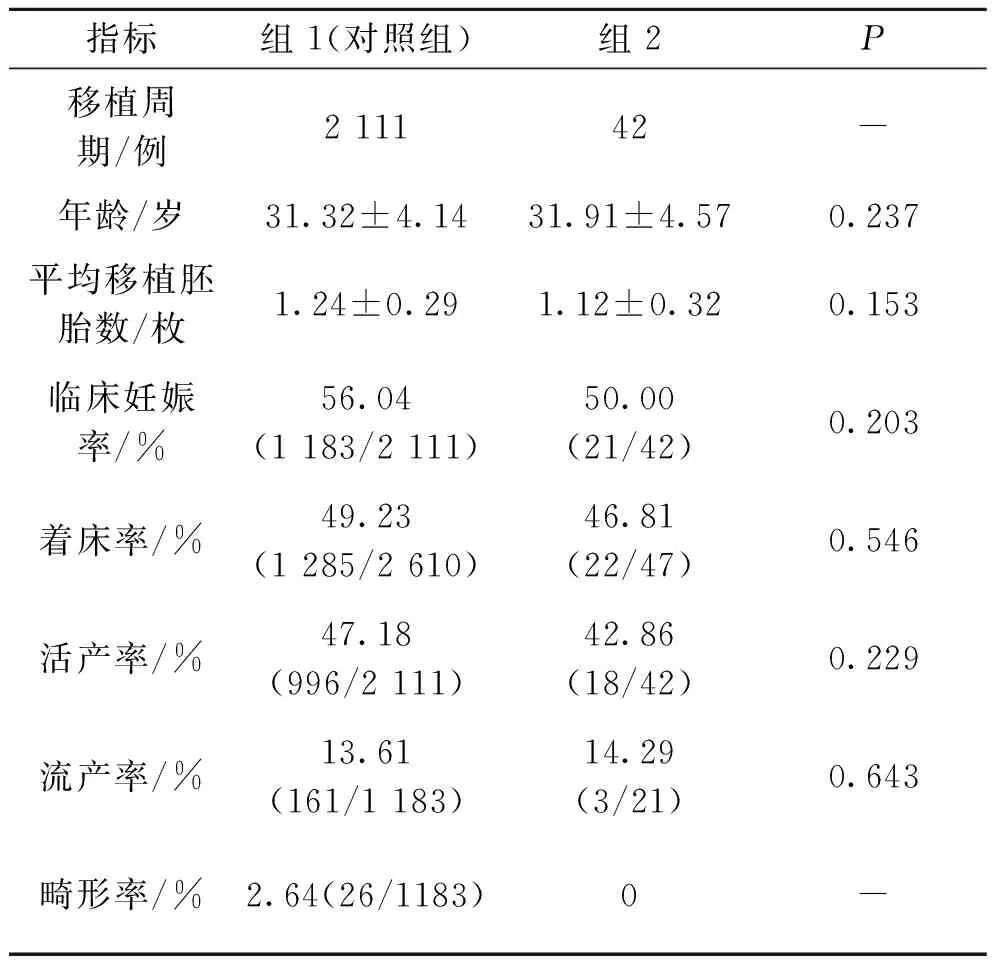
表5 MNB非优质胚胎囊胚解冻周期比较Tab.5 Comparison of thawing cycle of MNB non-high-quality embryos
3 讨 论
卵裂球多核对胚胎质量的影响有多种观点.Elif等[15]报道妊娠和未妊娠组的卵裂球多核的比例、数量和观察到多核的时间点等均无显著差异.Aguiar等[19]报道,单卵裂球多核胚胎的囊胚形成率与对照组无显著差异,而多卵裂球多核胚胎的囊胚形成率较低,与对照组有显著差异.本研究对多核胚胎的囊胚发育情况进行了具体分组分析.对于优质胚胎,D2单卵裂期多核胚胎的囊胚形成率和可用囊胚形成率均与对照组无显著差异;而D2多卵裂球多核胚胎的囊胚形成率和可用囊胚形成率均与对照组差异显著(见表2).对于非优质胚胎,D2多卵裂球多核胚胎的囊胚形成率和可用囊胚形成率均显著低于对照组;D2单卵裂球多核胚胎的可用囊胚形成率也显著低于对照组(见表3).本研究结果与Aguiar等[19]的报道一致.本研究也发现,D2单卵裂球多核胚胎,D3大部分卵裂球多核消失,尤其是优质胚胎;而D2多卵裂球多核胚胎,D3仍有一部分胚胎卵裂球多核,这与Ramirez、王志强等[14,16]研究结论基本吻合.造成这一现象可能原因是:卵裂球多核胚胎在发育过程中有自我修复功能,但多卵裂球多核胚胎的卵裂球异常比例较高,胚胎进一步发育过程中难以得到修复,导致胚胎凋亡而不能发育到囊胚;另外,多核优质胚胎在进一步发育过程中的修复能力较强,一些多核卵裂球在D2到D3发育过程得以修复,多核消失,而非优质胚胎的修复能力较差,一些多核卵裂球形成碎片而凋亡,从而影响囊胚形成和囊胚质量.综上,与对照组相比,D2单卵裂球多核优质胚胎的囊胚形成率和可用囊胚形成率均无统计学差异,而D2多卵裂球多核胚胎,无论是优质胚胎还是非优质胚胎,其囊胚形成率和可用囊胚形成率均显著低于对照组.
胚胎低着床率与胚胎高染色体异常率密切相关[4 ,13].本研究分别对13枚D2单卵裂球多核胚胎形成的囊胚进行PGS检测,染色体正常率为46.15%,与对照组的染色体正常率没有显著差异(见图2),Balakier、Hashimotos等[30-31]研究支持本研究的结论,对于D2细胞期出现多核现象的胚胎,通过对由其发育而来的囊胚进行染色体分析,大约50.0%的囊胚染色体为整倍体,与对照组没有显著差异.但部分研究者与本研究的结果不一致,可能原因是我们的PGS检测对象是囊胚期胚胎,而其研究的PGS检测对象是卵裂期胚胎,卵裂球多核胚胎可能通过胚胎自我修复机制来进行胚胎的早期自我修复而发育到囊胚,而不能进行自我修复的胚胎发育不到囊胚而凋亡.
MNB胚胎移植周期的临床妊娠结局有大量研究报道,但没有得出统一的结论.MNB胚胎与低着床率和高流产风险相关[10],Fauque等[20]认为D2卵裂球多核胚胎移植后种植率没有显著变化,但活产率降低.Aguilar等[19]认为早期卵裂球多核胚胎与低着床率没有联系.Duke等[18]认为卵裂球多核发育来的优质囊胚具有较高的种植潜能.Seikkula等[8]对解冻胚胎的研究则认为解冻D2多核胚胎移植后种植率没有显著变化.本研究将所有的MNB胚胎培养到囊胚进行冷冻,解冻囊胚进行移植.大量文献已证实,囊胚期胚胎的染色体异常率低于卵裂期胚胎,囊胚培养可淘汰掉一部分染色体异常的胚胎,另外囊胚与子宫内膜的容受性更好.本研究结果显示:无论D3是优质胚胎还是非优质胚胎亚组,D2单卵裂球多核胚胎形成囊胚进行冷冻解冻移植,其临床妊娠率、着床率、流产率、活产率、胎儿畸形率与对照组均无显著差异(表4和表5).我们的结果与Duke、Seikkula、Aguilar等[8,18,19]研究结果一致,但与Van Royen、Fauque等[10,20]报道的结果不一致,原因可能是不同研究者移植胚胎情况不一样,有囊胚期胚胎和卵裂期胚胎之分,患者内膜条件以及怀孕期间所处环境等因素均与妊娠结局相关.有关移植多核胚胎产生连体胎儿的报道[13].在本研究中,对照组和D2单卵裂球多核胚胎组均出现流产和胎儿畸形现象,但它们之间差异不显著(见表4和表5),产生连体胎儿可能与其他因素有关.
不同研究者和本文作者对MNB胚胎的囊胚形成率、染色体整倍体率及临床结局等指标研究结果不一致,分析造成研究结果差异的原因可能有:不同生殖中心的促排卵方案、胚胎培养实验室技术及胚胎评分标准不一样;不同实验室研究胚胎的发育阶段不一样,有卵裂期胚胎和囊胚期胚胎之分;另外,不同实验室研究的胚胎质量不一样.本研究为了排除以上因素造成的影响,采用常规降调节长方案促排卵,实验室采用统一的培养体系和操作规程,将多核胚胎分成优质胚胎和非优质胚胎两个亚组,每个亚组再根据出现多核的卵裂球数目分成三个组,每个组培养至囊胚进行囊胚移植和对囊胚进行染色体分析.本研究的不足之处在于一些组的样本量较少,如多卵裂球多核胚胎解冻移植周期数较少,多核胚胎的染色体非整倍体筛查样本较少,需要进一步扩大样本量去验证.
4 结 论
经过以上分析,得到以下结论:
1)D2单卵裂球多核胚胎,尤其是单卵裂球多核优质胚胎具有良好的发育潜力,其囊胚移植后有良好的临床结局.
2)建议在常规辅助生殖治疗中出现的卵裂球多核胚胎继续培养至囊胚进行囊胚移植,若有条件可进行胚胎植入前染色体非整倍体筛查,可以获得理想的妊娠结局.

