双酚类环境雌激素在水环境中的生态毒理、代谢及检测研究进展
许志刚,张小兰,刘智敏
(昆明理工大学 理学院,云南 昆明 650500)
0 引 言
双酚类化合物(Bisphenols,BPs)是一类重要的有机化工原料,广泛用于塑料瓶、食品接触涂层和药物等各类工业产品[1],但双酚类化合物具有内分泌干扰作用,可能与许多疾病有关,如乳腺癌、认知功能障碍、心血管疾病等[2].双酚A(BPA)是生产环氧树脂的关键单体,会引起类似雌性激素的生理效应,长期接触有可能会引起慢性中毒[3],导致儿童肥胖、影响记忆能力[2].目前,许多国家已经提出禁止双酚A在婴幼儿食品容器中应用的政策.因此,BPA的结构类似物作为替代物质,逐步进入工业产品的生产,如双酚F(BPF)、四溴双酚A(TBBPA)、双酚S(BPS)和双酚B(BPB)等.然而,近年来关于BPA类似物的研究结果表明,它们也可以引发BPA的雌性激素的生理效应,对动物的身体和生理方面产生重大影响,例如生长发育、生殖、免疫、神经以及代谢系统均存在毒性效应[4].
BPs以多种不同方式进入水环境,包括生产和制造过程中的直接排放和无序排放,受污染的土壤经过雨水冲刷或地表径流将BPs引入水环境,丢弃的塑料可以向水体中渗出BPs,在河水、湖水和海水等环境中均能检出BPs[1].Yamazaki等[5]的研究结果显示:BPF是日本、韩国和中国河流中的主要污染物,该化合物的浓度比相应样品中BPA的浓度高1~2个数量级.Song等[6]研究了中国30个城市的52个城市污水污泥样品中13种BPs的存在和分布情况.结果表明,TBBPA是最常见的类似物,BPS和BPF的出现频率与BPA相似.因此,环境中双酚类化合物的影响不容小觑.
由于水环境中的BPs的污染存在浓度低、毒性大、范围广和持久等特点.目前,降解双酚类化合物的方法主要有物理方法、化学方法和生物降解方法,例如,Lv等[7]采用物理方法消除BPA,利用多孔β-环糊精改性纤维素纳米纤维膜富集水中BPA,动态吸附实验表明,多孔β-环糊精改性纤维素纳米纤维膜对水中微量BPA具有良好的吸附能力.根据GB 5749—2006《饮用水卫生标准》,多孔β-环糊精改性纤维素纳米纤维膜处理水量是未经修饰纤维素膜的14.5倍,这表明对水中微量的BPA具有良好的吸附性能.Rao等[8]采用化学方法降解BPA,将FeOOH和Fe2O3共嫁接TiO2的光催化剂用于水环境中BPA的降解,通过简单控制温度来调节FeOOH和Fe2O3的组成,55 ℃ 为最佳温度,BPA的降解率达到最高;Masuda等[9]采用生物降解方法降解BPA,使用Pseudomonas monteilii strain N-502对BPA进行了降解,该菌种来自于农田、污水和池塘样品,菌株N-502在 10 d 的培养体系中完全降解了 500 mg/L 的BPA,在 2 h 的细胞系统中降解了 100 mg/L 的BPA.然而,物理和化学处理方法普遍存在诸多弊端,如处理成本高、运行费用高、操作条件苛刻和易产生二次污染等问题.与之相比,生物方法具有成本低、作用范围广和持续时间长等优点.因此,目前对BPs处理最有前景的方法是生物降解方法.本文综述了BPs类雌激素在水环境中的生态毒理效应和风险评估方法,讨论了其藻类降解和细菌降解过程和机理,总结了不同种类BPs类化合物的分析检测方法,并对BPs在水环境中的生物代谢和毒理研究进行了展望.
1 BPs的生态毒理效应与生态风险评价
1.1 生态毒理效应
1.1.1 急性毒性
以非洲爪蟾为模型进行BPs毒性暴露实验,胚胎直接暴露于BPA、BPAF、DBP或17β-雌二醇中长达 96 h.BPA(1~50 μmol/L)和BPAF(0.003~25 μmol/L)在1~6 h 内细胞分裂中断,胞质分裂减缓和细胞解离.0.013 μmol/L BPAF(LC50)致使脊髓屈曲、短体轴/尾、颅面畸形和显著死亡率.10~200 μmol/L DBP致使腹侧严重水肿.BPA、BPAF、DBP都具有与17β-雌二醇类似的毒性,其中BPAF的毒性最为突出(BPAF>BPA>雌二醇>DBP)[10].除非洲爪蟾外,BPs对其他水生生物也存在不利影响.Li等[11]研究了BPA和木质素衍生双酚对藻类、水蚤和青鳉的致死和亚致死效应,并将两者的毒性进行了比较,结果表明:LD-BP在代表性水生生物中的毒性高于BPA,并且对水生生态系统的生态风险高于BPA.此外,在体外实验中,Jiao等[12]使用猪卵母细胞为模型进行了细胞毒性的研究,结果表明,即使在卵丘细胞存在的情况下,9,9-双(4-羟基苯基)-芴抑制了卵母细胞成熟,导致猪卵母细胞纺锤体组装异常、ATP减少、ROD水平升高、早期凋亡和CGs分布紊乱,这也表明不同物种的卵母细胞会受到9,9-双(4-羟基苯基)-芴广泛的毒性侵害.
1.1.2 内分泌干扰效应
内分泌系统由内分泌腺和其分泌的激素组成,其中内分泌腺包括甲状腺、垂体、性腺等腺体.同时BPs已经是美国的环境保护局确认的内分泌干扰物[13].2017年Moreman等[14]首次借用斑马鱼胚胎和幼鱼作为模型,针对BPA、BPS、BPF和BPAF的毒性和致畸作用进行了综合分析.结果表明转基因斑马鱼的雌激素反应均为四种双酚类化合物诱导的诱导引发,雌激素显现的活性大小顺序为BPAF>BPA=BPF>BPS.Huang等[15]以斑马鱼为模型,研究了全身甲状腺激素、促甲状腺激素的含量,以及属于下丘脑-垂体-甲状腺轴的基因的转录情况.BPF暴露导致T3和T4含量的改变,T3/T4的比值增加,导致甲状腺内分泌紊乱.此外,Rosenmai等[16]借助BPB、BPE、BPF和BPS探究BPA类似物对雌激素受体和雄激素受体活性产生的影响,研究发现大多数BPA类似物具有BPA相似的效力,其中BPS的雌激素性和抗雄激素性低于BPA,但BPS对17-羟基孕酮的疗效最大.
1.1.3 发育毒性
目前许多生物模型(如斑马鱼等)的胚胎发育过程基本上呈全透明状态.因此,在评价生物早期胚胎暴露于环境污染物实验中,外部形态的描述是至关重要的.Xiang等[17]采用秀丽隐杆线虫建立了临床模型,探究了BPS对运动行为、生长、繁殖、寿命和抗氧化系统的影响.结果表明,秀丽隐杆线虫暴露于 0.01 μmol/L BPS溶液中明显地抑制了运动行为和生长,同时危害了生殖、抗氧化系统和寿命.在一些斑马鱼实验中也发现了类似的发育影响,斑马鱼胚胎分别暴露于 0.000 5、0.5和 5.0 mg/L BPF溶液中,通过形态学检查表明,BPF暴露导致脱色、心率降低、抑制自发运动、孵化抑制和脊髓变形[18].因此,BPs对水生生物存在严重的毒害作用.
1.2 生态风险评价
生态风险评价是生态系统及其组分所承受的风险,是指一定区域内,具有不确定性事故或灾害对生态系统及其组分可能产生的作用.其中关于双酚类物质的毒性评估通常是根据欧盟提出的风险商数(risk quotients,RQ)计算,进行风险等级分类.RQ计算方法是将实际检测或由模型估算出的环境暴露浓度(measured environmental concentration,MEC)与表征该物质危害程度的毒性数据(predicted no-effect concentration,PNEC)相比较,(RQ=MEC/PNEC),PNEC为毒理学终点数据与评价因子(assessment factor,AF)的比值.表1列出了五种双酚类污染物的AF值,以及对最敏感生物的预测无效应浓度[19].

表1 双酚类污染物对最敏感生物的影响评价因子和预测无效应浓度[19]Tab.1 Assessment factor and prediction of no effect concentration in bisphenols for the most sensitive organism ng/L
一般认为,当RQ在0.01~0.1时,表现为低风险;当RQ在0.1~1时,表现为中等风险;当RQ>1时,表现为高风险[20].为了严格地评价水体中BPs的潜在危害,本文采用RQ值为>0.3为风险高[21].如图1所示,许多国家对地表水中BPs进行了研究,结果表现出多地的地表水处于低风险或者中等风险,风险呈现BPF>BPA>BPS>BPAF.
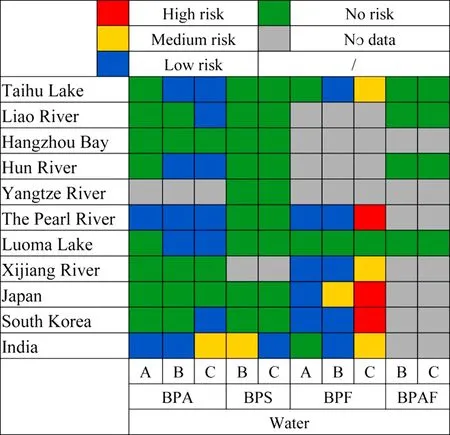
图1 日本、韩国、印度和中国地表水中BPA、BPS、BPF和BPAF的RQ[19]Fig.1 RQ of BPA,TBBPA,BPF and BPS in surface water of Japan,South Korea,India and China
在中国、日本和韩国,BPF是唯一具有高生态风险的污染物.BPF可以调节斑马鱼早期发育过程中免疫相关基因的表达,导致孵化率下降,并对内分泌系统存在干扰[19].另外,中国、日本和韩国的鱼类暴露于BPF的风险也最大,其次是BPA和BPS.因此,进一步加强BPs物质对水生生物的基础毒理研究是很有必要,尤其是多种BPs叠加风险的研究.同时探索一种更加贴合实际的生态风险评估方法是有必要的.
2 BPs的代谢研究
2.1 BPA的代谢
BPA是最常见的双酚类化合物之一,其具有一定的代表性,因此它的降解研究也是最为普遍.生物降解相比于物理和化学降解,更加环保、适用范围更广、成本更低.在水环境中生物降解主要分为微生物降解和藻类降解,其中微生物降解中又存在好氧生物降解和厌氧生物降解.好氧降解是最主要的降解途径,且目前还未发现厌氧条件下降解良好.在厌氧生物膜反应器中,BPA去除效果不明显,但是经过有氧处理,BPA去除率能达到92%[22].
目前已从水体和沉淀物分离出许多BPA的降解微生物,例如假单胞菌、鞘氨醇单胞菌、肠杆菌、链霉菌、杆状细菌等.1992年Lobos等[23]从塑料制造厂废水处理的污泥浓缩物中分离出第一株名为MV1的菌株,在BPA的降解过程中显示, 60%的碳矿化为CO2,20%与细菌细胞相关,20% 转化为可溶性有机化合物,中间体被鉴定为4-羟基苯甲酸、4-羟基苯乙酮、2,2-双(4 -羟基苯基)-1-丙醇和2,3-双(4-羟基苯基)-1,2-丙二醇.MV1来源于塑料厂的污水处理设施,可以好氧降解BPA及其他多种双酚类化合物.此外,假单胞菌、肠杆菌链霉菌和杆状细菌也具有BPA降解能力.这一系列微生物对BPA的好氧降解途径主要可以分为三种,分别为氧化骨架重排、本位取代和酚环羟基化-间位裂解(如图2所示).
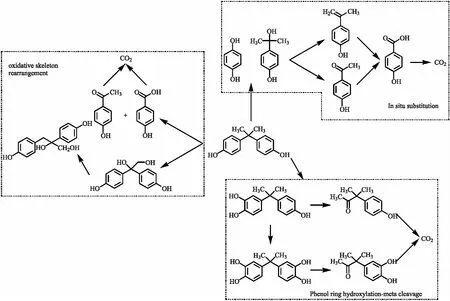
图2 双酚A的好氧代谢途径[24]Fig.2 BPA degradation pathway under aerobic condition
鞘氨醇单胞菌MV1[25],鞘氨醇单胞菌FJ-4[26]和鞘氨醇单胞菌AO1[27]等是通过氧化骨架重排降解BPA.De Santana等[28]采用桑托斯河口分离出的四株耐盐菌株对BPA进行降解研究,采用MALDI-TOF Biotyper菌株进行16S rRNA基因测序和质谱鉴定,结果表明效果最强的菌株是哈氏希瓦氏菌(Shewanella haliotis),其能够耐受 150 mg/L BPA,在 10 h 内实现生物转化 75 mg/L.该研究小组利用LC-MS对中间产物进行了定性分析,中间产物包括2,2-双(4-羟基苯基)-1-丙醇、2,3-二(4-羟基苯基)-1,2-丙二醇、4-羟苯基乙醇和4-羟基苯甲酸.
菌株鞘氨醇单胞菌TTNP3[25]和鞘氨醇单胞菌Bayram[29]巴塞尔贪铜菌JF1[30]是通过本位取代降解BPA.Vijayalakshmi等[31]通过热敏纸工业废水中分离出的铜绿假单胞菌PAb1对BPA进行降解研究,这个降解过程采用Monod、Moser和Tesier进行分批发酵降解分析,得到半饱和系数(KS)为9.947、12.46和 14.14 g/L,回归系数R2分别为0.91、0.94和0.84,铜绿假单胞菌PAb1降解BPA的比生长速率为 0.841 h-1,代谢中间体通过GC-MS鉴定为苯酚、苯乙酮、对苯二酚和对羟基苯甲酸.
酚环羟基化-间位裂解途径是最新发现的BPA代谢途径,菌株5-溴-2-硝吡啶木贼镰刀菌OMI[32]和鞘氨醇杆菌MV1[25]降解BPA是通过酚环羟基化-间位裂解.其中鞘鞍醇单胞菌MV1将BPA降解为3-羟基-2,2-二(4-羟基苯基)丙烷,3-羟基-2,2-二(4-羟基苯基)丙烷的芳香环在meta-位置被裂解,然后进一步降解为代谢产物3,3-二甲基对羟基-2-丙酮.3-羟基-2,2-二(4-羟基苯基)丙烷也可以羟基化生成3,3’-羟基-2,2-二(4-羟基苯基)丙烷[25].
此外,藻类对BPA也有很好的降解能力.Hirooka等[33]的研究发现小球藻Chlorella fusca在光照120 h后,BPA的去除率为85%.Ji等[34]研究了绿藻衣藻(Chlamydomonas Mexicana)和小球藻(C. vulgaris)对BPA的降解能力,发现两种绿藻对BPA的降解率分别为24%和23%.
2.2 TBBPA的代谢
TBBPA是目前世界产量最大和使用最广泛的溴系阻燃剂,各种水环境中均有检出TBBPA的报道.四溴双酚A具有环境持久性和生物积累性,其对鱼类和哺乳类生物都有毒性.TBBPA的厌氧降解是先脱溴生成BPA,然后BPA两个苯环之间的连接键断裂形成3,4-二羟基苯乙酮和2,5-二羟基苯甲酸.Ronen等[35]研究TBBPA在厌氧污泥中的转化,发现在厌氧段 10 d 内 157.6 μM TBBPA可完全脱溴生成 98.6 μM BPA,BPA在厌氧条件下无法进一步降解,但在好氧条件却能作为唯一碳源和能源被微生物代谢.目前有较多的TBBPA降解研究,相比之下,好氧降解对TBBPA的去除更有效.顾等[36]研究了海洋菌对TBBPA的有氧去除,在 10 d 内有氧代谢TBBPA (10 mg/L)的降解效率约为90%,随后对该菌的降解中间产物进行了分析,并提出了TBBPA的降解途径,包括β-裂解、脱溴和硝化途径(如图3所示).
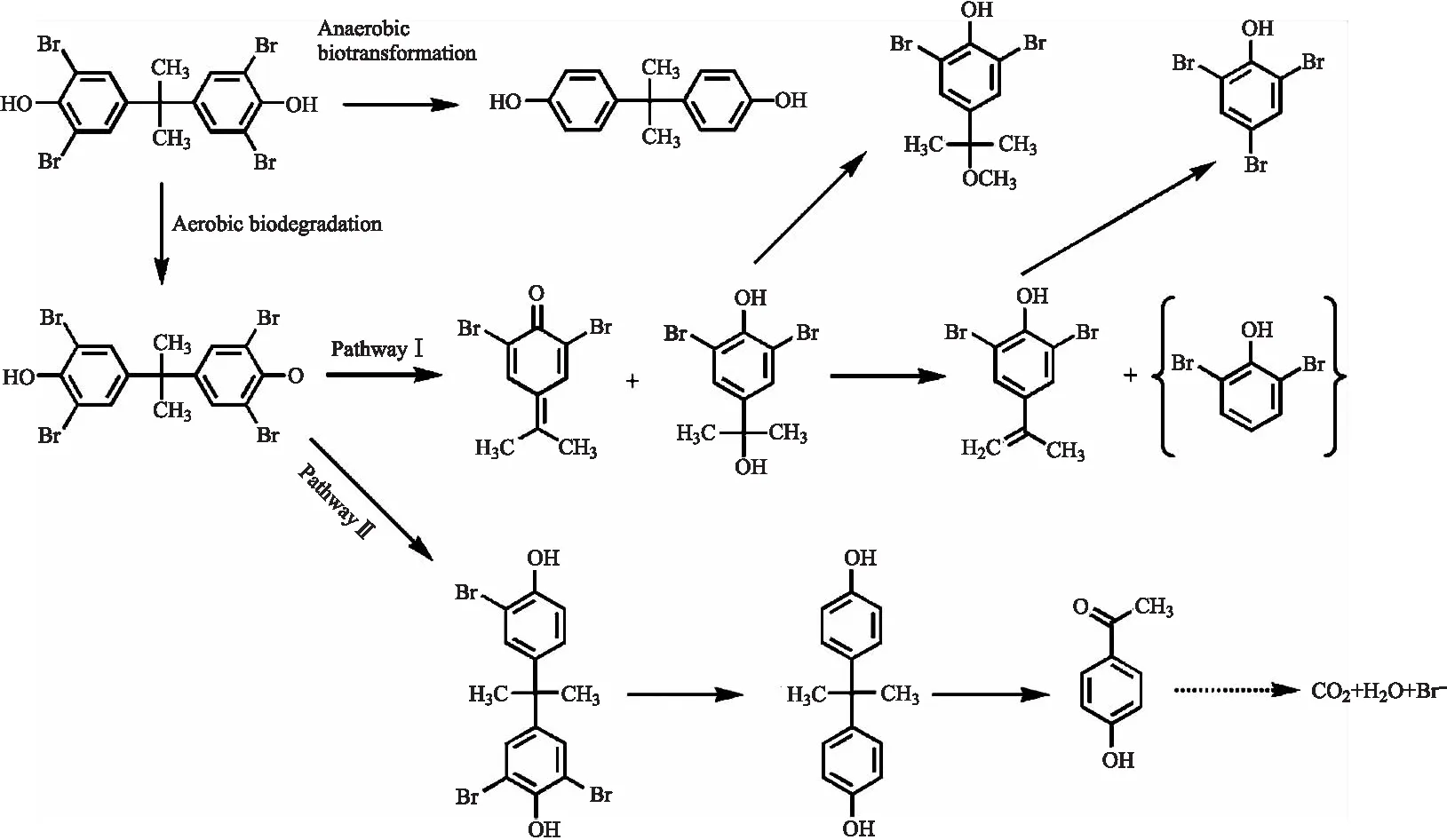
图3 Ochrobactrum sp.T好氧生物降解四溴双酚A推测降解途径[36]Fig.3 Proposed aerobic TBBPA biodegradation pathway by Ochrobactrum sp.T
2.3 BPF的代谢
因此,BPF被广泛用于工业生产.随着BPF使用量的逐年增加,其污染情况可能会日益严重,以至于BPF的检出浓度已经超过BPA.目前BPF的降解问题已经引起研究者的关注.研究结果显示,BPF与BPA具有类似的结构,但大多数BPA的降解菌株并不能对BPF进行降解反应,引起这一现象的原因可能是BPF分子中的亚甲基处未连接类似甲基的活性基,且BPF的降解途径更简单.
对于双酚F的厌氧转化,相关研究很少,厌氧降解过程主要是生成4,4′-二羟基二苯甲酮(DHBP).张等[37]发现Pseudomonas sp.HS-2厌氧转化BPF为DHBP,这与BPF好氧降解中初始转化相同,说明BPF好氧和厌氧转化都必须先转化为DHBP,再继续之后的反应.
好氧降解主要是发生Baeyer-Villiger氧化反应(如图4),主要中间产物有双(4-羟苯基)甲醇、4,4′-二羟基二苯甲酮、4-羟苯甲酸-4-羟苯酸酯、对二苯酚和对羟基苯甲酸.Inoue等[38]从河水中分离出Sphingobium yanoikuyae Strain FM-2菌株,培养 9 h 后将BPF完全降解,其中中间产物为双(4-羟基苯基)甲醇、4,4′-二羟基二苯甲酮、4-羟基苯甲酸-4-羟基苯甲酸酯、4-羟基苯甲酸酯和1,4-氢醌.
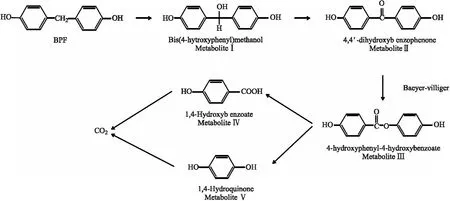
图4 BPF的好氧降解示意图[38]Fig.4 Schematic diagram of the aerobic degradation of the BPF
2.4 其他BPs的代谢
Moreira等[39]研究发现Rhodoccoccus sp. ED55对BPS有良好降解效果,结果表明:在 10 d 内BPS的去除率高达95%.Ike等[40]在好氧和厌氧的条件下分别对多个河流水样中的BPS进行了实验,结果表明BPS在有氧条件下是不可生物降解或高度耐生物降解,在厌氧条件下很容易降解,其去除率达到60%左右.Danzl等[41]采用TOC Handai (TOC,potential test)、river (sea) die-away (SDA,simulation test)方法研究了BPS在海水中的生物降解,结果表明:BPS比BPA和BPF容易在水环境中积累,即使BPS对人类健康和环境造成的风险低于BPA或BPF,其持续存在也可能成为生态负担.因此,BPS的降解菌种还需进一步研究.
Frankowski等[42]通过河水、城市和农村污水处理厂的活性污泥中微生物群降解BPA、BPS、BPF、BPAF、BPE和BPB,结果表明:BPAF的降解效率最低,这是由于双酚类化合物初级降解的不同机制造成,BPS的降解始于其环的氧化,而BPA和BPF的降解则始于其环连接基团,因此能够降解一种双酚的细菌不一定能降解其他双酚类化合物.
3 BPs及其代谢产物的检测
3.1 高效液相色谱检测法
高效液相色谱法是一种最通用的色谱分离检测方法,流动相能够在高压下快速流动,使目标分析物分离,其具有操作简便、准确度高的优点,因此普遍用于双酚类雌激素的测定(表2所示).Wang等[43]采用纤维阵列萃取-高效液相色谱法对环境水中3类EEs进行分析,回收率为80.8%~114.1%,相对标准偏差(RSD)为0.8%~12.4%,双酚类(BPs)和对羟基苯甲酸酯(PBs)的检出限均为 0.003 μg/L,邻苯二甲酸酯(PEs)的检出限均为 0.016 μg/L.Kang等[44]通过HPLC对河水中细菌降解前后的BPA含量进行了快速测定,BPA降解的半衰期为2~3 d,第10 d BPA含量均低于检测限(<0.005 mg/L).

表2 高效液相色谱法在双酚类环境雌激素样品检测中的应用Tab.2 Application of high performance liquid chromatography in the determination of bisphenol environmental estrogen samples
3.2 液相-质谱检测法
液相色谱-质谱联用技术(LC-MS)结合了色谱的高分离性和质谱的高灵敏度、高选择性,能提供相对分子质量与结构信息,为BPs及其代谢产物的鉴定提供了可靠性.Yuan等[50]采用磁性Zr-MOFs (Fe3O4@PDA@UiO-66-NH2)固相萃取-超液相色谱-质谱法对水样进行了分析,BPA、BPB、BPS、BPAP和BPAF的检出限为0.013~0.290 μg/L,湖泊水样中五种双酚的最大萃取率为78.2%.Hao等[52]建立了一种桶装水中BPA的测量方法,样品经固相萃取预处理后,采用液相色谱-质谱分析,该方法检测范围为122.9~1 190.7 ng/L,相关系数为 0.992 9,52种桶装饮用水中BPA检出率超过60%,最高检出浓度达到 898.7 ng/L,远低于国家标准的浓度限值.采用LC-MS技术分析其他双酚类环境雌激素的检测应用如表3所示.
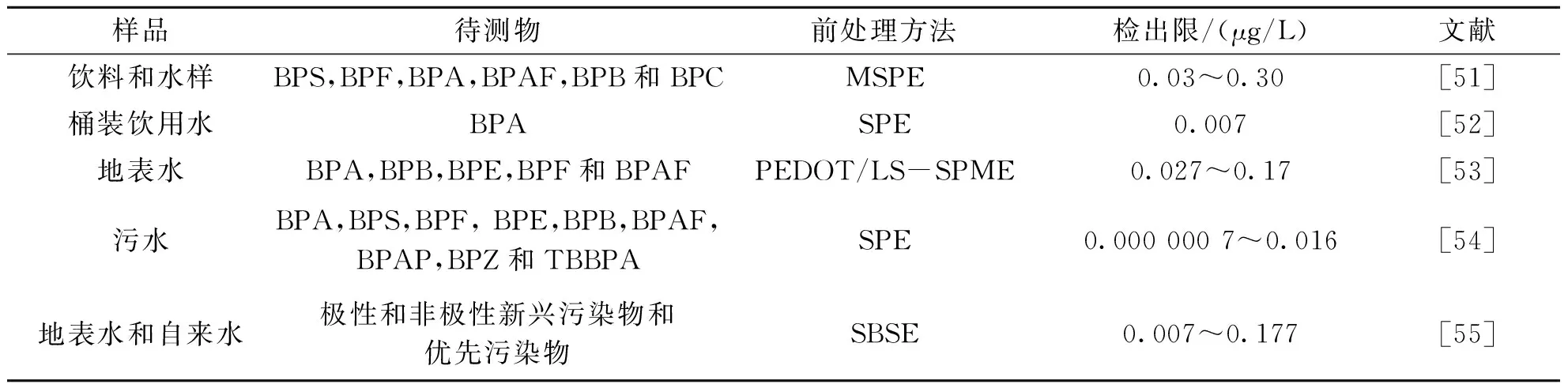
表3 LC-MS在双酚类环境雌激素样品检测中的应用Tab.3 Application of LC-MS in the determination of bisphenol environmental estrogen samples
3.3 气相色谱-质谱检测法
气相色谱-质谱联用分析法(GC-MS)也有用于双酚类化合物检测的报道.GC-MS主要用于分析检测非极性、低沸点和热稳定的化合物,对水相样品中的双酚类化合物及其代谢产物的检测具有一定的局限性.Jurek等[56]采用液体萃取法和Folch萃取法对纸样进行萃取,建立了一种利用气相色谱-串联质谱同时分析BPA、BPAF、BPB、BPE、BPF和BPS的方法.该方法具有良好的线性度(R2>0.996 5)和精度,不同双酚的检测限和定量限分别为0.23~2.70 μg/kg 和0.78~9.10 μg/kg.
3.4 其他检测方法
电化学分析方法应用较为广泛,且具有灵敏度高、选择性好、响应时间短等优点.Liu等[57]开发了一种电化学酪氨酸酶生物传感器,建立了一种BPA的检测方法,该方法对BPA具有良好的灵敏度,线性范围为0.02~10 μmol/L,最低检出限为 3.18 nmol/L.Filik等[58]采用将β-环糊精/多壁碳纳米管固定在玻碳电极(β-CD/MWCNTs/GCE)表面制备了一种测定水样品中双酚S (BPS)的伏安传感器,该电极在0.5~60 μmol/L BPS范围内具有良好的线性关系,检出限为 0.05 μmol/L.
免疫法是基于抗原与抗体结合生成沉淀所建立的分析法,有高度的特异性和易于现场快速检测等优点.该方法对样品含量及纯度要求低,能同时对多个样品进行定量或定性检测,分析成本低.Sheng等[59]利用抗BPA抗体偶联羧基功能化的NaYF4:Yb/Tm上转换纳米颗粒(UCNPs)和包覆抗原偶联羧基功能化的磁性聚苯乙烯微球(MPMs)作为捕获探针,提出了一种用于检测桶装饮用水、瓶装矿泉水和饮用水中BPA的荧光免疫分析方法,该方法的线性检测范围为0.1~500 mg/L,BPA在水样中的检出限为 0.02 mg/L,加标回收率为85.35%~108.35%.
4 结论与展望
双酚类化合物作为一类重要的化工原料,使用日益增多,但作为环境雌激素对水环境的影响也越来越严重.目前,地表水中已经广泛检出BPA、TBBPA、BPF、BPS、BPAF、BPAP、BPB、BPF、BPP和BPZ,国内外学者对BPs在水环境中的生态毒理效应、代谢和检测研究已经做了大量工作,取得了一些重要的研究进展,未来还需要在以下几个方面进行深入研究:(1)BPs在环境中存在代谢转移,而有关代谢产物的生态毒理效应研究还较少,需要对代谢转移产生的毒性进行深入的研究;(2)由于水环境中的复杂性和存在的水生生物的差异性,BPs作用于不同生物的代谢过程也是多变的,为了了解这一系列的代谢途径,还需要更多的代谢和毒理研究;(3)水环境中BPs的浓度低,经历代谢之后其浓度还会降低,且代谢产物的极性也进一步增加,痕量极性代谢产物的检测问题也需要进一步关注.

