环境变化对水稻osfh1突变体成蛋白家族表达的影响
李 斌, 李明玉, 杜志烨, 汪开顺, 肖 凯, 王 鑫, 石 杨, 姬红丽, 陈 稷, 黄 进*
(1. 成都理工大学 生态环境学院, 成都 610059; 2.四川省农业科学院 植物保护研究所, 成都 610066; 3. 四川农业大学 农学院, 成都 611130 )
成蛋白(formin)是动植物细胞形态变化的关键调控因子(Shimada et al., 2004; Xu et al., 2004)。微生物和动物成蛋白的结构通常包括FH1(formin homology 1)、FH2(formin homology 2)、FH3(formin homology 3)、GBD(GTPase binding domain)、DID(diaphanous inhibitory domain)、DAD(diaphanous auto-regulatory domain)等(Janni et al., 1998; Peter & Magdalena, 2013)。其中,FH2蛋白结构域是成蛋白行使功能的关键结构域,也是确定蛋白是否为成蛋白的主要依据(Janni et al., 1998; Peter & Magdalena, 2013)。在动植物中的研究表明,成蛋白通过聚合肌动蛋白单体影响微丝微管、细胞骨架的动态调控,从而调控动细胞分裂以及细胞的极性生长(Shimada et al., 2004; Xu et al., 2004)。近年来的研究表明,当酿酒酵母Bnip1和Bud6基因共同突变时,酵母对高温敏感;而当Bnip1单突变时,会降低酵母氮源利用率和对过氧化氢敏感性(Graziano et al., 2013; Juanes & Piatti, 2016)。这些结果表明成蛋白不仅参与细胞正常的生长发育以及其形态的变化,也有可能参与酵母抵抗外界环境胁迫。
成蛋白通过介导肌动蛋白调控细胞形态,如小立碗藓Ⅱ类成蛋白突变后,细胞肌动蛋白结构以及细胞极性生长被破坏,导致其无法伸长生长(Luis & Magdalena, 2012)。拟南芥AtFH8的过表达促进根毛细胞的伸长生长,而其突变体却则抑制了根毛的发育(Yi et al., 2005; Pei et al., 2012)。水稻OsFH5促使G-actin单体或Actin/Profilin配合物形成的肌动蛋白聚合成核,调控植物形态变化(Yang et al., 2011)。此外,OsFH15还参与调控水稻籽粒的生长发育(Sun et al., 2017)。植物的生长发育同时受到遗传因素和外界环境的共同调控,如课题组前期研究中发现,水稻成蛋白基因OsFH1可能通过调控极性生长参与水稻根毛伸长调控。在不同的培养条件下(固体培养基表面或者水培),OsFH1的突变体有不同的表型,在固体培养基的表面,即使在OsFH1基因缺失的情况下,突变体也可长出正常的根毛 (Huang et al., 2013)。由此可知,某种未知的环境因素可能通过某个信号通路可弥补OsFH1的缺陷造成的根毛极性生长,即水稻成蛋白基因OsFH1与环境因素共同调控水稻根毛的极性生长。在这个过程中,外界环境是通过改变哪些基因或者信号通路补偿OsFH1基因的缺失以实现水稻根毛的正常生长仍有待探索和验证。结构相似的蛋白之间可能存在功能代偿情况,一个基因功能丧失导致植物或动物生长发育出现的缺陷被其他基因弥补一部分,如莱氏野村菌过氧化氢酶超家族基因NrCat1和NrCat4,单独敲除一个基因会引起另一个基因表达上调,代偿其功能缺失,而当两个基因同时突变则影响莱氏野村菌的抗逆性(苏宇, 2018)。植物通过其肽配体 CLAVATA3 (CLV3) 及其受体蛋白激酶 CLAVATA1 (CLV1) 构成高度保守的负反馈信号通路维持其干细胞稳态(Cara et al., 2016)。在拟南芥中,当CLV1缺失后,其旁系同源物BARELY ANY MERISTEM (BAM)表达量增加以补偿 CLV1 的丢失造成的表型缺陷(Diss et al., 2014; Nimchuk et al., 2015)。Fatima等(2004)以及课题组未发表数据表明,水稻成蛋白家族共有17个成员,并且大部分成员的结构保守性很高,即它们在功能上可能也具有较高的相似性。因此,为探究在固体培养条件下,osfh1突变体根毛生长的恢复是否有可能是由其他水稻成蛋白基因表达产生的代偿作用来实现的,本研究在1/2 MS固体培养(固培)和1/2 MS液体培养基(液培)条件下,分别处理水稻osfh1突变体,并以野生型植株作为对照,对成蛋白家族成员的表达量进行分析。此外,通过对水稻成蛋白基因家族进行生物信息学分析,预测水稻成蛋白家族成员可能的功能,对潜在的代偿基因功能进行进一步探索。
1 材料与方法
1.1 材料
所采用的植物材料为水稻T-DNA插入突变体osfh1(PFG-1A-08638)及对应的野生型水稻。
1.2 材料处理
首先,使用0.1%咪鲜胺浸泡消毒osfh1突变体和野生型水稻种子8 h,在无光条件下进行萌芽36 h(37 ℃);挑选萌芽成功种子培养5 d后取样,条件为26 ℃恒温,16 h光照8 h无光循环处理。然后,使用70%乙醇对去皮的osfh1突变体以及野生型种子进行消毒,每次消毒1 min,重复2次。最后,将消毒后的种子加入2%有效次氯酸钠于摇床上消毒30 min(37 ℃,60 r·min-1)后进行清洗;将消毒完成后的种子置于1/2 MS (Murashige and Smoking culture medium)培养基中培养5 d后取样,条件为26 ℃恒温,16 h光照8 h无光循环处理。
1.3 根毛表型观察
利用Nikon显微镜和Imaging View显微成像系统拍摄,采用Image J测量根毛数据,利用Microsoft Office Excel进行数据计算和数理统计等。
1.4 生物信息分析
通过TAIR(https://www.arabidopsis.org/)获取拟南芥AtFHs蛋白序列,使用EnsemblPlant数据库(http://plants.ensembl.org/index.html)下载水稻蛋白组序列。以拟南芥AtFHs作为参考序列使用TBtools v1.089在水稻基因组中比对鉴定水稻成蛋白基因家族。通过MEGA.7的ClustalW算法比对氨基酸水平的保守性,并通过邻接法构建系统进化树,Bootstrap值设为1 000。成蛋白结构域以及其功能通过NCBI CDD进行分析(https://www.ncbi.nlm.nih.gov/Structure/ bwrpsb/bwrpsb.cgi)。成蛋白基序的保守性通过MEME-Suit进行分析(https://meme-suite.org/meme/)。通过Rice Genome Annotation Project (http://rice.plantbiology.msu.edu/index.shtml)获得成蛋白基因家族上游序列,通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站分析启动子顺式作用元件。在MultiLoc2(http://abi.inf.uni-tuebingen.de/Services/MultiLoc2)网站上传水稻成蛋白Loc number预测水稻成蛋白亚细胞表达;通过The Rice Annotation Project (RAP)(https://rapdb.dna.affrc.go.jp/)数据库获取水稻成蛋白染色体、氨基酸残基分子量、蛋白分子量、等电点、蛋白亲水性等相关信息;通过RiceXPro数据库(https://ricexpro.dna.affrc.go.jp/)获得水稻成蛋白组织表达(根、种子、叶、地上部分、花药、穗、雌蕊、愈伤组织)数据;制图均采用TBtools软件。
1.5 基因表达分析
采用艾德莱生物技术有限公司EASYspin plus植物RNA提取试剂盒提取固培以及液培处理的野生型和osfh1突变体根系组织总RNA。分别取1 μg的根系组织的总RNA,通过Thermo 反转录试剂盒合成第1链cDNA,并稀释20倍备用。本实验室引物全部为自行设计并交由擎科生物科技有限公司进行引物合成(表1)。qRT-PCR 扩增在德国耶拿qTOWER3G上进行,以不同处理的根部组织逆转录的cDNA 为模板,利用水稻成蛋白的特异引物对成蛋白进行扩增;并以Ubiquitin作为内参基因,正向引物为5′-ATCACGCYGGAGGTGGAGT-3′,反向引物为5′-AGGCCTTCTGGTTGTAGACG-3′。扩增的总反应体系为10 μL,其中含有2×SYBR Green 5 μL、2.5 μmol·L-1正向引物1 μL、2.5 μmol·L-1反向引物1 μL、模板cDNA 3 μL,设3次重复。扩增基因的反应循环数为40个,PCR条件:95 ℃下预变性2 min,95 ℃下变性15 s,55 ℃下退火15 s,72 ℃下延伸20 s。通过qPCR soft 4.0软件对数据进行分析。

表 1 水稻成蛋白家族qRT-PCR引物设计Table 1 qRT-PCR primer design of OsFHs in rice
2 结果与分析
2.1 水稻osfh1突变体表型
以水稻osfh1突变体以及野生型植株进行固培和液培处理观察水稻主根根毛表型发现,osfh1突变体地上部分长度比野生型短,并且在固体培养处理后野生型和突变体都有一定伸长(图1:A-B)。osfh1突变体主根较野生型长,且在固体培养处理后野生型和osfh1突变体主根根长都有一定增加(图1:C-D)。osfh1突变体主根在1/2 MS液体培养条件下无根毛,当突变体在1/2 MS固体培养基上生长时,主根根毛表型得到一定恢复且差异显著(图1:E-F)。这表明OsFH1基因参与水稻生长发育的调控,在主根根毛的生长发育中具有关键作用,并且osfh1突变体在不同环境下表型发生改变表明环境因素通过与OsFH1基因的突变共同作用改变水稻主根根毛表型。此外,液培处理下的osfh1侧根数量和长度均有增加。
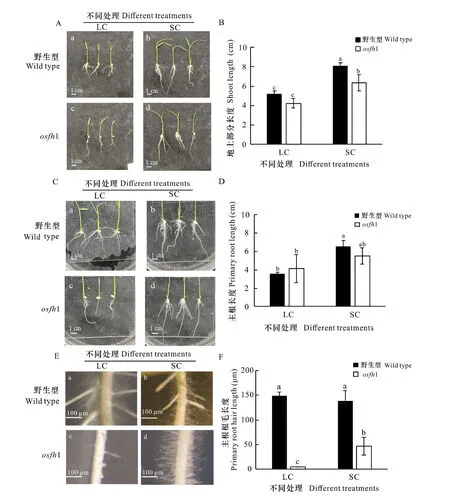
A. 野生型和osfh1突变体地上部分的表型; B. 野生型和osfh1突变体地上部分长度柱形图; C. 野生型和 osfh1 突变体根部的表型; D. 野生型和osfh1突变体主根长度柱形图; E. 野生型和osfh1突变体主根根毛的表型; F. 野生型和osfh1突变体主根根毛长度柱形图。 LC. 1/2MS液体培养; SC. 1/2MS固体培养(P<0.05)。下同。A. Phenotypes of the aerial parts of wild type and osfh1 mutants; B. Length bar graphs of aerial parts of wild type and osfh1 mutants; C. Phenotypes of wild type and osfh1 mutant roots; D. Bar graph of wild type and osfh1 mutant taproot lengths; E. Phenotypes of taproot root-hairs of wild type and osfh1 mutants; F. Length bar graphs wild type and osfh1 mutant taproot root hair lengths; LC. 1/2MS liquid culture; SC. 1/2MS solid culture (P<0.05). The same below.图 1 水稻野生型和osfh1突变体在不同处理下表型差异Fig. 1 Phenotypic difference of wild-type rice and osfh1 mutants under different treatments
2.2 qRT-PCR分析不同环境下野生型和osfh1突变体成蛋白家族基因成员表达量变化
研究认为,结构高度相似的蛋白可能行使类似的功能,而同一家族成员结构功能往往类似(苏宇, 2018;Nimchuk et al., 2015)。因此,成蛋白家族其他成员很可能在不同环境因素处理下osfh1根毛表型恢复的过程中行使一定功能。鉴于此,本研究使用qRT-PCR技术对固培液培处理下的野生型以及osfh1突变体根部的成蛋白家族成员基因表达进行分析。
从图2可以看出,当培养条件由液培到固培中时,osfh1突变体中的OsFH3、OsFH5、OsFH8、OsFH10、OsFH11、OsFH13、OsFH17表达量上调,OsFH1、OsFH2、OsFH4、OsFH12、OsFH14、OsFH16表达量下调,而OsFH6、OsFH7、OsFH9表达量无变化。其中,OsFH16在突变体中表达量大幅度下调,调,并且与野生型中OsFH16和OsFH17的表达趋势相反,因此OsFH16 、OsFH17极有可能参与环境表明其可能受到OsFH1的调控;而OsFH17大幅度上与osfh1突变体互作改变根毛表型这一过程。

A-Q分别是野生型和osfh1根部OsFHs家族的表达量。小写字母表示不同处理下野生型和osfh1之间差异显著性(P<0.05)。下同。A-Q are the expression levels of wild-type and osfh1 root OsFHs respectively. lowercases indicate the significant differences between wild-type and osfh1 under different treatments (P< 0.05). The same below.图 2 不同处理下osfh1突变体与野生型OsFHs基因家族表量变化Fig. 2 OsFHs expression changes between WT and osfh1 under different treatments
通过比较固培环境与液培环境处理下osfh1和野生型根部的OsFHs表达量,进一步分析了不同环境处理下OsFHs表达趋势,结果见图3。从图3可以看出,从水培到固培中野生型以及osfh1体内OsFH3、OsFH5、OsFH7、OsFH10、OsFH11、OsFH13、OsFH15表达趋势一致都呈上升趋势,OsFH12、OsFH14、OsFH16都呈下降趋势,而OsFH1、OsFH2、OsFH4、OsFH8、OsFH9、OsFH17表达趋势相反。其中,osfh1突变体中OsFH10、OsFH15表达量虽然大幅度增加,但其表达量趋势与野生型一致,并且表达量低于野生型。野生型中OsFH16表达量无变化,但在osfh1突变体中大幅度下降。野生型和突变体中OsFH17表达趋势相反,osfh1中OsFH17表达急剧上升,并且差异显著。

相对变化率为osfh1和野生型根部OsFHs家族在1/2 MS固体培养(SC)处理下的表达量比上1/2 MS液体培养(LC)处理下的表达量的比值。Relative change rate is the OsFHs expressions of the osfh1 mutant and wild-type root under 1/2 MS solid culture treatment (SC) compared to those under 1/2 MS liquid culture treatment (LC).图 3 1/2 MS固培和1/2 MS液培处理下OsFHs 相对表达量分析(osfh1与野生型相比较)Fig. 3 Relative expression analysis of OsFHs under 1/2 MS solid and 1/2 MS liquid treatments (compared with the expression level in wild type)
2.3 水稻成蛋白生物信息分析
qRT-PCR分析表明不同环境处理osfh1突变体导致其体内成蛋白基因家族OsFH16、OsFH17表达量被改变。基于代偿理论,我们认为OsFH16、OsFH17可能参与不同环境因素处理下osfh1表型恢复过程。通过生物信息学对水稻成蛋白的结构、功能可能受到的调控以及OsFH16和OsFH17是否可能参与根毛生长发育的调控和水稻成蛋白家族可能的功能进行了分析。
2.3.1 水稻成蛋白结构域预测、序列比对与进化分析 蛋白可能行使的功能与其蛋白的结构密切相关,因此基于课题组未发表数据鉴定的17个水稻成蛋白家族成员,分析其可能的功能,利用生物信息技术对水稻中成蛋白保守蛋白结构域以及基序进行了比较分析(图4)。本研究结果表明,水稻成蛋白家族成员高度保守,且都具有FH2关键结构域,与Fatima等(2004)关于拟南芥以及早先水稻相关成蛋白的研究结果一致。水稻成蛋白可分为两个亚家族,即第一类亚家族(OsFH1、OsFH2、OsFH4、OsFH8、OsFH9、OsFH10、OsFH11、OsFH13、OsFH14、OsFH15、OsFH16、OsFH17)和第二类亚家族(OsFH3、OsFH5、OsFH6、OsFH7、OsFH12)。在水稻第二类亚家族中,OsFH12还存在于植物领域中未阐明的结构域PTEN。此外,通过蛋白序列同源性分析也表明水稻成蛋白的FH2结构域在氨基酸水平上是保守的。与OsFH1亲缘关系最近的是OsFH15,而OsFH17与OsFH16与OsFH1亲缘关系较远。但是,保守基序分析结果显示,水稻成蛋白第一类亚家族基序保守性较高,表明第一类亚家族成员的功能可能类似,因此为了进一步分析水稻成蛋白可能存在的功能,本研究对其顺式作用元件以及亚细胞定位进行分析。
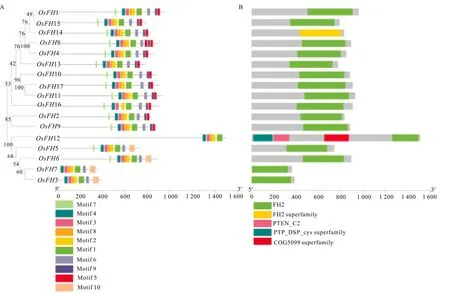
A. OsFHs家族系统进化树和保守基序分析; B. OsFHs家族蛋白分析。A. OsFHs family phylogenetic tree and conservative motif analysis; B. OsFHs family conservative protein analysis.图 4 水稻成蛋白进化树、保守蛋白结构域以及保守基序分析Fig. 4 Phylogenetic, conserved motif and protein domains analysis of OsFHs in rice
2.3.2 水稻成蛋白顺式作用元件以及亚细胞定位分析 顺式作用元件分析表明成蛋白家族成员上游存在多个响应激素以及胁迫调控相关的元件(图5)。这些成蛋白成员中除OsFH17以外,其他水稻成蛋白都可能受到茉莉酸调控,而除了OsFH3,OsFH5和OsFH6以外其他水稻成蛋白成员都有厌氧调控相关的顺式作用元件。此外OsFH1、OsFH4、OsFH5、OsFH6、OsFH8、OsFH10、OsFH12、OsFH13、OsFH15都具有干旱响应元件。OsFH1、OsFH8、OsFH9、OsFH11、OsFH13、OsFH15、OsFH16、OsFH17都具有生长素调控相关原件,表明其可能参与生长素相关调控。
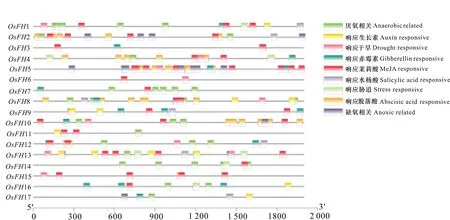
图 5 水稻成蛋白顺式作用元件预测Fig. 5 Cis-acting elements predicted in the promoter regions of OsFHs
其中,OsFH16、OsFH17、OsFH1都具有厌氧相关的顺式作用元件、赤霉素调控相关顺式作用元件以及生长素调控相关顺式作用元件。而研究表明水稻根毛生长发育受到生长素以及赤霉素调控(Maekawa et al., 2009; Wang et al., 2017)。在本实验中固培、水培环境变化也包括氧气含量的变化,但当前并无相关研究。因此,环境变化改变根毛表型可能是通过生长素以及赤霉素相关信号通路调控,而养分含量也可能作为环境因素参与调控。
亚细胞定位表明OsFH1、OsFH4、OsFH6、OsFH7、OsFH9定位于细胞液中,OsFH2定位于胞外,而OsFH4、OsFH5、OsFH6定位于质体,并且OsFH4可能在细胞核内起着一定作用。此外,OsFH8、OsFH11、OsFH12、OsFH13、OsFH14、OsFH15、OsFH16、OsFH17都定位于质膜,表明大部分水稻成蛋白可能在质膜上行使功能。并且OsFH6定位于过氧化物酶体,OsFH13定位于液泡,OsFH3定位于线粒体表明这些水稻成蛋白可能参与这些细胞器的形成。OsFH10、OsFH13定位于高尔基体,OsFH14、OsFH15定位于内质网表明其可能参与蛋白的分泌与转运(表2)。而OsFH1和OsFH16、OsFH17之间定位的差异,表明OsFH1功能可能和OsFH16、OsFH17存在一定差异。
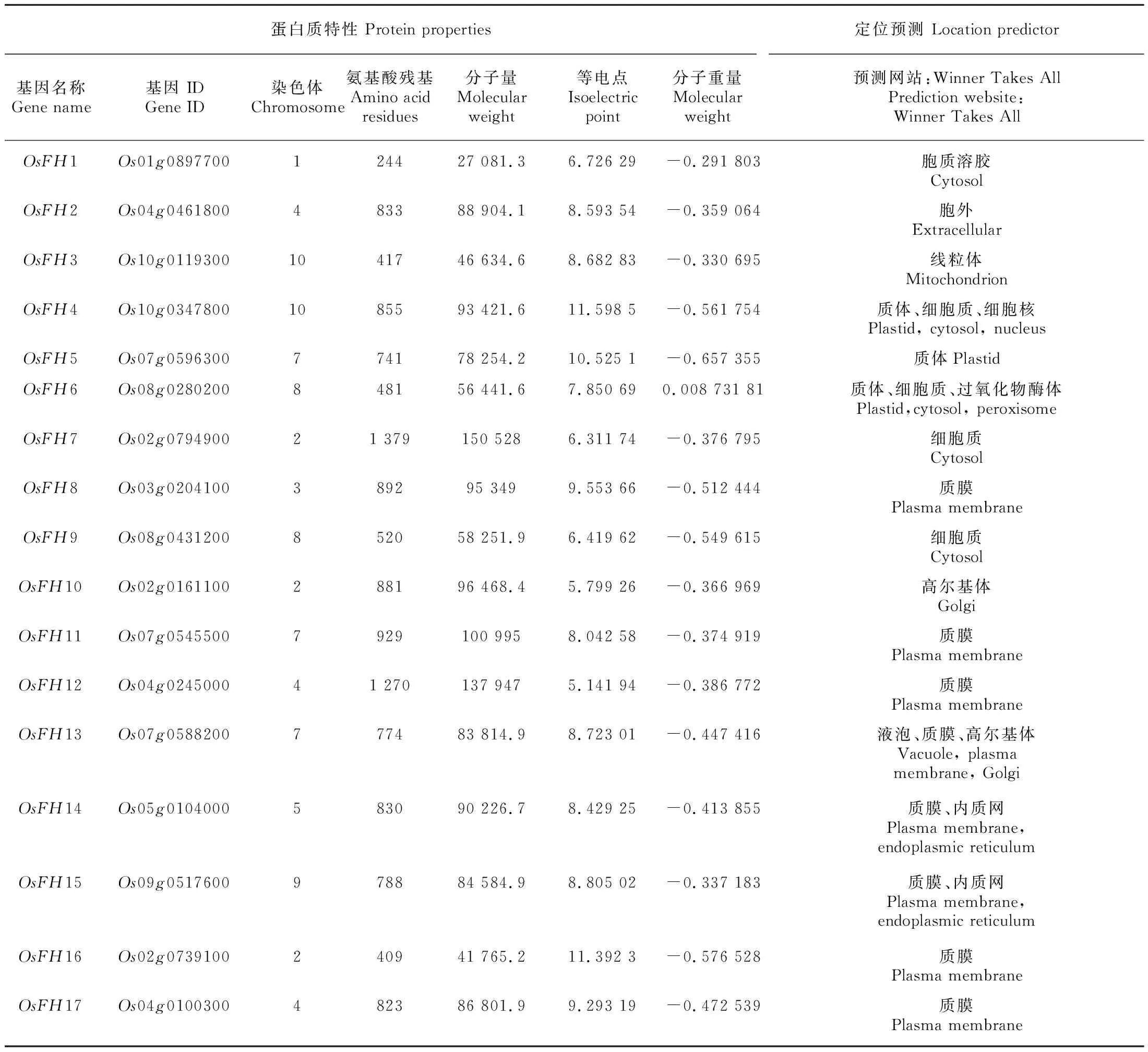
表 2 水稻成蛋白信息Table 2 Information of rice formin proteins
2.3.3 水稻组织成蛋白表达水平分析 基因在植物不同部位的表达差异可能决定了其参与的功能,通常在某个部位高表达的基因会参与特定部位的生长发育,以及对胁迫进行响应。通过RiceXPro数据库(https://ricexpro.dna.affrc.go.jp/)获取水稻成蛋白家族在不同部位表达量数据,进一步探索水稻成蛋白家族成员可能具有的功能。
水稻成蛋白组织表达分析表明,OsFH7在水稻根部高表达,OsFH13、OsFH10、OsFH2、OsFH4、OsFH8、OsFH11、OsFH16、OsFH1、OsFH5在水稻根部均有表达,而OsFH14、OsFH6、OsFH3在根部有表达,但表达量较低,表明这些成蛋白家族成员可能在根部具有一定作用。水稻OsFH1在根部的表达也与osfh1突变体表型相吻合,但根部OsFH17表达量较低(图 6)。
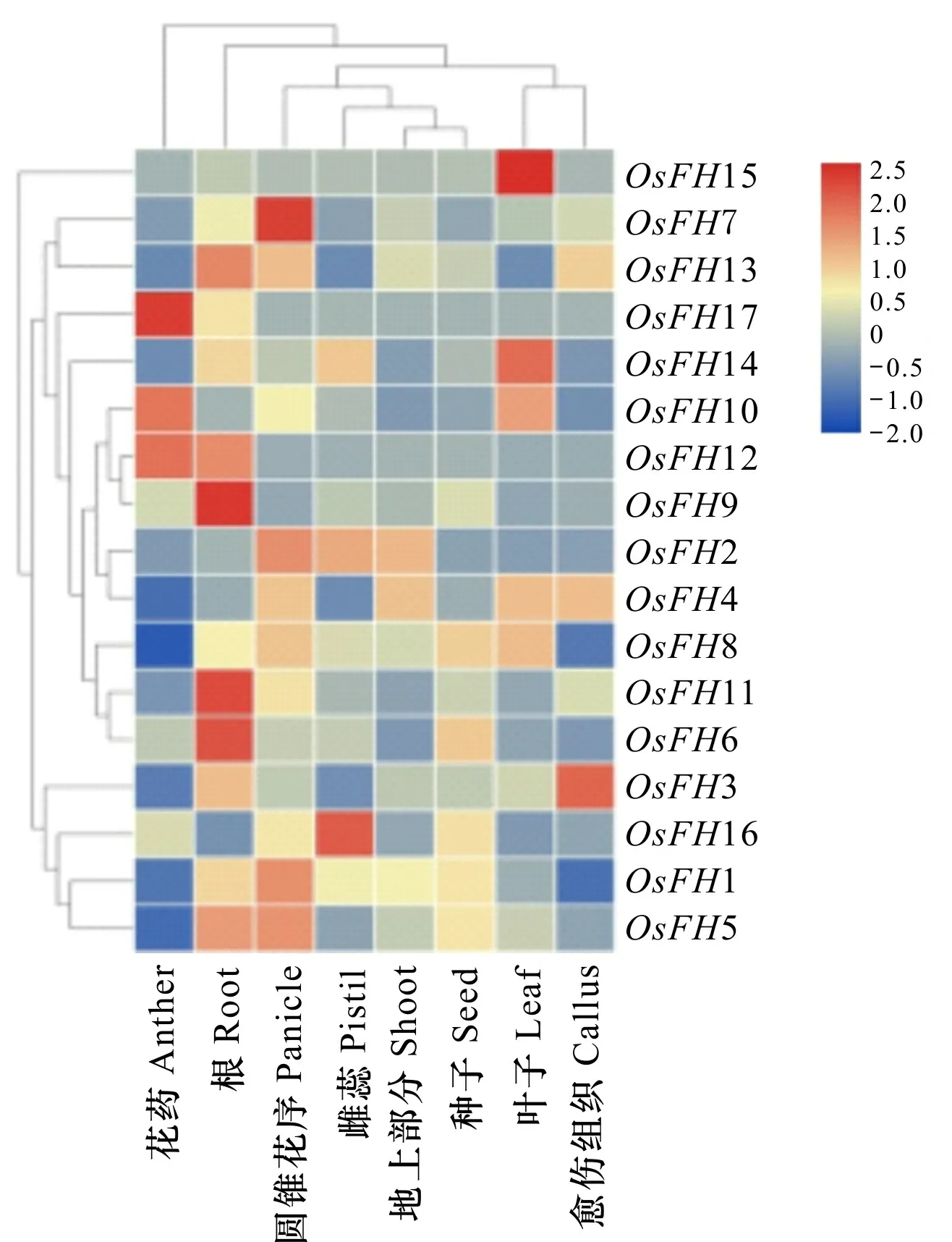
图 6 水稻成蛋白在不同组织表达水平Fig. 6 Expression pattern of OsFHs in rice
3 讨论与结论
水稻根毛作为一种根部表皮细胞的特异化结构,参与水稻获取外界养分、微生物互作、土壤固定等关键生理过程(李斌等, 2020)。Salazar-Henao等(2016)研究认为水稻根毛的伸长是通过根部表皮细胞的极性生长往外延伸,但对于其如何进行极性生长过程尚不清楚。成蛋白作为细胞极性生长的关键蛋白,在动植物中都有一定研究,如AtFH3、AtFH5调控拟南芥花粉管极性生长(Liu et al., 2018; Lan et al., 2018)。拟南芥AtFH8介导植株根毛形态发育(Pei et al., 2012)。水稻相关研究表明,osfh1突变体根毛无法进行伸长,说明OsFH1参与根毛的极性过程(Huang et al., 2013)。此外,OsFH1突变体的根毛表型缺陷在不同环境的处理下得到一定程度恢复,表明环境因素参与了osfh1介导的根毛生长发育。基于这一结论结合相关研究中所得到的结构高度相似的基因之间可能存在代偿作用的观点,探究水稻成蛋白家族是否能够在osfh1突变情况下取代其作用,从而促进根毛的生长(Diss et al., 2014; Nimchuk et al., 2015)。
qRT-PCR分析结果显示水稻成蛋白中OsFH16、OsFH17在1/2 MS固培以及1/2 MS液培处理下中表达量差异显著,表明OsFH16、OsFH17可能参与不同环境处理改变osfh1突变体根毛表型的调控。OsFH16、OsFH17都和OsFH1一样属于第一类成蛋白家族成员。亚细胞定位表明OsFH16、OsFH17都定位于细胞质膜,与相关研究一致,即酵母成蛋白定位于细胞极性生长位点,促进物质传输,并且通过聚合肌动蛋白促进细胞极性生长(Billault & Martin, 2019; Cifrova et al., 2020)。并且拟南芥研究也证实了这一点,如AtFH5通过定位在细胞膜极性生长点介导囊泡运输物质(Liu et al., 2018)。在本研究中,OsFH16、OsFH17基因上游都具有植物激素、厌氧、缺氧相关顺式作用元件,结合酵母研究表明成蛋白可能参与抵抗温度胁迫,响应过氧化氢等结果,表明OsFH16、OsFH17极有可能可能受到环境的调控从而代偿osfh1突变导致的水稻根毛无法伸长。此外,对OsFH16、OsFH17表达趋势进行分析发现OsFH17从液培到固培表达量急剧增加,表明其可能在环境处理改变osfh1突变体根毛表型的调控中具有更重要的作用,但对于其具体功能还需进一步探索。
在对水稻成蛋白的结构分析时发现水稻第二类成蛋白OsFH12与其他成员不同,只有一个PTEN结构域。PTEN是在人类癌症调控的关键基因,PTEN主要通过去磷酸化参与细胞调控,并且通过结合膜磷脂定位于细胞质膜(van Gpac et al., 2012)。OsFH12蛋白具有的PTEN结构域表明其可能通过该结构定位在细胞膜行使功能,并且该结果与亚细胞分析结果一致。因此,OsFH12极有可能在细胞质膜上行使功能。结合OsFH12的组织表达数据,OsFH12极有可能参与花药的生长发育。此外,本研究发现1/2 MS液培处理下的osfh1突变体中侧根数量以及长度多于野生型,表明OsFH1可能参与侧根的起始。拟南芥研究也表明其侧根的起始依赖于细胞骨架以及肌动蛋白介导的中柱鞘细胞不对称细胞分裂,从而形成侧根原基促使侧根生长(Barro et al., 2019; Fernandez et al., 2020)。成蛋白主要功能是调控肌动蛋白以及细胞骨架,因此水稻OsFH1也可能通过调控细胞骨架和肌动蛋白促进水稻侧根起始。
目前,关于水稻成蛋白在水稻根毛发育过程中行使功能的研究较少,并且对于不同环境通过调控哪些基因促进osfh1突变体恢复表型也尚未阐明。本研究通过分析不同环境处理下osfh1突变体成蛋白基因家族的表达量、利用生物信息手段对水稻成蛋白基因家族成员进行系统性分析,结果表明在固体表面培养时,环境变化可能通过OsFH16、OsFH17等基因的改变以补偿OsFH1基因的缺陷,进而确保植物可产生正常的根毛。但是,该论断仍需要利用突变体,过表达体及遗传学方法的进一步验证。

