韭菜化感物质草莓酸对香蕉枯萎病菌的影响
滕秋梅, 杨晓东, 何成新, 徐广平,3, 黄玉清, 张德楠, 孙英杰, 牟海飞, 韦绍龙, 周龙武*
(1. 广西喀斯特植物保育与恢复生态学重点实验室, 广西壮族自治区中国科学院 广西植物研究所, 广西 桂林 541006; 2. 汕尾市陆河县陆河中学, 广东 汕尾 516700; 3. 中国地质科学院岩溶地质研究所, 自然资源部/广西岩溶动力学重点实验室, 广西 桂林 541004; 4. 南宁师范大学, 广西北部湾环境演变与资源利用教育部重点实验室, 南宁 530001; 5. 广西壮族自治区农业科学院 生物技术研究所, 南宁 530007 )
香蕉(Musanana)是世界产量第二大的水果,也是消费量最大的水果之一,目前香蕉枯萎病给全球香蕉产业带来了较大威胁。香蕉枯萎病又称巴拿马病,其病原菌主要由尖孢镰刀菌古巴专化型4 号生理小种(Fusariumoxysporumf. sp.cubense,Foc4)侵染引起,是一种土传病害(Ploetz,2015)。香蕉枯萎病主要发生在非洲、南美洲和澳大利亚以及我国东南沿海各省等香蕉主产区,生产中尚未有高效的防控措施。目前,防控香蕉枯萎病比较有效的措施是培育抗病品种以及轮作和套种等(孙雪丽等,2018)。近年来的研究发现,利用植物间的化感作用可以有效防控由真菌侵染等引起的土传病害,且对生态环境不会造成二次污染(Gomes et al.,2017),如西芹的挥发物通过化感作用能有效抑制黄瓜枯萎病(陈磊等,2012),蚕豆和小麦间种对蚕豆枯萎病有抑制作用(杨智仙等,2014),番茄-分蘖洋葱伴生栽培能显著控制灰霉病的发生(吴瑕等,2015)。上述研究成果说明利用化感作用防治病害的发生切实可行,但有关化感作用抗性机理的研究不多(高晓敏等,2014)。
香蕉枯萎病初侵染主要来源于病株残体和带菌土壤,由于Foc4的厚垣孢子可在土壤中存活数十年,所以抑制土壤中Foc4的孢子萌发和菌丝生长可能是限制Foc4在香蕉根系生长和减少香蕉枯萎病发生的有效措施。前人研究发现,韭菜(Alliumtuberosum)(柳红娟等,2015)、番茄(Solanumlycopersicum)(刘范等,2018)、竹荪(Dictyophoraindusiata)(范田娜等,2019)、木薯(Manihotesculenta)(廉法卓等,2019)等提取物(含有化感物质)能够抑制Foc4菌丝生长且可降低香蕉枯萎病的发生,但这些研究仅从某个方面(如抑制菌丝生长)进行了研究,缺乏较系统的研究。为探明化感作用防控香蕉枯萎病的作用机制,本研究在前期韭菜挥发物防治香蕉枯萎病的基础上,选择韭菜代谢产物2-甲基-2-戊烯醛的衍生物草莓酸(strawberry acid,SA)化感物质(Zhang et al.,2013),通过SA与Foc4的互作实验,系统地研究化感物质SA对Foc4菌丝生长、香蕉枯萎病病情指数以及对香蕉土壤微生物数量和土壤酶活性的影响,以期为香蕉枯萎病的防治提供理论参考。
1 材料与方法
1.1 供试材料
香蕉幼苗为桂蕉1号(AAA),由广西壮族自治区农业科学院生物技术研究所提供;Foc4为前期实验室筛选和保存的菌株;供试的SA(分子式为C6H10O2,无色透明液体,含量99%)购自长沙凯美香精香料有限公司;红壤土、营养土和泥炭土按照体积1∶2∶2的比例混合后作为供试土壤。土壤理化性质:有机质23.51 g·kg-1,全氮1.12 g·kg-1,全磷0.66 g·kg-1,全钾15.94 g·kg-1,速效氮179.14 mg·kg-1,速效磷21.48 mg·kg-1,速效钾176.39 mg·kg-1,pH 6.44。
1.2 方法
1.2.1 SA对Foc4菌丝生长的影响 配置 SA 母液:用移液枪吸取 1 mL 纯的 SA 溶液至容量瓶,用灭菌水定容到 100 mL,该溶液中的 SA 浓度为10 mL·L-1。先用移液枪分别吸取该浓度SA溶液0、1.2、2.4、3.6、4.8 mL于5 mL灭菌的离心管中,再分别加入一定量的灭菌水使其总体积为5 mL,混匀后分别加到75 mL PDA培养基中 (温度降低至50 ℃左右时),使其充分混匀后配成含有SA浓度为0、150、300、450、600 μL·L-1(分别记为CK、A、B、C、D)的培养基。分装到培养皿,冷却凝固后接种一块直径为0.5 cm的Foc4菌饼,置于28 ℃的培养箱中培养7 d,每天测量每个平板上Foc4菌落直径,用以评价SA对Foc4菌丝的生长抑制情况,每个处理设置5个重复。参考漆艳香等(2007)的计算公式:
菌落扩展直径(cm)=菌落直径平均值-0.5;
菌丝生长抑制率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100。
1.2.2 液体培养条件下 SA 对 Foc4 菌丝重量和分生孢子产量的影响 用打孔器在培养一周后的Foc4平板上打取直径为0.5 cm的Foc4菌饼,放入150 mL的PDA培养基(马铃薯 200 g,葡萄糖 20 g,琼脂 18 g,水 1 000 mL),每瓶加入 9 mL SA,使每瓶培养基中含 SA的浓度为 600 μL·L-1,不加SA的培养基作为对照处理,每个处理5次重复。在 28 ℃、140 r·min-1条件下振荡培养,培养7 d后过滤,收集菌丝和滤液,用血球计数板计算Foc4的分生孢子产量。
1.2.3 不同 pH 条件下 SA 对 Foc4 菌丝生长的影响 分别用2 moL·L-1的 HCl 和 NaOH 溶液将 PDA 培养基的 pH 调成 5、7、9,分别加入不同浓度SA使培养基中的SA 浓度分别为 0、300、 600 μL·L-1,后面步骤同1.2.1。
1.2.4 香蕉枯萎病病情指数的变化 先在250 mL的三角瓶中加入100 mL的Czapek培养基,再加入5个直径为0.5 cm的Foc4菌块,28 ℃、140 r·min-1下振荡培养,12 d后过滤菌丝,滤液经8 000 r·min-1离心20 min后,取上清液无菌过滤,滤液即为粗毒素滤液。以添加SA(SA终浓度为600 μL·L-1)的粗毒素滤液为处理组,并以未添加SA的粗毒素滤液为对照。参考漆艳香等(2007)的方法,将香蕉幼苗去除根主轴下部2/3和须根,放入装有30 mL粗毒素滤液的培养瓶中,香蕉苗基部有2 cm浸入液体中,每个瓶子放置1株,每个处理5个重复,室温下培养。每隔24 h观察1次处理的香蕉症状,调查其发病情况。参考许文耀等(2004)的方法,将病情级别划分为6个等级:0 级,无表现任何症状;1 级,叶片出现失水状,轻微萎蔫,顶端4片叶中有1~2片叶开始变褐;3 级,叶片萎蔫明显,顶端4片叶中有3~4片叶开始变褐;5 级,叶片呈现暗绿色或暗褐色萎蔫;7 级,部分叶片枯死;9 级,全株枯死。香蕉枯萎病的计算公式病情指数:
病情指数= ∑(各级病株数 × 各级代表值)/(总株数 × 最高级代表值) × 100%。
1.2.5 土壤微生物数量及土壤酶活性的变化特征 实验于人工气候箱中进行。Foc4培养2周后,用移液枪吸取无菌水反复吹打菌落,用灭菌后的玻璃涂布棒刮取Foc4的孢子到无菌水中,过滤后,利用微型旋涡混合仪,使孢子悬液振荡均匀,用血球计数板,统计菌液的孢子含量,无菌水稀释后使孢子悬液浓度约为106cfu·mL-1。香蕉苗(展叶期,有5片叶)种植于装有1.25 kg自然土(无枯萎病原菌)的小花盆中,香蕉枯萎病病原菌采用灌根接菌法。实验设计有4个处理,分别为CK、A、B、C。每个处理均先加入50 mL Foc4菌液,再加入100 mL浓度分别为0、300、600、1 200 μL·L-1的SA溶液,其中CK的0 μL·L-1以无菌水代替。施加SA的处理每隔4 d加1次。每个处理10盆香蕉苗,接菌半个月后采集对照及各处理的土壤并检测其土壤微生物数量、Foc4数量变化和土壤酶活性。
土壤细菌、真菌和放线菌的数量通过稀释平板计数法(许光辉和郑洪元,1986)测定,采用的培养基分别为牛肉膏蛋白胨、改良高氏1号(苯酚500 mg·L-1)和马丁(Martin)孟加拉红-链霉素(链霉素30 mg·L-1)。计算方法(细菌 106个·g-1干土,真菌 104个·g-1干土,放线菌103个·g-1干土):每克样品的菌数=同一稀释度几次重复的菌落平均数×稀释倍数。Foc4数量的测定参考Smith等(2008)的方法,采用Komada 改良培养基,即培养基成分为KH2PO41 g、Fe-Na-EDTA 0.01 g、MgSO4·7H2O 0.5 g、L-天门冬酰胺 2 g、D-半乳糖 15 g 、灭菌水1 L;抗生素类为二硝基苯 1 g、牛胆盐 0.5 g、四硼酸钠 1 g、硫酸链霉素 0.3 g。培养基调节 pH 至(3.8±0.2)。以cfu·g-1干土表示。
土壤脲酶、蔗糖酶、酸性磷酸酶、蛋白酶、过氧化氢酶、多酚氧化酶活性的测定分别用苯酚钠比色法、3,5-二硝基水杨酸比色法、磷酸苯二钠比色法、茚三酮比色法、高锰酸钾滴定法、碘量滴定法(关松荫,1986)。
1.3 数据分析
使用 Excel 2016 软件进行统计分析;用 SPSS 22.0 软件进行单因素方差分析(one-way ANOVA),并用最小显著差数法(least significant difference,LSD)进行差异显著性检验(显著性水平设定为α<0.05,极显著水平设定为α<0.01),采用皮尔森(Pearson)法进行相关性分析。
2 结果与分析
2.1 不同培养浓度下SA对Foc4菌丝生长的影响
0(CK)、150、300、450、600 μL·L-1的SA在平板上处理7 d的结果如图1和表1所示。经CK、A、B和C处理后,随着时间的延长,同一浓度培养下Foc4的菌落直径均显著增加(P< 0.05),第5天相比第3天分别增加了41.43%、48.20%、58.36%、57.14%;在同一培养时间,随着SA浓度的增加,Foc4菌落直径则显著减小(P< 0.05),第5天时,B、C比A分别减少了49.15%、70.89%。经D处理后,Foc4菌落直径随着时间的增加均没有变化,说明该SA浓度对香蕉枯萎病病原菌的菌落具有显著抑制效果。
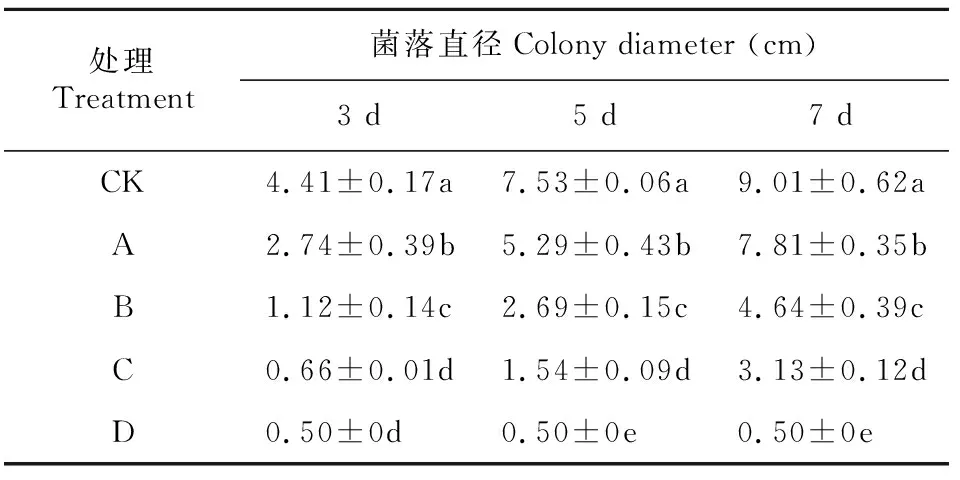
表 1 添加不同浓度SA后Foc4菌落生长的变化Table 1 Changes of Foc4 colony growth after adding different concentrations of SA
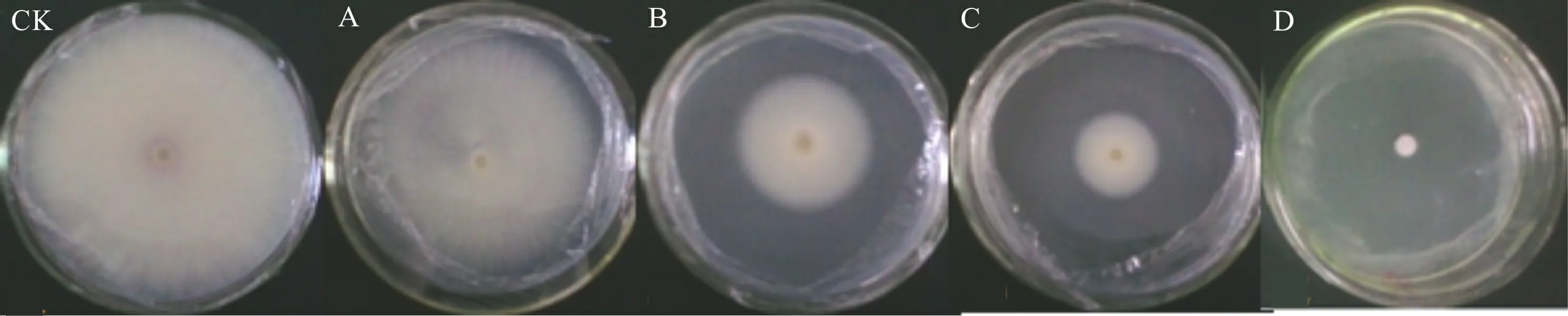
CK为对照, 未添加SA; A、B、C、D代表SA浓度分别为150、300、450、600 μL·L-1。下同。CK is the control without SA; A, B, C and D represent SA concentrations of 150, 300, 450, 600 μL·L-1, respectively. The same below. 图 1 不同浓度SA对Foc4菌落生长的影响 (7 d)Fig. 1 Effects of different concentrations of SA on colony growth of Foc4 (7 d)
2.2 不同培养时间下SA对Foc4的抑制作用
由图2可知,随着SA处理浓度的升高,抑制作用越大;第3天时,B、C、D处理的抑制率比A处理分别提高了49.21%、55.47%、57.29%,且彼此间的差异均显著(P< 0.05);第1天至第7天,SA浓度为D时,抑制率始终达100%。另外,随着培养时间延长,SA对Foc4的抑制作用随之减弱,且呈现SA浓度越小抑制率降低越快的趋势,第7天时,浓度为A、B、C处理的抑制率比第4天分别下降了62.22%、32.41%、23.15%。结果表明,SA对Foc4的抑菌效果随着培养时间延长而减弱。
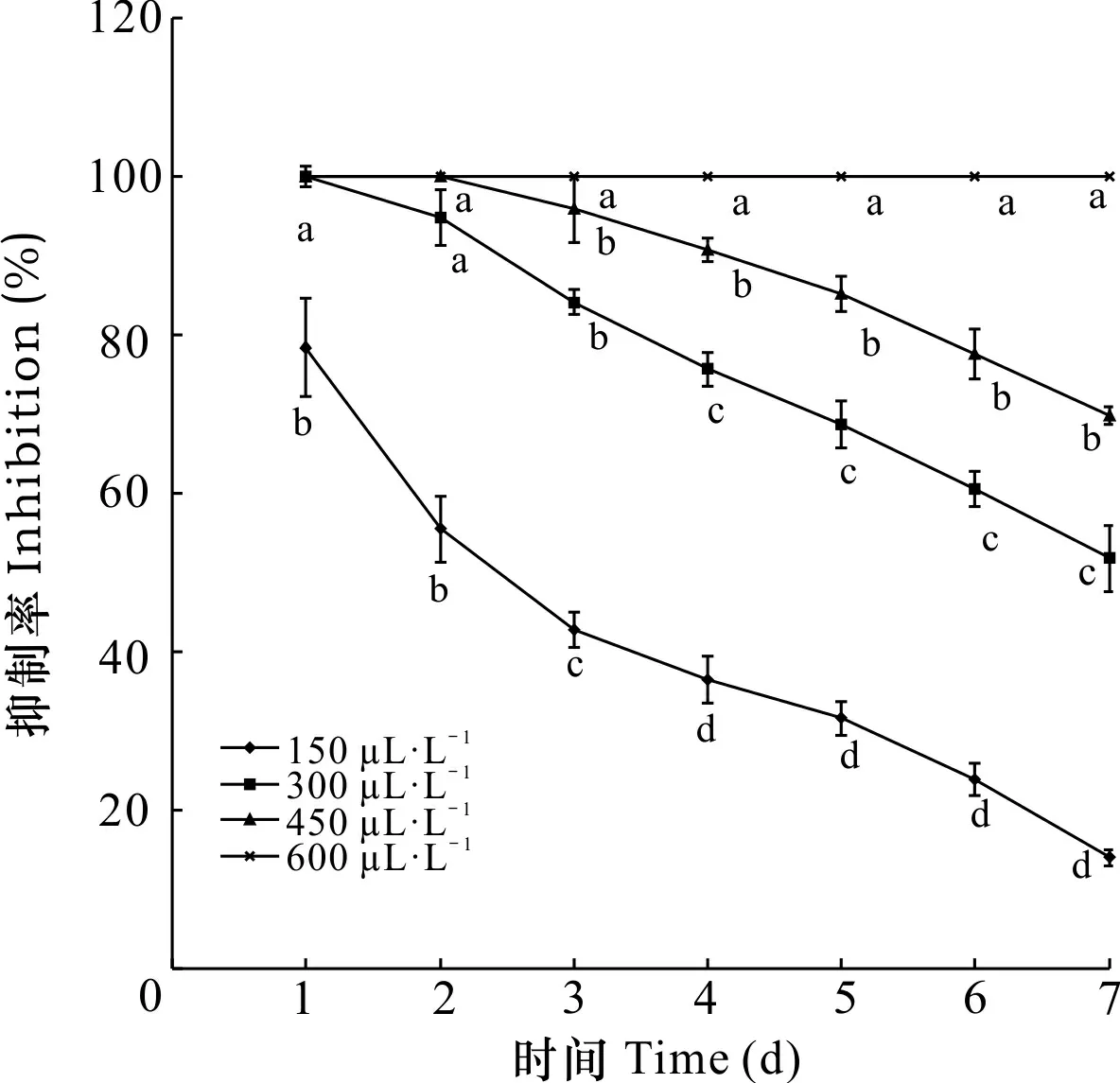
不同小写字母表示各处理在0.05 水平差异显著。下同。Different small letters indicate significant differences among treatments at 0.05 level. The same below.图 2 添加不同浓度SA后Foc4抑制率随时间的变化Fig. 2 Changes of the inhibition rate of Foc4 with time after adding different concentrations of SA
2.3 液体培养条件下, SA 对 Foc4 菌丝和孢子产量的影响
由表2可知,液体培养条件下添加浓度为600 μL·L-1的SA后,Foc4孢子数量显著低于CK处理(相差470 多倍),菌丝干重仅为0.008 g,说明产生的菌丝和孢子极少,表明添加SA显著抑制了菌丝干重增加和减少了培养基中孢子数量。

表 2 SA对Foc4孢子数量和菌丝干重的影响Table 2 Effects of SA on spore number and hypha dry weight of Foc4
2.4 不同pH条件下SA对Foc4菌丝生长的影响
由图3可知,当浓度为300 μL·L-1、pH为5时,SA对Foc4菌丝的抑制作用最大,随着pH增加,抑制率显著下降,pH为9时的抑菌率较pH为5时低52.68%;当SA浓度为600 μL·L-1、pH为5时的抑制率也是最高(100%)。可见,pH不同,SA对Foc4菌丝的抑菌率有差异,且偏酸性环境下(pH为5)的抑制作用更强。
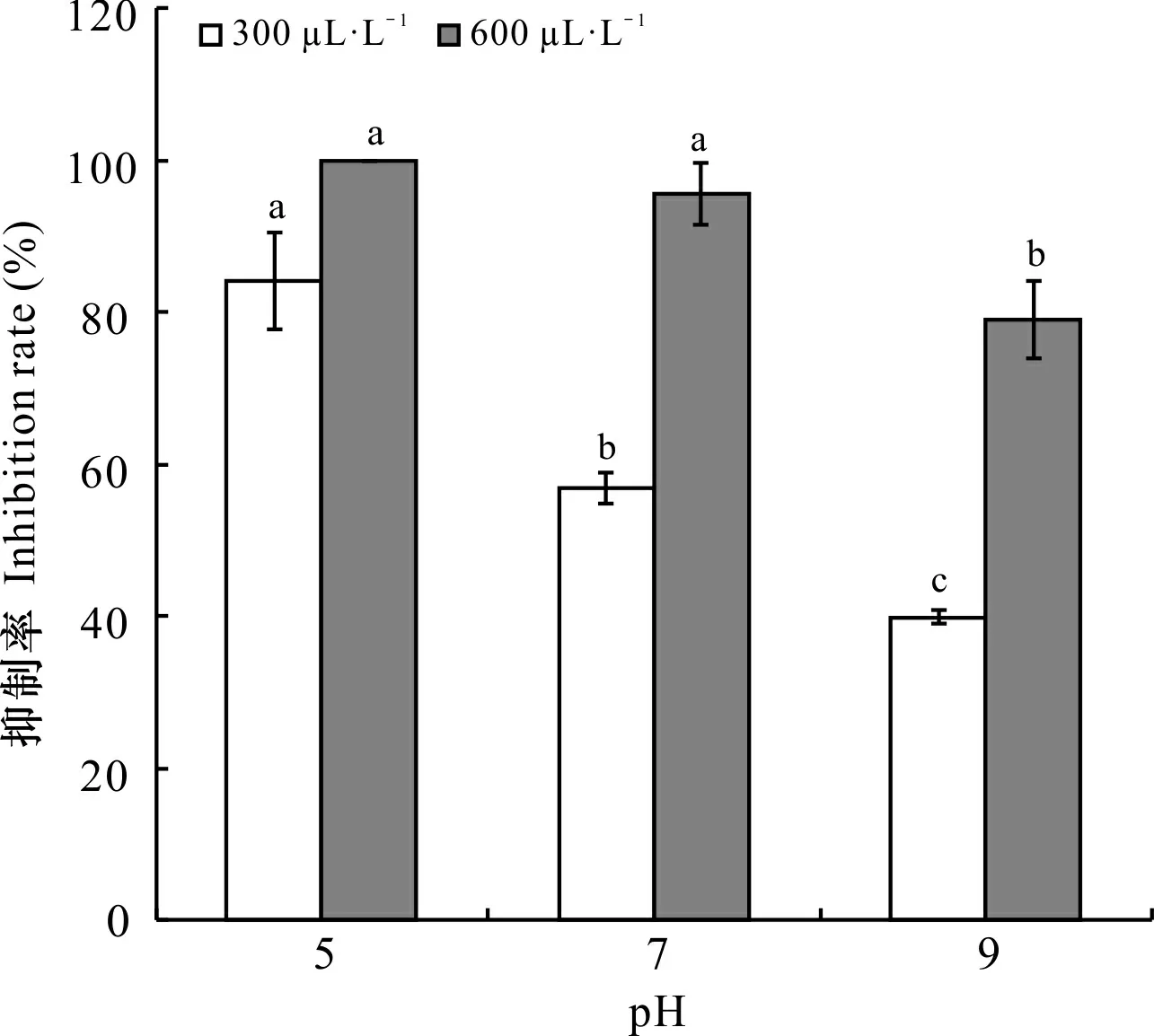
图 3 不同pH梯度下添加SA后Foc4抑制率的变化 Fig. 3 Changes of the inhibition rate of Foc4 after adding SA under different pH conditions
2.5 SA对香蕉幼苗枯萎病病情指数的影响
随着时间的延长,香蕉苗发病程度越来越严重(图4:A),病情指数逐渐增加(图4:B)。粗毒素处理48 h时,CK的香蕉幼苗叶片出现萎蔫,而添加SA的叶片表现正常(不萎蔫),病情指数相比CK降低了60%;处理96 h时,CK植株呈现严重萎蔫,植株部分叶片有些枯死,其病情趋向严重,添加SA的病情指数显著低于CK;处理96 h和120 h较CK分别降低了41.67%、40.00%,说明添加SA在很大程度上降低了香蕉苗枯萎病的发病程度。
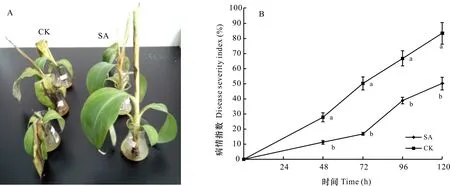
图 4 添加SA对香蕉苗生长(A)和香蕉枯萎病病情指数(B)的影响Fig. 4 Effects of SA addition on seedling growth (A) and wilt disease severity index (B) of banana
2.6 SA对土壤微生物数量的影响
不同类型微生物数量随SA浓度的变化表现有差异性(图5:H、I、J、K、L)。微生物总量(图5:H)在SA浓度为A和B时显著升高,C处理显著低于CK、A、B处理。细菌数量(图5:I)的表现规律与微生物总量相似,与CK相比,细菌数量在SA浓度为A时显著升高,B浓度达最大值(与CK相比增幅为20.67%),C浓度显著降低,不同浓度间的差异均显著(P<0.05)。真菌数量(图5:J)在A浓度时降低且与CK无显著差异,B浓度显著升高并达最大值(增幅为19.34%),C浓度显著低于其他浓度,不同浓度间的差异均显著(P<0.05)。放线菌数量(图5:K)则为A浓度时显著升高(相比CK增幅为42.58%),B、C浓度降低且均显著低于CK。总体而言,细菌、真菌和放线菌的数量在C浓度处理时均显著低于CK,这表明高浓度的SA对土壤微生物有抑制作用,显著降低了土壤微生物的数量。

CK为对照,未添加SA; 横坐标中的A、B、C代表SA浓度分别为300、600、1 200μL·L-1。下同。CK was the control without SA; A, B and C represent SA concentrations of 300, 600 and 1 200 μL·L-1, respectively. The same below. 图 5 添加不同浓度SA后土壤微生物数量的响应 Fig. 5 Responses of soil microbial quantities after adding different concentrations of SA
SA施到 Foc4-香蕉-土壤系统的结果表明,Foc4 数量(图5:L)随SA浓度的增加而降低,当浓度达到C(1 200 μL·L-1) 时,Foc4 的数量显著低于CK(降低了26.75%),说明SA能抑制Foc4数量的增加,且高浓度的抑制作用更显著。
2.7 SA对土壤酶活性的影响
添加SA后,土壤酶活性差异明显(图6:M、N、O、P、Q、R)。土壤脲酶、蔗糖酶、酸性磷酸酶和蛋白酶活性的变化特征一致,在A、B处理均趋于增大,特别是在B处理时均显著提高(P<0.05),较CK分别提高了18.52%、36.20%、28.57%、14.29%,C处理时均显著降低。而在A处理时土壤过氧化氢酶和多酚氧化酶活性也是趋于增大,但在B处理时均趋于减小,C处理时均显著降低;与CK相比C处理的降幅分别为41.88%、54.82%(P<0.05)。总体上,土壤酶活性随SA浓度的变化呈现“低促进高抑制”现象。
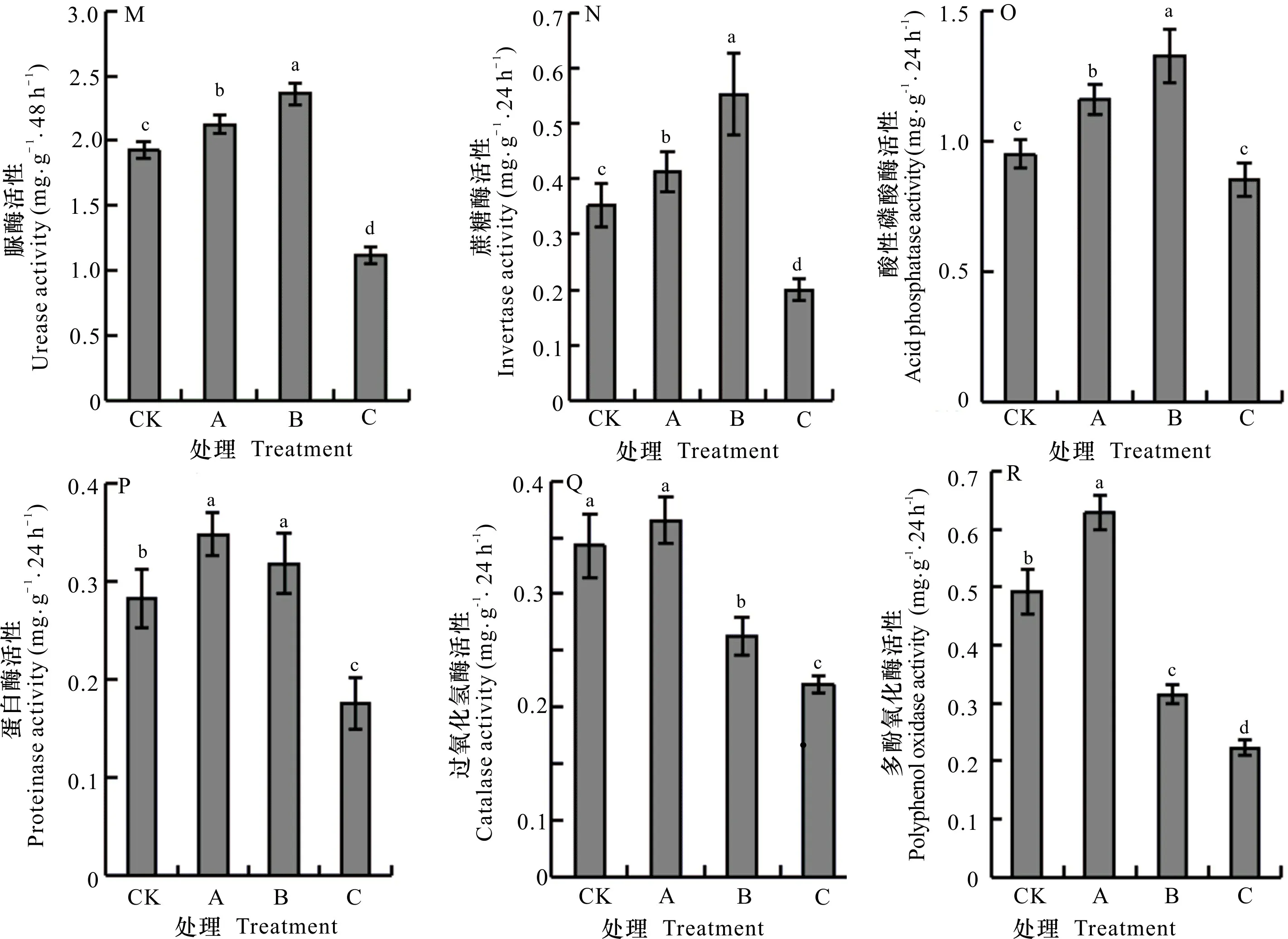
图 6 添加不同浓度SA后土壤酶活性的响应Fig. 6 Responses of soil enzyme activities after adding different concentrations of SA
2.8 土壤微生物数量与土壤酶活性的相关性分析
在接有Foc4的条件下,添加SA后香蕉土壤微生物数量和土壤酶活性之间存在一定的相关性(表3)。土壤微生物总量与细菌、真菌数量极显著正相关(P<0.01),与蔗糖酶、酸性磷酸酶、多酚氧化酶显著正相关(P<0.05)。土壤细菌数量与蔗糖酶、酸性磷酸酶、多酚氧化酶显著正相关(P<0.05),土壤真菌与放线菌显著负相关(P<0.05),与蔗糖酶、多酚氧化酶活性显著正相关(P<0.05);土壤放线菌与蔗糖酶、蛋白酶、多酚氧化酶活性呈显著正相关(P<0.05)。蔗糖酶与脲酶显著正相关(P<0.05),与酸性磷酸酶、多酚氧化酶均显著负相关(P<0.05);过氧化氢酶与多酚氧化酶显著负相关(P<0.05)。这说明土壤微生物数量和土壤酶活性互相影响,同时受土壤微生物区系的双重调节。Foc4的数量与细菌、放线菌、微生物总量具有显著的正相关关系,而与其他6种酶和真菌的相关性均不显著。
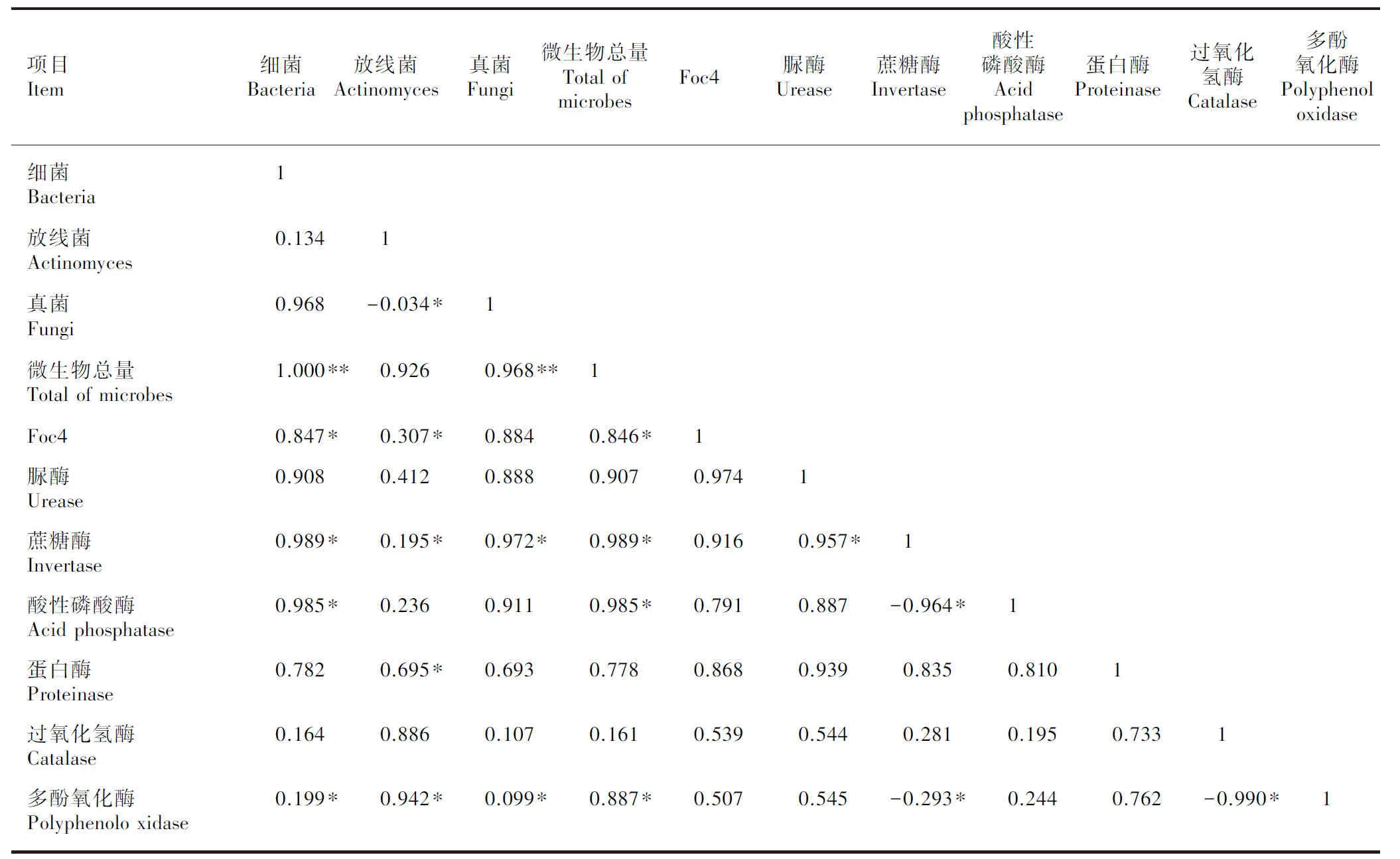
表 3 土壤微生物数量与土壤酶活性的相关性分析Table 3 Correlation analysis of soil microorganism quantities and soil enzyme activities
3 讨论与结论
在水稻根系分泌物中,提取的化感物质对西瓜枯萎病菌的孢子形成和萌发有抑制作用(Ren et al.,2016),2,4-二叔丁基苯酚显著抑制了番茄叶霉病菌的孢子萌发和菌丝生长(周宝利等,2013)。本研究与上述研究结果类似。以前期实验中从韭菜浸提液分离出的化感物质2-甲基-2-戊烯醛的衍生物——SA为材料(Zhang et al.,2013),本研究结果表明,SA显著抑制了Foc4菌丝的生长。相对于对照,添加SA显著抑制了Foc4菌丝生长、减小了Foc4的菌落直径以及降低了孢子数量,说明SA对Foc4菌丝的生长具有一定的化感效应,SA可能会通过抑制Foc4菌丝的生长以及抑制孢子数量的增加,从而降低香蕉枯萎病的发生或蔓延。本研究结果与Zhang等(2013)和黄永红等(2011)的实验结果一致,进一步证明韭菜化感物质对香蕉枯萎病的发生有一定的抑制效果。SA对Foc4菌丝具有一定的化感作用,主要原因可能是韭菜属于葱属植物,其提取物中含有硫化合物对Foc4具有抑制作用(杨静美等,2014;Gao et al.,2020)。
化感物质对病原菌的生长具有一定的抑制作用,所有化感物质的抑制作用几乎都与其浓度有关(Kravchenko et al.,2003)。不同浓度SA对Foc4的抑制情况有所差异,Foc4菌落生长直径随着SA浓度的增加显著减小,抑制率随之升高,液体培养条件下SA浓度为600 μL·L-1的孢子数量显著低于对照,说明SA与培养基混合后浓度在600 μL·L-1及以上时对Foc4抑制效果最佳,而在小于此浓度条件下,随着实验时间的持续,SA对Foc4的抑制效果则趋于减弱。此结果一方面与病原菌Foc4本身的生物学特性有关,SA达不到抑制Foc4的临界浓度时,会对低浓度SA产生抗性。这说明一定浓度的韭菜粗提液能抑制Foc4菌丝生长和孢子数量增加,从而提高抑制率。这可能是草莓酸有效防控香蕉枯萎病的主要机制。
另外,林妃等(2010)的研究表明,pH为5时最适合Foc4的菌丝生长,在pH 6~7 时菌丝生长最快。本研究得出,不同pH条件下,SA对Foc4菌丝的抑制作用有差异,当pH为5时抑制率显著大于pH为7和9,说明pH为5时(即酸性环境下)SA对Foc4菌丝的抑制作用可能更好。在实际农田中,香蕉连作会引起土壤向偏酸性发展,也说明Foc4趋向于生长在偏酸环境。通过添加外源化感物质SA来抑制香蕉枯萎病的发生,且SA还是在最适合Foc4菌丝生长的条件下发挥较好的作用,这在香蕉枯萎病防治上具有良好的应用前景。本研究不足的是,对菌丝生长所设置的SA最终浓度只到600 μL·L-1,结合后面的实验结果,应当在600 μL·L-1后加大最大浓度;只分析了SA对Foc4菌落和菌丝以及孢子数量影响的结果,应增加孢子萌发实验结果的分析,以使得研究内容更全面;SA是韭菜挥发物中的衍生物,在环境中易挥发(Zhang et al.,2013),这就导致SA对Foc4的实验结果可能会随着时间的变化而改变。为了提高SA的有效性,在今后的生产实践中可以提高 SA微胶囊化等技术,更有利于香蕉枯萎病的防控。
土壤微生物数量与土传病害的发生和防控具有紧密的联系(廖咏梅等,2020)。袁秀梅等(2016)研究发现,蚕豆根系化感物显著影响土壤微生物数量和种群结构变化。本研究结果表明,在接有Foc4的条件下,与未添加化感物质SA相比,添加SA后香蕉苗土壤细菌、真菌和放线菌的数量发生显著变化,说明化感物SA对香蕉土壤微生物区系具有化感效应。SA浓度不同,对不同种土壤微生物的数量影响有差异。其中,放线菌仅在300 μL·L-1处理时显著升高,其他处理时显著低于对照,而细菌和真菌均在600 μL·L-1处理时显著升高,1 200 μL·L-1处理时显著降低。另外,Foc4的数量随SA浓度的升高呈降低的趋势。此结果与杨阳等(2013)的研究结果类似,其研究表明分蘖洋葱根系化感物增加了黄瓜土壤细菌和放线菌的数量,降低了尖镰孢菌的数量;韩春梅等(2010)也得出类似的结论。本研究中,可能是SA进入土壤后,对某些微生物具有趋化作用,可能会增加一些有益菌群的数量,减少有害菌群的数量,同时打破土壤微生物区系的平衡,削弱或消除有益菌群和有害菌群的拮抗作用,从而影响植物或植物与微生物的互作,这可能是减缓香蕉枯萎病发生的原因之一,与Zhou等(2012)结论相一致。因此,进一步研究不同浓度SA对香蕉土壤生物地球化学元素性质所造成的影响,将有助于进一步深入探讨SA化感作用的机理。
SA对土壤酶活性存在一定的影响,与土壤微生物数量相似,添加不同浓度SA,香蕉土壤酶活性随SA浓度的增加而增加,达到一定浓度后下降,表现出“低促高抑”的现象。与本研究结果相似,刘苹等(2013)的研究指出,花生所生长的土壤酶活性在低含量脂肪酸处理时增加,高含量脂肪酸处理时显著降低。而与韩春梅等(2010)、Chen等(2009)研究结果有所不同,其指出土壤酶活性随香草醛等化感物质含量的增加而增强。不同研究结果有差异,一方面可能是所研究的化感物质和植物不同;另一方面可能是土壤微生物是土壤酶的主要来源之一,其数量的变化可能会影响土壤酶活性的改变。本研究中,当SA浓度为1 200 μL·L-1处理时,土壤细菌、真菌和放线菌的数量均显著降低,这与该浓度下土壤酶活性显著较低相一致,且相关性分析得出,土壤细菌、真菌和放线菌数量均与蔗糖酶、多酚氧化酶等显著正相关,此研究结果与韩春梅等(2012)相似。因此,本研究中化感物质SA对香蕉土壤的微生物和酶活性均表现出浓度效应的差异性,对香蕉生长的影响可能是直接作用和间接作用的综合表现。
化感物质与抗病特性存在相关性。大葱根系分泌物能提高土壤微生物的多样性,对枯萎病菌的萌发有明显的抑制作用(时伟等,2014)。李蕾等(2009)的研究表明,除 1%浓度处理外,其余浓度的西芹鲜根乙醇浸提液对黄瓜枯萎病菌均有显著或极显著的化感抑制作用。茄子黄萎病抗病性与根际土壤中放线菌数量,与土壤多酚氧化酶、过氧化氢酶、脲酶、蛋白酶活性正相关(周宝利等,2013)。与前人的研究结果略有不同,本研究中Foc4数量随SA浓度的升高呈降低的趋势,到1 200 μL·L-1时显著降低,可见该浓度SA对 Foc4 具有显著抑制效果;相关性分析表明,添加SA后土壤Foc4数量与细菌、放线菌、微生物总量具有显著相关性,与土壤酶和真菌的相关性未达到显著水平。土壤微生物是土壤酶的主要来源(关松荫,1986),土壤微生物数量的改变是香蕉枯萎病发病后的重要特征(邓晓等,2011)。而香蕉枯萎病是由Foc4侵染香蕉维管束引起的系统性病害,因为Foc4土壤种群密度与病害危害程度呈正相关(吴小燕等,2013),所以Foc4数量的减少在很大程度上说明香蕉枯萎病的发病率在降低,表明化感物质SA在一定程度上对香蕉枯萎病具有抑制作用。另外,本研究在平板实验中,当SA浓度为600 μL·L-1时对Foc4的菌丝生长具有显著的抑制效果,而在盆栽实验中,与对照相比,当用该浓度处理时,土壤微生物总量、细菌、真菌数量也显著升高,而Foc4的数量无显著差异,当SA浓度为1 200 μL·L-1时,Foc4的数量显著降低。可见,SA对Foc4的影响因基质不同而有差异。可能是当SA进入土壤后,其影响着土壤微生物组分,潜在地影响着植物以及植物和微生物的相互作用 (韩春梅等,2012);因为培养基和土壤是两个不同的基质,所以SA发挥显著效果所需要的量一般会有不同。本研究先在培养基上找出SA发挥作用的最适浓度,再应用于土壤(同时选择了最适浓度的0.5倍和2倍一起实验),进一步探索施用SA对土壤生态环境的影响。本研究结果发现,600 μL·L-1以上高浓度时,SA对Foc4的菌丝生长和数量具有一定的抑制作用,且对土壤微生物和酶活性也产生了影响,但培养基上得出的SA对Foc4影响的最适浓度与在土壤中的不完全一致。因此,SA对Foc4在大田实验下的最佳表现还需进一步开展研究。
综上所述,韭菜挥发性物质SA能有效地抑制香蕉枯萎病病原菌的生长,抵御病原菌侵染寄主,且被施用后容易降解,对环境危害小,为人们开发杀菌剂提供了新思路。该物质对 Foc4 病原菌有显著的抑制作用,改善了香蕉土壤生态系统环境,可以为农药领域提供一种高效且无毒的天然源杀菌剂。为了能够在生产上大面积推广使用SA技术防控香蕉枯萎病,SA对土壤生物活性起重要调控作用的最适浓度及其分子作用机理等需要进一步的研究。
在纯培养条件和有植物存在的条件下,SA对Foc4均具有化感效应,说明化感物质SA在香蕉枯萎病病害的防治上具有一定的应用潜力。SA浓度的增加对Foc4菌丝的生长抑制作用随之增加,偏酸性条件下SA对Foc4的抑制效果更好,添加 SA后显著降低了香蕉幼苗的病情指数。600 μL·L-1及以上浓度的SA对Foc4的菌丝生长具有良好的抑制效果,SA浓度达到1 200 μL·L-1时,土壤中Foc4的数量显著降低,土壤微生物数量的增加和酶活性的提高也被显著抑制了。由于土壤环境是十分复杂的缓冲系统,且SA容易挥发、在土壤中的半衰期短,因此同样浓度抑制 Foc4 的效果在室内培养基纯培养的条件下比实际土壤中的作用效果要显著。
致谢感谢广西特聘专家Azim Mallik对本研究实验设计的悉心指导!

