水稻OsMBF1c基因的克隆及表达分析
石 杨, 汪梦婷, 靳雨璠, 于 月, 张 旭, 李家豪, 姜 南, 李 斌, 陈 稷, 黄 进*
(1. 成都理工大学 生态环境学院, 成都 610059; 2. 四川农业大学 农学院, 成都 611130 )
近年来,随着人类工业化进程的加快,干旱、盐碱化和重金属污染问题对农作物的威胁日趋严重,其中重金属污染问题尤为突出。镉(Cd)作为一种重金属,因其具有高毒性,即使在土壤中以较低浓度存在,也会对农作物产生极强的毒性,进而影响农作物的生长发育(Toppi & Gabbrielli, 1999;金枫等,2010)。水稻(Oryzasativa)作为我国重要的粮食作物,其生长发育受到土壤中Cd的严重危害(Zheng et al., 2021)。因此,如何改善重金属对水稻生长发育的影响并解决籽粒中的重金属积累问题,对未来培育耐Cd水稻品种以及保障粮食生产安全均具有重要意义。目前,水稻应对重金属胁迫的转录调控机制的研究较为广泛,相关转录因子、转录调节因子等因对抗胁迫功能基因的表达起着重要调节作用,而一直成为研究热点。多蛋白桥联因子1(multi protein bridging factor 1, MBF1)是植物处于生物及非生物胁迫应答过程中起重要作用的转录调节因子之一(Wang et al., 2017)。MBF1蛋白主要由N端“MBF1”结构域和C端“α-螺旋-β-转角-α-螺旋”结构域组成,可通过桥联转录激活因子和TBP(TATA-Binding Protein)调控多种信号转导途径并激活多种防御因子,最终提高植物在逆境胁迫下的耐受性(Millership et al., 2004;Jaimes-Miranda & Chvez Montes, 2020)。拟南芥(Arabidopsisthaliana)、小麦(Triticumaestivum)、菊花(Chrysanthemummorifolium)中MBF1基因家族可参与调控植物应对热、氧化和干旱等胁迫反应(Suzuki et al., 2005;Pamela et al., 2010; Zhao et al., 2019)。然而,MBF1是否参与植物应对重金属胁迫通路,以及是否可能缓解植物因重金属而引起氧化损伤等的相关研究却少见报道。此外,对MBF1的研究也仅仅局限于拟南芥、小麦等物种,在水稻中潜在的功能和作用机制的研究则较少,而水稻作为我国重要的粮食作物之一,研究其抗逆机理显得尤为重要。
本研究对水稻中的MBF1基因家族进行了生物信息学分析,并以水稻为材料,利用PCR方法克隆得到了OsMBF1c(LOC_Os06g39240)基因的全长编码区(coding sequence, CDS)。在此基础上,采用实时荧光定量PCR(RT-qPCR)方法对Cd处理下不同水稻组织中OsMBF1c的相对表达量进行分析。旨在探究以下问题:(1)水稻MBF1蛋白家族亲缘进化关系、理化性质以及结构特征;(2)水稻MBF1基因家族成员在Cd胁迫下的表达变化情况;(3)水稻MBF1在缓解Cd危害过程中的潜在功能。本研究结果将为耐镉水稻品种的培育提供潜在的基因资源,同时为进一步解析该基因在水稻中应对重金属胁迫的调控机制奠定基础。
1 材料与方法
1.1 材料
水稻种子于4 ℃保存。选健康种子放入适量无菌水中,30 ℃催芽48 h。将发芽种子置于1/2 MS液体培养基中,30 ℃温室进行光照16 h/黑暗8 h交替培养,5 d后选取同一生长阶段的幼苗进行CdCl2(100 μmol·L-1)胁迫处理,经时间梯度(1、6、12 h)处理后采集地上部分和根部,并将其立即用液氮进行速冻,置于-80 ℃冰箱保存备用。
1.2 OsMBF1c基因克隆
1.2.1 总RNA提取和cDNA第一链合成 将CdCl2处理的水稻组织参照Aidlab公司的EASYspin Plus植物RNA快速提取试剂盒的说明书进行总RNA的提取。提取成功后,取1 000 ng RNA,参照ThermoFisher公司Thermo Scientific RevertAid First Strand cDNA Synthesis Kit反转录试剂盒说明书进行反转录合成cDNA第一链。
1.2.2OsMBF1c基因的克隆和测序 根据水稻OsMBF1c基因的CDS序列设计引物OsMBF1c-F/OsMBF1c-R(表1)。以水稻cDNA为模板,使用擎科生物科技有限公司的金牌Mix酶对OsMBF1c基因的CDS序列进行PCR扩增。利用胶回收试剂盒对PCR产物进行胶回收后,利用Vazyme公司的ClonExpress Ⅱ One Step Cloning Kit试剂盒连入pGADT7载体,并转化至大肠杆菌DH5α菌株。挑取阳性克隆培养后,使用天根生化科技公司的质粒小提试剂盒提取重组质粒并进行酶切验证,送往擎科生物科技有限公司(成都)进行测序。
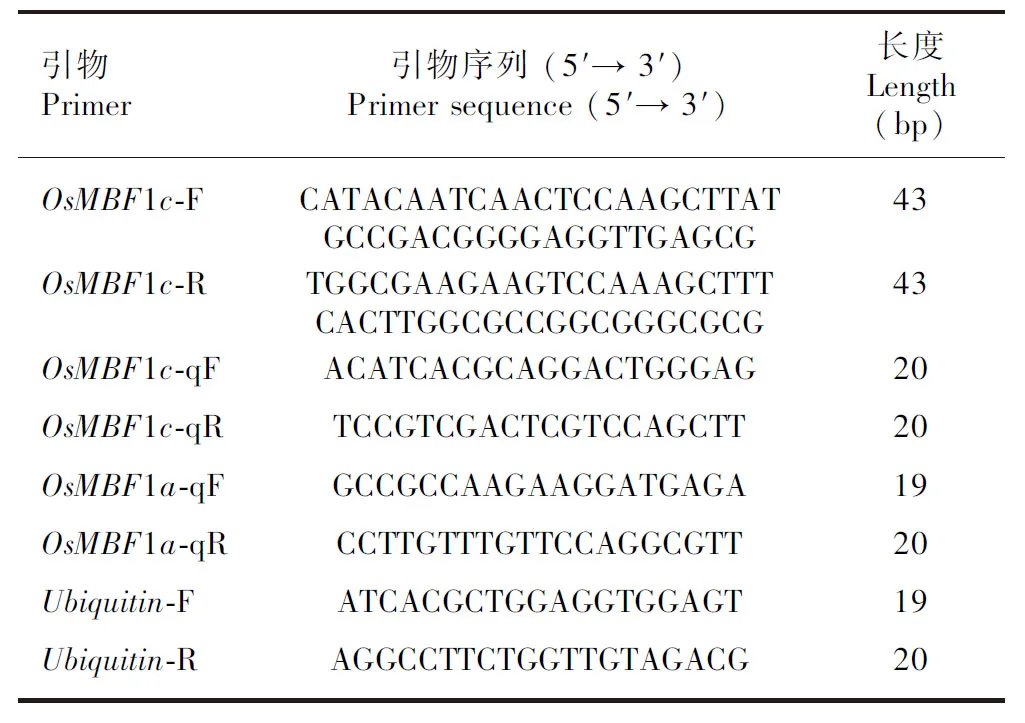
表 1 基因克隆和表达检测引物Table 1 Primers used for gene cloning and expression analysis
1.3 生物信息学分析
从EnsemblPlants数据库(http://plants.ensembl.org/info/data/ftp/index.html)获得水稻、大麦(Hordeumvulgare)、二粒小麦(Triticumdicocoides)、高粱(Sorghumbicolor)、玉米(Zeamays)的整个基因组以及gff3注释文件,使用TBtools软件将整个基因组序列翻译为蛋白序列。利用OsMBF1c的氨基酸序列在Pfam(http://pfam.xfam.org/)网站中对其编码蛋白的结构域进行分析,目的基因编码蛋白中含有与非生物胁迫相关的MBF1结构域,先通过Pfam网站得到其HMM结构模型,再通过TBtools软件的Simple HMM Search功能对水稻、二粒小麦、大麦、高粱和玉米的蛋白序列进行分析,筛选确定所选物种中的MBF1基因家族成员。
利用在线ProtParam工具(https://web.expasy.org/protscale/)对OsMBF1c的基本理化性质进行预测和分析;利用SCOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)对蛋白质二级结构进行预测;利用水稻OsMBF1c基因编号在Rice Genome Annotation Project网站 (http://rice.plantbiology.msu.edu/index.shtml)获得启动子序列;通过The PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子顺式作用元件,采用TBtools软件制图。
利用在线Multalin软件(http://multalin.toulouse.inra.fr/multalin/)对其编码的氨基酸序列进行比对;利用MEGA 7.0软件中Neighbor-joining法构建系统进化树;通过The MEME Suite网站(https://meme-suite.org/meme/index.html)对其同源蛋白进行motif分析,利用TBtools中的Visualize Motif Pattern功能对多序列的motif元件进行分析与美化。用STRING数据库(https://string-db.org/cgi/input.pl),对水稻OsMBF1c蛋白的相互作用进行预测。
1.4 OsMBF1c基因表达分析
以稀释20倍的Cd处理水稻的cDNA为模板。采用德国耶拿分析仪器股份公司(Analytikjena)qTOWER3G 实时荧光定量基因扩增仪检测OsMBF1c、OsMBF1a基因的表达量。反应试剂采用Aidlab的2 × Sybr Green qPCR Mix。扩增体系为cDNA 3 μL、SYBR Green 5 μL、引物(2.5 μmol·L-1)各1 μL。反应程序:95 ℃预变性2 min; 95 ℃变性15 s, 55 ℃复性15 s, 72 ℃延伸20 s, 72 ℃后延伸3 min,40个循环。以水稻Ubiquitin作为内参基因。每个样品均设置3次重复,以2-ΔΔCt方法分析定量数据。
1.5 数据统计分析
使用Graphpad软件对不同处理Cd浓度、不同处理时间、不同组织的数据进行差异显著性分析。
2 结果与分析
2.1 水稻OsMBF1c基因结构分析及CDS全长克隆
利用Rice Genome Annotation Project(http://rice.plantbiology.msu.edu/)查询得知,基因OsMBF1c位于水稻全基因组的第六号染色体上,OsMBF1c基因CDS长度为468 bp(图1:A)。基于水稻cDNA文库,使用OsMBF1c-F/OsMBF1c-R引物扩增OsMBF1c基因CDS片段, 获得大小约为468 bp的目的基因,其共编码155个氨基酸。用1.5%琼脂糖凝胶电泳检测获得的PCR产物,条带大小(图1:B)与基因组数据库结果一致。
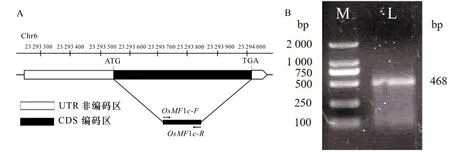
A. OsMBF1c 基因结构分析; B. OsMBF1c CDS扩增产物; M. DL2 000 标记; L. OsMBF1c基因CDS扩增产物。A. Structure analysis of OsMBF1c gene; B. OsMBF1c CDS amplification product; M. DL2 000 Marker; L. CDS amplification product of OsMBF1c gene.图 1 OsMBF1c基因结构分析及CDS全长扩增产物Fig. 1 Gene structure analysis of OsMBF1c and amplification product of OsMBF1c CDS
2.2 水稻OsMBF1c基因的生物信息学分析
使用ProtParam工具预测分析OsMBF1c蛋白的基本理化性质。结果显示,OsMBF1c蛋白含有155个氨基酸,分子式为C698H1184N224O209S3,分子量为16.154 kDa,理论等电点(PI)为10.67,表明此蛋白质呈碱性;蛋白质不稳定性指数37.59,表现为稳定蛋白;进一步在Expasy网站上利用ProtScale软件对OsMBF1c蛋白亲/疏水性进行分析,结果显示,OsMBF1c蛋白多肽链的第24位分值最低,为-2.111;第126位分值最高,为1.856,同时OsMBF1c亲水区域大于疏水区域,属于亲水性蛋白(图2:A);二级结构预测发现(图2:B),在OsMBF1c氨基酸组成中,以无规则卷曲为主,占46.45%,其次为α-螺旋,占45.16%,β转角占比最少,为4.52%。
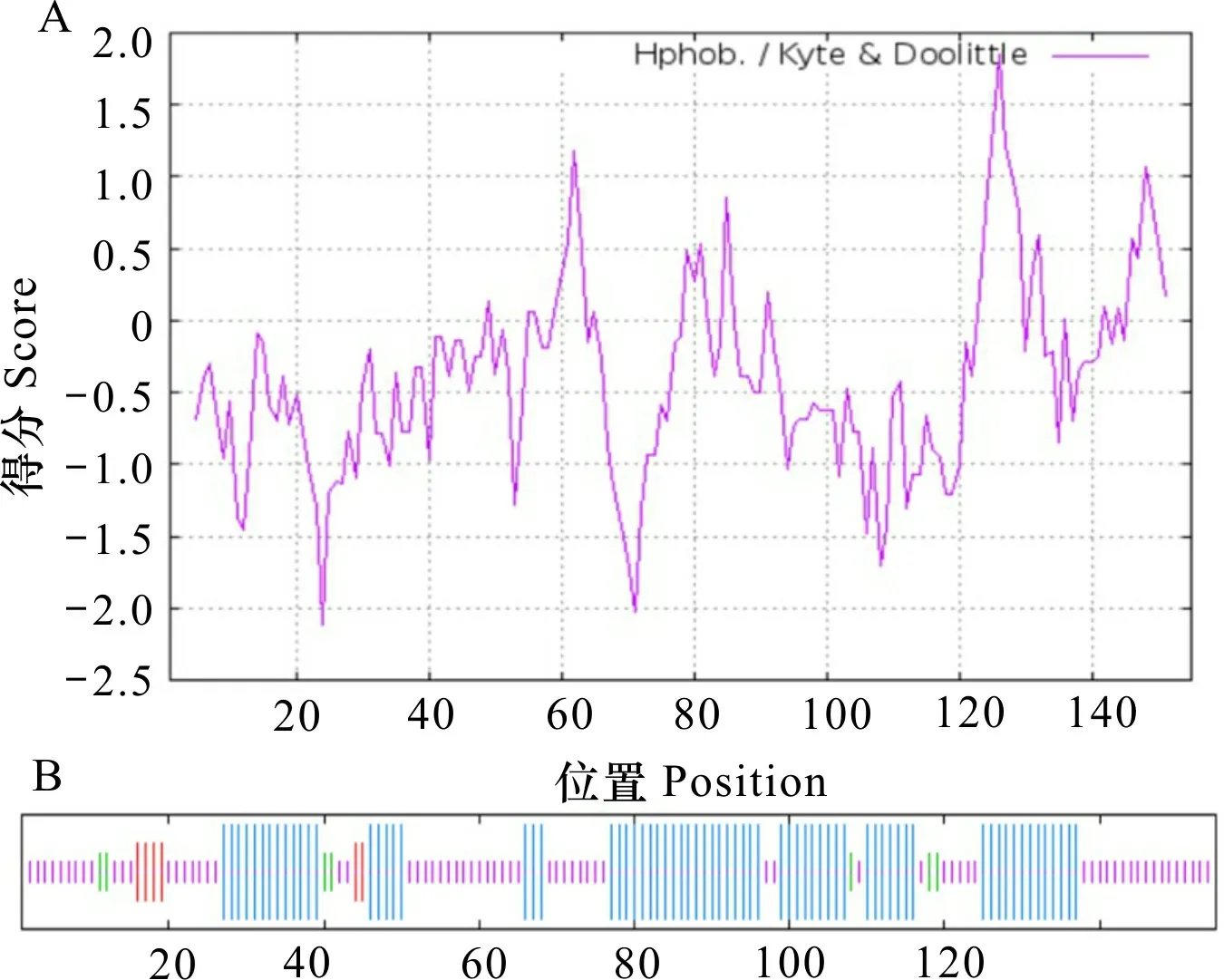
A. 疏水性区域预测; B. 二级结构预测。蓝色. α-螺旋; 红色. 延伸链; 绿色. β-转角; 紫色. 无规则卷曲。A. Hydrophobic region prediction; B. Secondary structure prediction. Blue. α-helix; Red. Extended chain; Green. β- corner; Purple. Random coil.图 2 OsMBF1c蛋白的生物信息学分析Fig. 2 Bioinformatics analysis of OsMBF1c protein
2.3 水稻OsMBF1c基因启动子顺式作用元件分析
通过TBtools对OsMBF1c顺式作用元件进行可视化分析,结果如图3所示。OsMBF1c的启动子序列中含有参与调节厌氧感应的顺式作用元件ARE、GC-motif、光响应元件G-box、乙烯响应元件ERE等。这些顺式作用元件可能在水稻应对不同非生物胁迫响应机制中对启动子的调控发挥重要作用,其启动子中基序的存在说明该基因有可能参与不同类型非生物胁迫的应对机制。
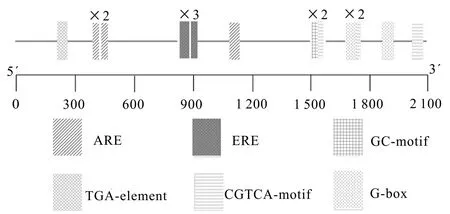
图 3 OsMBF1c蛋白的顺式作用元件分析Fig. 3 Cis-acting element analysis of OsMBF1c protein
2.4 水稻OsMBF1c多重序列比对和同源性分析
将OsMBF1c氨基酸序列与水稻、大麦、小麦、高粱和玉米等5种禾本科常见物种中同源基因的氨基酸序列进行同源性分析 (图4)。结果显示OsMBF1c与这些植物的MBF1氨基酸序列同源性介于41.29%~98.59%之间。其中,水稻OsMBF1c与二粒小麦TdMBF1a.1的同源性最高,而与玉米ZmEDRF 1.1的同源性最低。为进一步了解OsMBF1c与其他植物的MBF1蛋白之间的进化关系,利用 MEGA 7.0的Neighbor-Joining方法构建系统进化树(图5)进行分析,结果显示OsMBF1c与二粒小麦TdMBF1c.1、TdMBF1c.2、大麦HvMBF1.1的亲缘关系最近,该结果与基因同源性比对结果相一致。
2.5 MBF1同源蛋白保守基序分析
利用MEME对17条不同物种中MBF1蛋白进行了保守基序分析(图6),共鉴定获得10个保守基序(motif)。除ZmMBF1a外,其他同源蛋白的motif分布相对均匀,其分布数量与位置也基本相同,且在MBF1的同源蛋白中均存在motif 1与motif 2,这说明此蛋白质在进化过程中具有高度保守性,进而推断OsMBF1c可能与其他物种中的MBF1具有相同的功能特性。
2.6 水稻MBF1基因家族表达特性分析
分析了OsMBF1a、OsMBF1c在水稻进行100 μmol·L-1Cd处理下的表达情况。结果显示,在100 μmol·L-1Cd 处理下,地上部分OsMBF1a、OsMBF1c基因的表达水平均表现为上调,其中OsMBF1c在1 h达最高点,约为对照组(0 h)的7倍;随后呈下降趋势,处理6 h的基因相对表达量约为对照组的5.5倍,处理12 h的基因相对表达量变为对照组的3.5倍(图7:A);OsMBF1a基因表达量在6 h达最高点,约为对照组(0 h)的4.2倍,而在12 h时基因表达量呈下降趋势,约为对照组(0 h)的0.2倍(图 7:B);根部OsMBF1a、OsMBF1c基因的相对表达量较地上部分变化幅度较小,而与对照相比,个别处理时间呈显著性差异。结果还显示,100 μmol·L-1Cd 处理下,根部OsMBF1c基因在6 h达最高点,约为对照(0 h)的3倍(图8:A),根部OsMBF1a基因在12 h达最高点,约为对照(0 h)的4.4倍(图 8:B)。
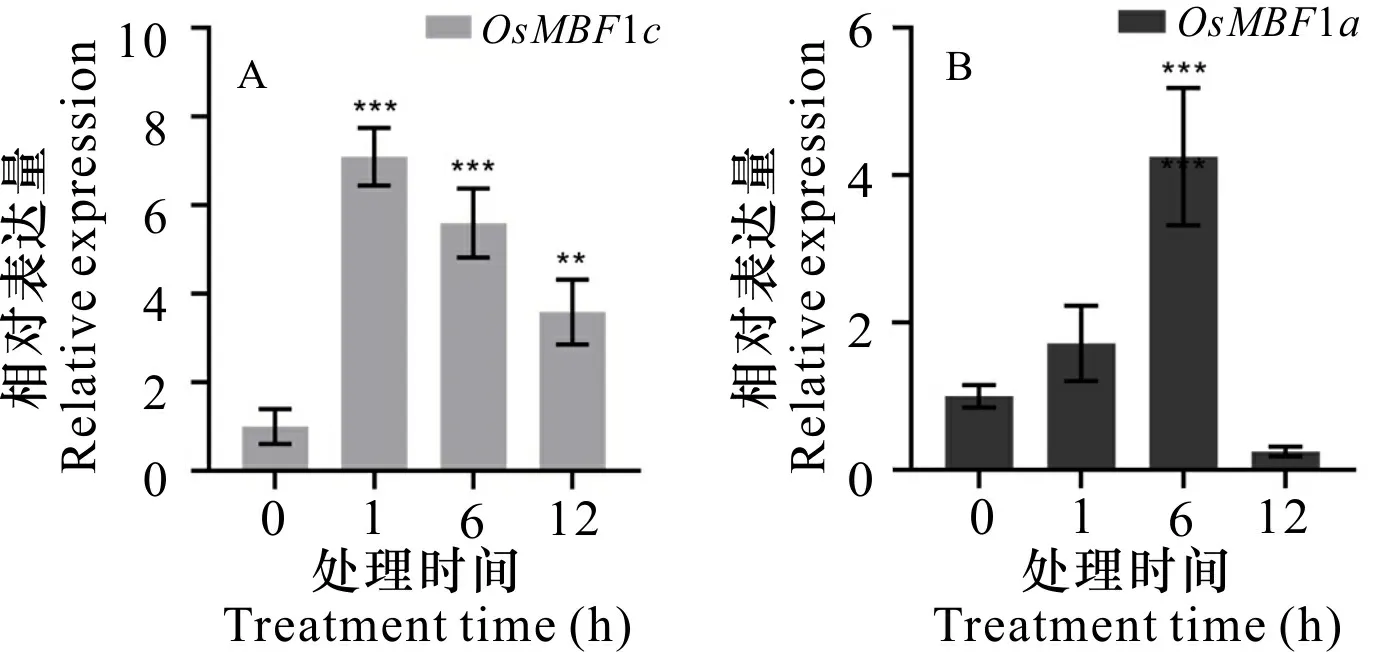
A. 水稻OsMBF1c基因的表达分析; B. 水稻OsMBF1a基因的表达分析; **. 与对照差异显著(P<0.01); ***. 与对照差异极显著(P<0.001)。下同。A. OsMBF1c gene expression analysis of rice; B. OsMBF1a gene expression analysis of rice; **. Significant difference compared with control (P<0.01); ***. Extremely significant difference compared with control (P<0.001). The same below.图 7 100 μmol·L-1 Cd胁迫水稻地上部分中OsMBF1c、OsMBF1a基因的相对表达量变化Fig. 7 Relative gene expression changes of OsMBF1c and OsMBF1a from the shoot of rice treated under 100 μmol·L-1 Cd stress
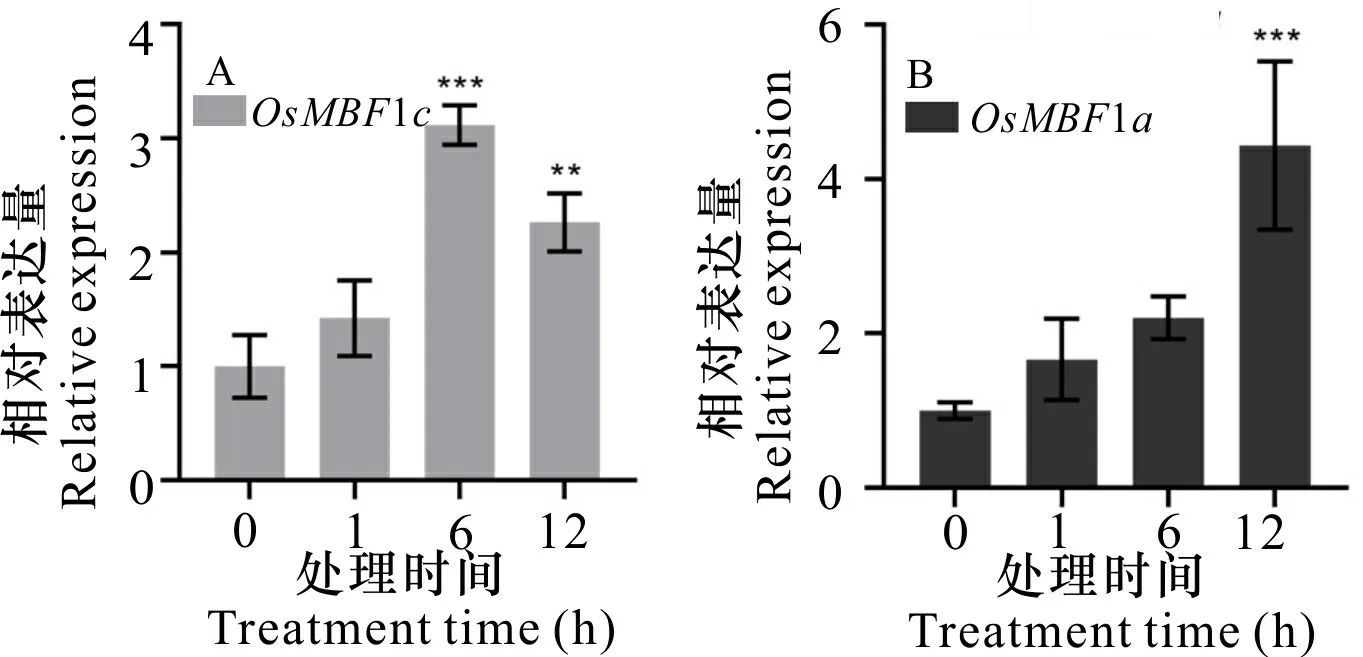
A. 水稻OsMBF1c基因的表达分析。B. 水稻OsMBF1a基因的表达分析。A. OsMBF1c gene expression analysis of rice; B. OsMBF1a gene expression analysis of rice.图 8 100 μmol·L-1 Cd胁迫水稻根部中OsMBF1c、OsMBF1a基因的相对表达量变化Fig. 8 Relative gene expression changes of OsMBF1c and OsMBF1a from the root of rice treated under 100 μmol·L-1 Cd stress
2.7 OsMBF1c蛋白互作网络分析
利用STRING数据库构建了水稻OsMBF1c蛋白的蛋白互作网络图(图9)。结果显示,OsMBF1c蛋白与OsRRM、HSFA6A和HSFA6B具有较强的相关性,其中HSFA6A、HSFA6B在植物应对高温、干旱和重金属等多种非生物胁迫过程中起着重要作用。通过预测与OsMBF1c蛋白互作的靶蛋白,将更加有助于深入探究水稻OsMBF1c蛋白的功能和调控机理。
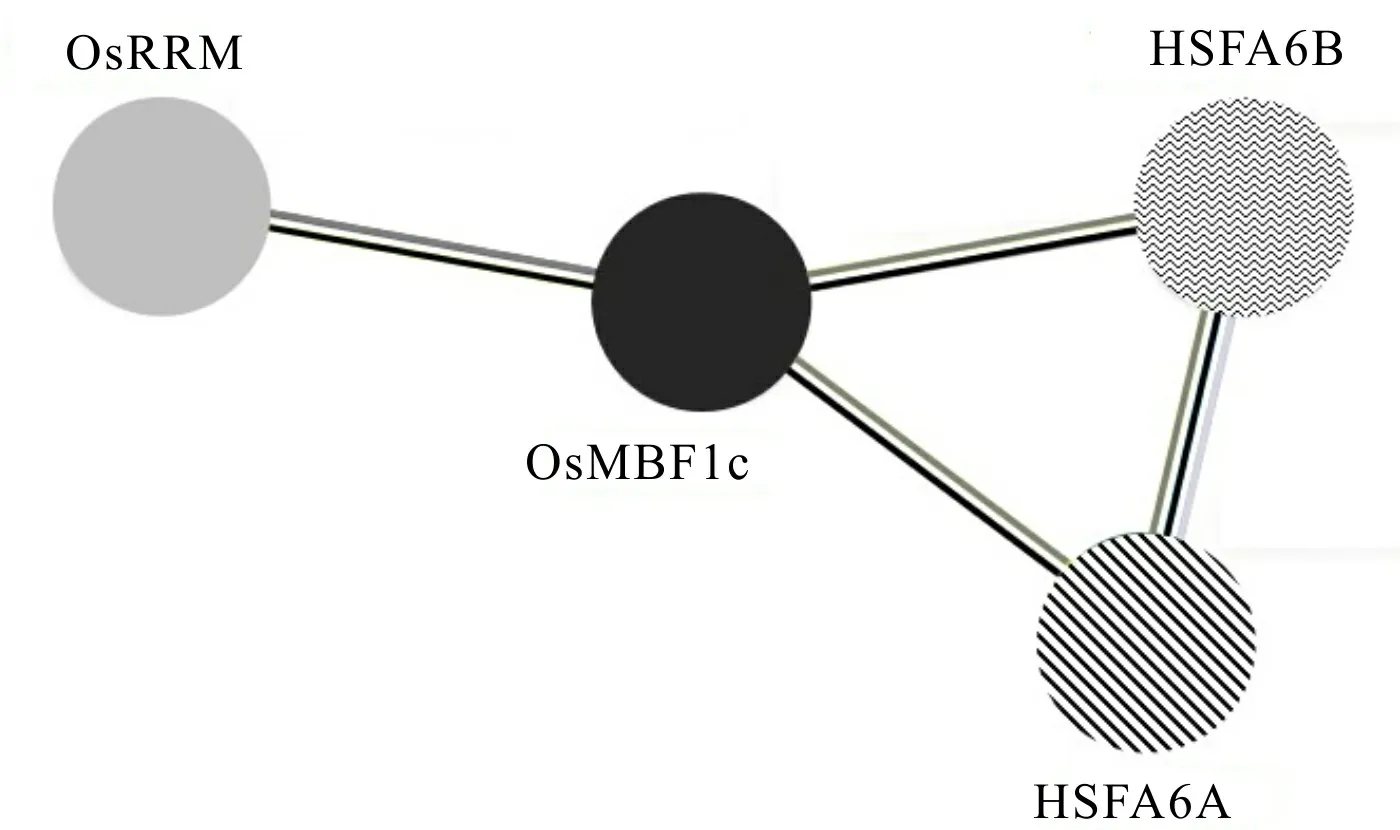
图 9 水稻中OsMBF1c蛋白相互作用网络Fig. 9 Protein interaction network of OsMBF1c in rice
3 讨论与结论
水稻在生长发育过程中可能会受到盐、低温、干旱、重金属等各种逆境胁迫,其中重金属所产生的危害严重制约着水稻产量和品质。水稻在长期进化过程中,逐渐形成了一套复杂的网络调控机制,以应对重金属逆境胁迫(董蔚等,2018)。MBF1蛋白作为转录共激活因子,参与植物中各种发育过程和非生物胁迫反应(Jaimes-Miranda & Chvez Montes, 2020)。植物中MBF1研究较多的是模式植物拟南芥,在拟南芥中具有3个MBF1基因,即AtMBF1a、AtMBF1b和AtMBF1c,其中AtMBF1a、AtMBF1c可增强拟南芥对热、渗透和盐等非生物胁迫的耐受性(Suzuki et al., 2005;Kim et al., 2007)。Zhang等(2019)研究表明,水稻中存在2个MBF1家族基因,即OsMBF1a、OsMBF1c,这与该文利用生物信息技术筛选出的结果一致,而对该家族基因在重金属胁迫下的功能研究却较少。OsMBF1c的基因结构中含有1个外显子,与拟南芥AtMBF1c相同。而OsMBF1c的同源基因OsMBF1a包含4个外显子,也与拟南芥AtMBF1a、AtMBF1b的外显子数相同(Tsuda & Yamazaki, 2004)。本研究结果进一步表明MBF1在不同植物物种间进化具有保守性,但在同一物种内的MBF1a/b与MBF1c却有较大差异。该现象表明植物在进化压力的选择下,就MBF1基因家族整体而言保持了较强的保守性,但该家族成员之间这种保守的差异却暗示着MBF1c可能与MBF1a/b分别具有不同的生物学功能。此外,对水稻OsMBF1c基因启动子顺式作用元件分析表明,该基因启动子中包括激素、低温等逆境应激元件,由此可推测水稻在重金属胁迫下,该基因可能发挥防御和应激作用。此外,系统进化树结果显示,OsMBF1a、OsMBF1c分别与大麦HvMBF1.2、HvMBF1.1亲缘关系较近。目前,虽无HvMBF1.1、HvMBF1.2基因功能的相关报道,但在Lai等(2020) 研究发现,大麦中的MBF1可能受脱落酸影响,并激活参与降低ROS含量的基因。由于重金属胁迫可使植物产生ROS,因此水稻MBF1蛋白是否与大麦MBF1蛋白家族具有相似功能,通过降低水稻ROS含量来提高水稻重金属耐受性仍需进一步探究。
前人在研究拟南芥、大麦草(Hordeumbrevisubulatum)等植物中MBF1应对非生物胁迫中的作用时发现,MBF1基因的表达模式与其功能有明显的相关性。例如,Zhang等(2020) 研究发现,经350 mmol·L-1NaCl处理6 h后的大麦草中HbMBF1a基因相对表达量有明显上调,经过表达HbMBF1a基因的拟南芥也同时呈现出较强的耐盐性。本研究发现,Cd胁迫可以显著诱导水稻各器官中OsMBF1c、OsMBF1a基因的上调表达,并在水稻根部和地上部分中对胁迫的响应模式不同,该结果与Zhang等(2020)对盐胁迫下HbMBF1a表达情况相类似。同时,通过对比地上和地下部分的表达模式发现,在不同Cd处理时间表达情况呈细微差异,在地上部分组织中,OsMBF1c普遍呈上调趋势,而OsMBF1a在Cd胁迫处理12 h后表达量却显著降低;在根部,OsMBF1c在6 h表达达到最高、而OsMBF1a在12 h达到最高,推测OsMBF1c可能参与水稻早期地上组织应对重金属胁迫的调控机制,而OsMBF1a更多地参与水稻后期根部Cd解毒机制。
目前,尚未有研究证明MBF1蛋白通过何种分子机制对非生物胁迫做出反应,进而调节应激反应。但是,可以推测的是MBF1作为转录辅因子,当细胞从非应激状态到应激状态,较为灵活的N端结构域可与不同的胁迫应答基因结合,从而一起参与调控植物的应激反应(Millership et al., 2004)。本研究蛋白互作预测显示,OsMBF1c蛋白与OsRRM、HSFA6A和HSFA6B等蛋白的相关性较强,这些蛋白在植物干旱、热激和盐等胁迫方面有着重要意义(Norbert et al., 2021)。在水稻中,OsMBF1c是否可与这些蛋白共同调控重金属应激反应以及通过何种分子机制对重金属应激做出反应等问题仍需进一步探究。

