木兰科植物组织培养技术研究进展
宦智群, 徐小蓉, 耿兴敏*, 唐 明
(1. 南京林业大学 风景园林学院, 南京 210037; 2. 贵州师范大学 生命科学学院, 贵阳550001 )
木兰科(Magnoliaceae)植物作为多心皮类植物的典型代表,是探索被子植物起源与发展演化的关键材料,科学研究价值极高;该科植物大多为春季观花木本,树形优美,叶、果、花均具较高的园林观赏价值(杨成华等,2017),常应用于工矿、居住区、道路、庭院绿化和公园绿地等方面(宋怀芬和刘会萍,2014);它们可以作为工业用材、药材和香料树种(孔焱焱,2018),具有较高的经济价值。由于对木兰科分类系统和亲缘关系的认知分歧,其类群概念至今尚未统一,分类系统众多,目前国内普遍被大家接受且应用最多的是刘玉壶(1997)系统,因此本文也采用该分类系统。据不同分类系统统计,世界木兰科种类数目为240~300种;《中国植物志》 (2004) 中记载中国有木兰科植物11属107种,《中国木兰》 (2004) 记载11属178种,FloraofChina(2008)记载12属112种。我国木兰科的物种丰富度中心在云南、贵州、广西、湖南、广东等地,物种丰度由东南、西南地区向北、东北和西北逐渐减少。
虽然我国的木兰科植物种类丰富,但野生资源匮乏与繁殖困难,严重限制了木兰科植物的推广栽培,导致其在园林中应用的种类十分有限(谭秀梅等,2018)。木兰科中许多植物自然结实率低(向光锋等,2019),并且人类活动破坏了原有生境,野生资源保存情况不容乐观。据《中国植物红皮书》(1991)记载,木兰科中被列为国家重点保护的珍稀濒危植物有39种之多,是被子植物中受到严重威胁种类最多的科;据《中国生物多样性红色名录·高等植物卷》(2013)记载,木兰科植物中存在易危(VU)40种、濒危(EN)27种、极危(CR)9种、近危(NT)6种、地区灭绝(RE)1种。木兰科植物的有性繁殖存在发芽率低、种源欠缺的问题,常规无性繁殖中嫁接繁殖不适合工厂化育苗,扦插繁殖生根困难(王欢等,2013;张果等,2016)。
组织培养技术是木兰科植物资源保育及开发的有效途径,可通过组织器官离体保存保育植物种质资源,也可通过工厂化育苗为园林绿化提供大量苗木以减少对野生资源的需求。虽然我国木兰科植物的部分树种在建立优良再生体系方面取得了一定的进展,但研究种类有限,鲜有应用于工厂化生产实践,并且组培过程中存在褐化、生根困难、愈伤组织再分化困难等技术问题。本文对木兰科植物不同再生途径的相关研究进行了论述,总结组培过程中普遍存在的褐化、生根困难等技术难题与解决措施,以期为木兰科植物高效的再生体系建立提供理论基础。
1 无菌短枝扦插途径
木本植物组织培养有无菌短枝扦插、器官发生、体细胞胚发生等再生途径。国内木兰科植物的组织培养中无菌短枝扦插途径研究较多。虽然木兰属(Magnolia)和含笑属(Michelia)的部分种类已经建立了完整的再生体系,但种类有限,增殖系数低、褐化及生根困难等技术难题仍未得到解决;其他如木莲属(Manglietia)、拟单性木兰属(Parakmeria)等仅见个别种有研究,且大多处于初步探索阶段。
1.1 无菌体系的建立
外植体的选择、取材时间、处理方式、消毒方式是影响无菌体系建立的几个关键因素。
木兰科植物的无菌短枝扦插一般选取茎尖、带腋芽的幼嫩茎段、顶芽或侧芽作为外植体(表1)。由于新生组织内含有的病菌以及酚类物质比在自然环境生长时间较长的植物材料少,因此选取靠近枝条顶端的芽和茎段,这些部位污染率和褐化率相对低,存活率相对高(Maria, 2012;唐军荣等,2014)。
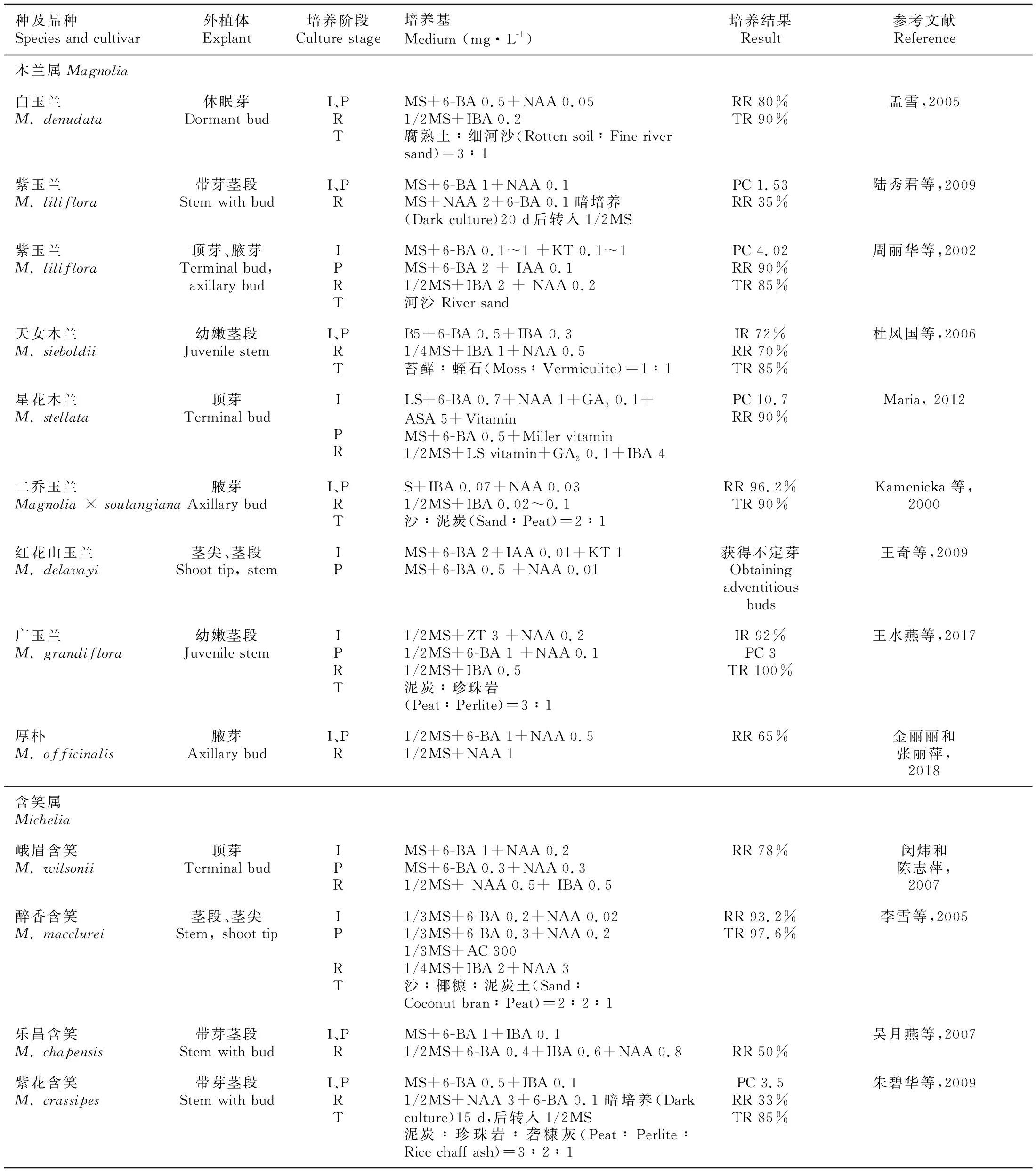
表 1 木兰科植物组织培养中无菌短枝扦插途径Table 1 In vitro shoot propagation in tissue culture of Magnoliaceae plants
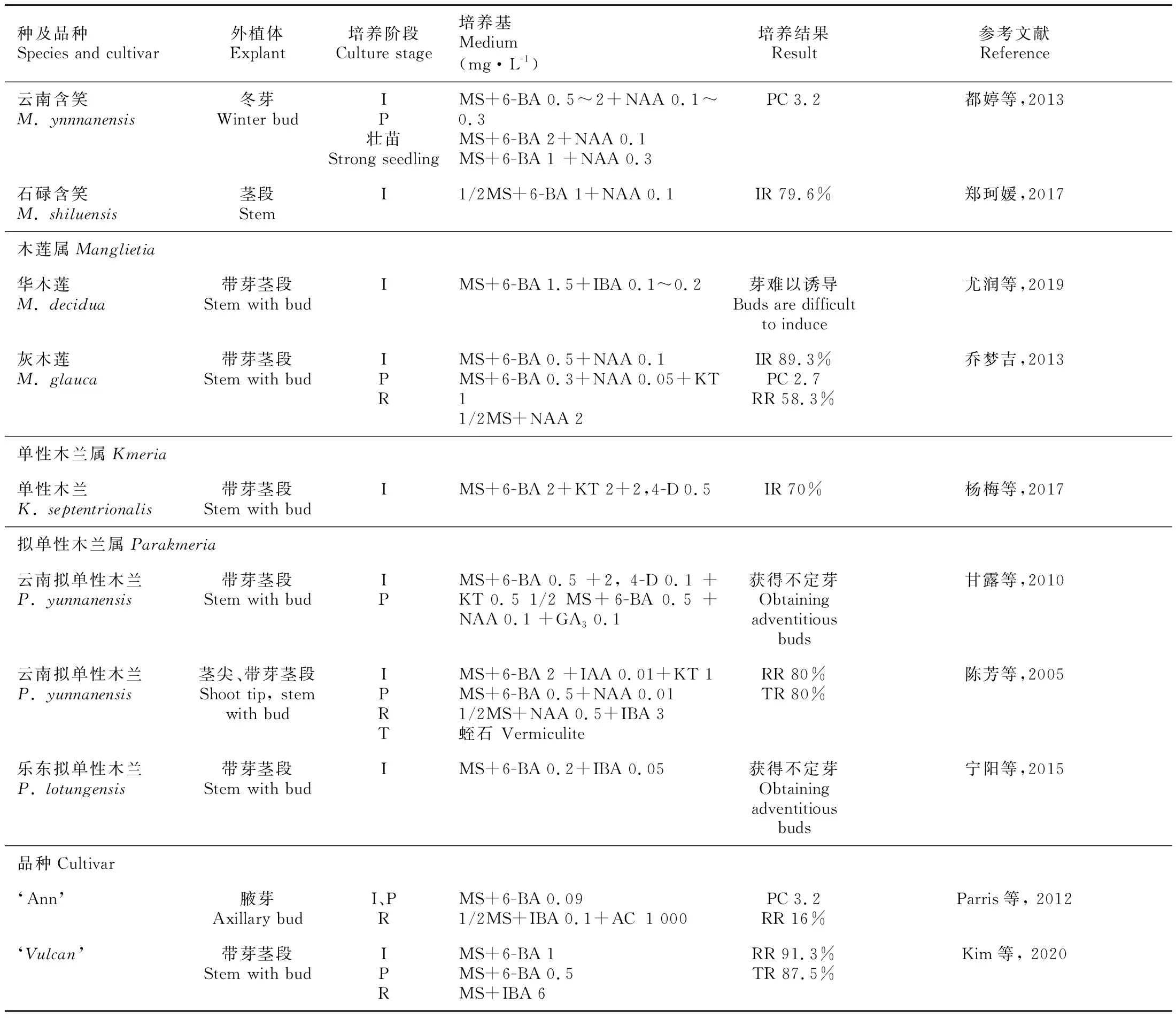
续表1
外植体的取材时间极大程度地影响着组培苗的污染率、褐化率与启动率,需综合考虑三者来确定取材时期。一般来说,木兰科植物夏季(7—8月)取材的外植体褐化严重(黄树军等,2013),休眠期(12月至翌年1月)取材的外植体污染率、褐化率相对较低(都婷等,2013;Maria, 2012),而春季蕾期阶段(5月)采集的初代外植体形态发生能力强,启动率较高(Konopkova et al., 2020)。
外植体处理方式不同会影响启动培养的结果。由于托叶会阻碍嫩芽的营养吸收,外层鳞片影响灭菌效果,因此消毒前去除外层鳞片,消毒后去除托叶的顶芽外植体的启动速度、启动率、顶芽长势均好于对照(唐军荣等,2014)。此外,宁阳等(2015)研究表明切掉叶柄的茎段外植体较之叶柄已自然掉落的茎段,腋芽萌发受到抑制且更易褐化。
芽、茎段外植体的消毒均以0.1% HgCl2为佳,灭菌时间要根据外植体的采集时间、幼嫩程度来确定,休眠期取材的外植体消毒时间应高于生长期取材的,幼嫩的外植体消毒时间应低于成熟的(都婷等,2013)。对于灭菌困难的种类,污染严重的可以鉴定其相关内生细菌,筛选适宜种类和浓度的抑菌剂添加至培养基中。
1.2 启动培养
基础培养基、生长调节剂是影响启动培养的关键因素。从表1可以看出,MS培养基是木兰科植物芽和茎段启动培养的常用基础培养基。6-BA的用量对芽的诱导及生长的影响极大,外植体的启动速度往往随6-BA浓度的增加而增加(都婷等,2013),最佳6-BA浓度取决于培养基中蔗糖与氮盐的比例,6-BA、蔗糖和氮盐水平不适合会导致褐化(Wojtania et al., 2015)。6-BA的适宜浓度一般为0.5~2 mg·L-1,并与少量的NAA(0.05~0.2 mg·L-1)、IBA(0.05~0.2 mg·L-1)等生长素配合使用(表1)。启动培养中,一些种类可能存在腋芽活性较低的现象,仅添加6-BA不足以使芽生长,此时需要加入适量的赤霉素(GA3)(0.1~2 mg·L-1)来打破休眠,并刺激芽的生长(Wojtania et al., 2019;Cui et al., 2019),其作用效果依赖于MS培养基中的蔗糖与氮盐的比例(Wojtania et al., 2015)。
1.3 增殖培养
基础培养基、生长调节剂同样是影响增殖培养的关键因素。MS培养基是最广泛用于木兰科植物增殖培养的基本培养基(表1)。但是,不同木兰种和品种的增殖阶段对基本培养基组成的要求是基因特异性的(Konopkova et al., 2020)。Sokolov等(2014)研究表明常用于葡萄离体繁殖的VM培养基与常用于核桃、白蜡、榆树等离体繁殖的DKW培养基能提高一些种类的增殖速率和芽的整体质量,与MS具有相似的作用,在木兰科植物的增殖阶段具有应用前景。
目前,最适合木兰科植物增殖培养的细胞分裂素是6-BA,对多种木兰及栽培品种腋芽增殖效果显著(Parris et al., 2012; Sokolov et al., 2014),其最佳浓度因基因型的不同而不同,范围为0.25~5 mg·L-1(Wojtania et al., 2015)。但是,6-BA会导致某些木兰组培材料玻璃化,降低芽的质量,并抑制生根。MT(meta-Topolin)是一种与6-BA结构相似的细胞分裂素,可以减少木兰品种‘Ann’玻璃化苗的产生(Parris et al., 2012)。此外,苯基脲类细胞分裂素CPPU是6-BA生物活性的10~100倍且价格低廉,在其他植物的组培中被广泛用于促进侧芽分化与植株生长(孙晓波等,2020),在木兰科植物中尚未见应用,可考虑与MT、低剂量的纳米碳(冯璐等,2017)等作为6-BA的替代品,应用于木兰科植物的增殖培养。增殖培养期间,组培苗易褐化,需要注意的是在后期应适当降低6-BA的浓度(Konopkova et al., 2020)且及时转瓶(周丽华等,2002)。
木兰科植物外植体的增殖能力具有基因型特异性(Sokolov et al., 2014),不同基因型的木兰科植物的增殖分化难易程度不一,在同样的培养基与生长调节剂条件下,二乔玉兰(Mognolia×sallangiana)的增殖率明显高于白玉兰(M.denudata)和紫玉兰(M.liliflora)(李艳等,2005),而星花木兰(M.stellata)腋芽的增殖率高于二乔木兰(Maria, 2012)。
1.4 生根培养
在木兰科植物的生根培养过程中,常通过降低无机盐浓度和调整基本培养基组成来促进生根,无机盐含量只需为增殖培养时的一半,即可满足生根培养所需养分(邓演文等,2018)。1/2MS 培养基是目前大多数木兰科植物选择的生根培养基。外植体的生根潜力可能受基础培养基组成的影响较小(Sokolov et al., 2014),白玉兰在 1/2MS 培养基以及 1/4MS 培养基中都能生根,两者的生根率和生根数差别不大(孟雪,2005)。
生长调节剂在根原基形成与生长中起关键作用,多数木兰科植物需添加生长素才会有较高的生根率,IBA是最常用于木兰科植物生根培养的生长素(表1),不同浓度的IBA能够调节产生根系数量与长度(Kamenicka et al., 2000)。木兰离体生根明显依赖于IBA和蔗糖水平,且这两种水平在不同基因型之间是不同的,玉兰品种‘Elizabeth’‘Burgundy’‘Spectrum’在含有6 mg·L-1IBA和30 g·L-1蔗糖的1/2MS培养基上生根效果最好(Wojtania et al., 2019)。对于生根困难的种类,则通过改善生根培养的条件和改变生根的方式等技术措施来促进生根(具体方法于文章5.2部分详述)。
1.5 培养条件
光照、温度和pH值等培养条件是影响木兰科植物形态发生的重要因素,在木兰科组织培养中所选择的蔗糖浓度、pH、培养温度、光照强度和光照时间相差不大,分别是蔗糖 20~40 g·L-1、pH 5.6 ~ 6.7(木兰科植物偏好碱性土壤)、培养温度 23~28 ℃、光照强度 1 000~3 000 lx、光照时间10~16 h·d-1。
相关培养条件在不同培养阶段与不同基因型的植物中有所差异,有时需要具体探讨。例如,蔗糖是木本植物组织培养中最常用的碳源(Wojtania et al., 2019),而Kamenicka等(1998)发现果糖、甘露糖和木糖是二乔玉兰芽增殖最有效的碳源,其次是蔗糖。培养基中常用的铁源是硫酸亚铁(FeSO4),而Sokolov等(2015)研究表明螯合铁NaFeEDTA和Fe(III)AC比非螯合铁FeSO4·7H2O更合适作为广玉兰(M.grandiflora)和二乔玉兰增殖和生根培养基中的铁源。不同光质可能通过影响相应光受体的活性进而影响激素水平, 从而影响植物的生长发育。由于红光可以促进地上部分生长,蓝光、远红光则可以促进地下部分生长(任桂萍等,2016),因此可以考虑在启动和增殖阶段使用红光,在生根阶段使用蓝光和远红光来促进组培苗的生长。
2 器官发生途径
木兰科植物器官发生途径的研究目前仍只限于木兰属和含笑属的少量种类,愈伤组织诱导困难及其不定芽分化困难的问题仍没有得到有效解决。木兰科植物的器官发生途径除个别通过叶片直接分化得到不定芽外(李艳等,2005),大多通过间接器官再生途径,先由外植体形成愈伤组织,再由愈伤组织分化为不定芽。
2.1 愈伤组织诱导
木兰科植物可以通过营养器官(顶芽、茎段、叶片、叶柄)和繁殖器官(花托、花瓣、花药)等诱导出愈伤组织(表2)。外植体来源不同,愈伤组织的诱导率也会不同。一般来说,顶芽和茎段较易诱导出愈伤组织,且愈伤组织生长状态较好。厚朴(M.officinalissubsp.officinalis)不同取材部位的愈伤组织诱导率为茎段>顶芽>叶片(谢燕燕等,2017);凹叶厚朴(M.officinalissubsp.biloba)外植体脱分化形成愈伤组织的能力大小为顶芽及茎段>雌蕊>花被>雄蕊>托叶>叶柄(刘叶蔓等,2008)。
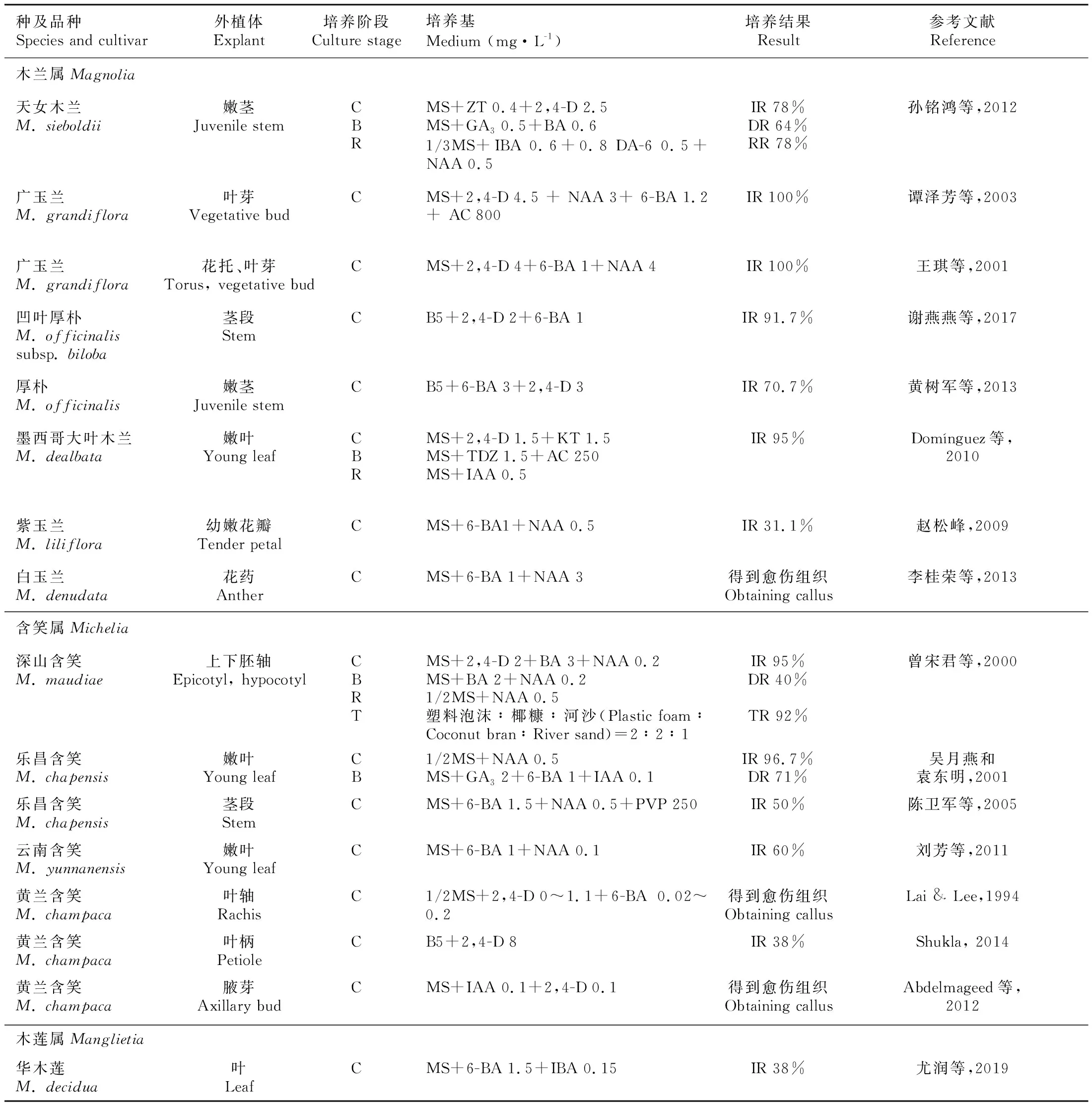
表 2 木兰科植物组织培养中器官发生途径Table 2 Organogenesis in tissue culture of Magnoliaceae plants
适宜的基本培养基对愈伤组织分化起着关键作用。MS培养基和B5培养基最常用于木兰科植物的愈伤组织诱导(表2)。实验证明,MS培养基适合大多数木兰科植物的多种外植体的愈伤组织诱导。但是,对于个别种类,如厚朴、凹叶厚朴的芽、茎段,以及黄兰含笑(Micheliachampaca)的叶柄等外植体,MS培养基中NH4+浓度较高,可能会对愈伤组织造成毒害,不利于其分化生长,B5培养基更加适合其愈伤组织诱导(黄树军等,2013;Shukla, 2014;谢燕燕等,2017)。
不同生长调节剂处理对愈伤组织的诱导率存在明显差异,并且诱导出愈伤组织的形态、生长状态和色泽等随生长调节剂种类及其配比的不同而不同(何培琦等,2010)。2,4-D(1~5 mg·L-1)和6-BA(1~5 mg·L-1)是木兰科植物愈伤组织诱导中常用的细胞分裂素(表2)。适宜浓度的2,4-D或6-BA诱导愈伤组织所需时间短且愈伤组织生长良好(黄树军等,2013;Shukla,2014)。6-BA与2,4-D或KT同时使用能提高诱导率和愈伤组织的质量。罗在柒等(2010)对紫玉兰的不同外植体进行愈伤组织诱导,从诱导率和增殖系数来看,2,4-D 4 mg·L-1+6-BA 1 mg·L-1的组合下诱导效果比较理想;而墨西哥大叶木兰(Magnoliadealbata)叶片外植体在MS+2,4-D 1.5 mg·L-1+KT 1.5 mg·L-1的培养基上,获得绿色、致密的愈伤组织(Domínguez et al., 2010)。
在培养条件的选择中,暗培养比光培养更有利于一些木兰科植物的愈伤组织的形成和生长。暗培养下的日本厚朴(M.obovata)顶芽外植体比光培养先诱导出愈伤组织,且在相同时间内,愈伤组织鲜重增长量大于光培养(付晓云等,2009)。黑暗环境中厚朴顶芽外植体的愈伤组织诱导率比光照条件下高且产生的愈伤组织形态结构较好,可能是光照有利于多酚类物质的积累,多酚类物质和酚氧化酶产生的化学反应产生有害的醌类物质,从而导致外植体死亡(何培琦等,2010)。
2.2 愈伤组织的再分化
木兰科植物的愈伤组织再分化较困难(表2),很多外植体诱导出的愈伤组织质地松软或褐化严重,最终未能分化成芽。木兰科植物愈伤组织能否分化出芽器官,与所用的基本培养基有关。吴月燕和袁东明(2001)比较了MS、MS’、1/2MS、GS培养基对乐昌含笑(Micheliachapensis)叶片愈伤组织再分化的影响,结果表明MS’培养基是愈伤组织再分化的最佳培养基。
愈伤组织的再分化受细胞分裂素与生长素的浓度与配比影响。GA3是促使愈伤组织分化为芽的有效途径,常与分裂素6-BA、2,4-D、KT等配合使用。在MS+6-BA 0.6 mg·L-1+GA30.5 mg·L-1培养基上,天女木兰(Magnoliasieboldii)嫩茎愈伤组织成功分化成芽(孙铭鸿等,2012);在MS’+6-BA 1mg·L-1+ GA32 mg·L-1培养基上,乐昌含笑叶片愈伤组织再分化成芽的比率最高(吴月燕和袁东明,2001)。
未来对于木兰科植物愈伤组织再分化困难的问题,应当探索更多用于诱导愈伤组织的外植体种类,同时致力于抑制愈伤组织的褐化,确保得到的愈伤组织颜色良好,质地紧密;此外,还应进一步探索基本培养基与生长调节剂对愈伤组织分化的影响。
3 体细胞胚培养
国内对体细胞胚诱导培养的相关研究较少,仅有杂交鹅掌楸(Liriodendron×sinoamericanum)的体细胞胚培养的研究见于报道。陈金慧(2003)以杂交鹅掌楸幼胚为外植体,以蔗糖为渗透剂提高渗透压,在MS+1~4 mg·L-1培养基上有效诱导出体细胞胚。体胚发生初期添加 0.1 mg·L-1的磺肽素(PSK)可以提高未成熟胚的脱分化率并能有效改善培养细胞的状态;0.5 mg·L-1的PSK能够促进胚性愈伤组织的形成和增殖(陈金慧等,2013)。1 μmol·L-1的茉莉酸甲酯(MeJA)可以提高杂交鹅掌楸的体胚发生率和成熟率、降低畸形胚发生率,2 mg·L-1ABA能够增强 MeJA 的上述效应(成铁龙等,2017)。
国外对木兰科中木兰属植物胚状体的培养研究相对较多。幼胚是木兰科植物适宜的体胚发生外植体,弗吉尼亚木兰 (Magnoliavirginiana)、福来氏木兰(M.fraseri)、尖头木兰(M.acuminata)、金字塔玉兰(M.pyramata)和北美大叶木兰(M.macrophylla)、墨西哥大叶木兰、日本厚朴、黄兰含笑(Micheliachampaca)都通过未成熟种子成功诱导出体细胞胚(Merkle & Wiecko, 1990; Merkle & Watson, 1993, 1994; Rosas et al., 2006; Kim et al., 2007; Armiyanti, 2012; Park et al., 2012; Cortazar et al., 2020)。
基因型、培养基和发育时期等是影响体细胞胚发生的关键因素。体细胞胚诱导培养一般选择在添加一定浓度2,4-D(0.01~1 mg·L-1)的WPM培养基上进行(Armiyanti, 2012; Cortazar et al., 2020)。有机附加物是木兰科体胚诱导所必需的营养物质,酪蛋白水解物、谷氨酰胺常被添加至诱导培养基中。未成熟种子最佳采集时间为花后3~4周;培养基中添加蔗糖比添加葡萄糖更利于体细胞胚的形成,蔗糖的最适添加量为3%(Kim et al., 2007)。
成功诱导出的体细胞胚往往转移到无激素的培养基上继续萌发成苗,黄兰含笑体细胞胚在MS培养基上萌发率为34%(Armiyanti, 2012),日本厚朴体细胞胚在1/2MS培养基上萌发率在80%以上,并形成正常的初生叶和根(Park et al., 2012)。
体细胞胚培养存在的问题是体胚诱导率和分化成苗率都很低,并且成功诱导出的体细胞胚中还有相当一部分是不能发育成苗的畸形胚(Merkle & Wiecko, 1990; Merkle & Watson, 1993, 1994; Kim et al., 2007),在今后的研究中还需进一步探索。
4 胚培养
木兰科植物的胚培养大多是幼胚培养。由于带种皮的种胚消毒不易彻底,因此接种前必须剥去种皮。幼胚灭菌时,相较于带外种皮与中种皮的种子,只带内种皮的种子污染率更低(徐石等,2008)。0.1% HgCl2消毒醉香含笑(M.macclurei)种胚 6~9 min,能获得60%~65%无菌且可萌发的外植体(刘英, 2021)。天女木兰种子采用75%酒精30 s+NaClO 10 min灭菌效果最佳,存活率达48%(于新杰,2016)。
在基本培养基的选择方面,B5培养基较为适宜,其含有幼胚生长所需的Ca2+、K+等大量元素和微量元素(杜凤国等,2006;于新杰,2016)。在植物生长调节剂的选择方面,6-BA显著影响芽的增殖,6-BA 和 NAA 较 ZT、KT、IBA、2,4-D、IAA更适合白玉兰幼胚离体培养中的增殖培养。天女木兰幼胚离体培养的最适增殖培养基是B5+6-BA 2 mg·L-1+NAA 0.04 mg·L-1+IBA 0.5 mg·L-1+AC 1 g·L-1,增殖系数超过3.6(陆秀君等,2008)。适合凹叶厚朴增殖的培养基为MS+6-BA 2.5 mg·L-1+NAA 0.5 mg·L-1,增殖系数可达 6.2(马英姿等,2014)。由于木兰科植物种子中酚类物质含量较多且易出现褐化,因此在培养基中往往加入AC(陆秀君等,2008)或 4~8 g·L-1的聚乙烯吡咯烷酮(PVP)来抑制其褐化(刘英,2021)。
由于木兰科植物成熟种子休眠期较长,休眠延长了种子的萌发进程,因此直接利用木兰科植物成熟种子启动离体培养的研究相对较少。目前仅见的报道是Sokolov等(2014)对广玉兰和二乔玉兰的研究,具体的做法是先对种子层积处理30 d和90 d后再进行离体培养,其种子萌发培养基为MS+6-BA 0.5 mg·L-1,萌发植株生长良好,层积处理后的种子在离体条件下的发芽率和成活率均好于直接播种。
5 技术难点
5.1 褐化
褐化在木兰科植物的组培过程中普遍存在,外植体的褐化影响了多种木兰科植物芽的萌发、愈伤组织的增殖与分化(刘均利和马明东,2007;刘叶蔓等,2008),导致组培效率不高,从而限制了组培苗大规模的生产(周丽艳等,2008;王欢等,2012)。对于木兰科植物易褐化的问题,前人通过外植体类型选择、采条季节选择、外植体预处理方式、添加抗氧化剂、暗培养等多种方法加以抑制,并取得了较好的效果。
(1)外植体类型选择:由于不同外植体中多酚氧化酶(PPO)与酚类物质各异,因此选择低PPO活性或低酚类含量的外植体可有效降低褐化程度,如天女木兰的侧芽作为外植体,褐化程度较之其他部位要低(徐石等,2008;王欢等,2012)。
(2)采条季节选择:植物在不同季节的代谢活动有强弱,PPO的活性有所不同,如白玉兰外植体在春、冬两季取材PPO活性较低且褐化率较低(周丽艳等,2008;王欢等,2012)。
(3)外植体的预处理方式:接种前的预处理包括浸泡外植体与低温预处理,如在清水中浸泡12 h以上(王奇等,2009)、在1 g·L-1维生素C(VC)或PVP溶液中浸泡4~6 h(王欢等,2012;王倩颖等,2017)、4 ℃低温预处理5~7 d(朱碧华等,2009)、8 ℃低温暗培养4 d(刘均利和马明东,2007)都可以有效减轻褐化。
(4)暗培养:黑暗环境可以抑制PPO的活性,培养初期一定时间的暗培养可以降低褐化率(周丽艳等,2008;王欢等,2012)。
(5)培养基类型:培养基中NH4+浓度过高可能会导致褐化,如相较于高浓度NH4+的MS培养基,B5培养基降低了天女木兰外植体的褐化率(王欢等,2012)。
(6)植物生长调节剂:6-BA、KT等细胞分裂素既能促进酚类化合物的合成,又能刺激PPO的活性。6-BA对二乔玉兰的芽中酚类物质的产生具有调节作用,随着6-BA浓度的升高(0.2~1 mg·L-1),酚类物质含量呈上升趋势(Wojtania et al., 2015)。
(7)添加抗氧化剂、吸附剂:向培养基中添加适宜浓度的抗氧化剂[如柠檬酸(CA)、VC、硝酸银(AgNO3)]或吸附剂(如PVP、AC)能有效抑制褐化。CA 通过降低 POD 活性或结合培养基中的金属离子抑制PPO的活性,防止酶促褐变;AgNO3通过降低MS培养基中易引起酚类物质产生的NH4+来抑制褐变,而AC、PVP则是通过吸附外植体产生的醌类物质来抑制褐变。适宜的抗褐化剂因基因型与外植体种类的不同而异(王倩颖等,2017),如Na2S2O3、CA对白玉兰外植体的抑褐效果好于PVP、VC(周丽艳等,2008),而PVP、VC对天女木兰外植体抗褐化效果却更好(王欢等,2012;高红兵等,2017)。景宁木兰(Magnoliasinostellata)叶片最佳抗褐化剂为AgNO3,而带芽茎段和根部的最优抗褐化剂为CA(王倩颖等,2017)。由于过高浓度的 PVP和AC会抑制芽的增殖和根的形成(Parris et al., 2012),因此需要探索抗褐化剂的适宜浓度。一般VC使用的最适浓度为500 mg·L-1,PVP最适浓度为1 000~1 500 mg·L-1,CA最适浓度为300 mg·L-1(高红兵等,2017),AC浓度以0.5%为佳(曾宋君等,2000;陆秀君等,2008)。
目前,木兰科植物组培的褐化问题主要通过在培养基中添加抗褐化剂来抑制,除了上述提到的抗褐化剂外,抗氧化剂一类中的植酸、L-半胱氨酸、甘露醇、血清白蛋白等未见应用于木兰科植物的组培,可在未来的实验中尝试。此外,螯合剂乙二胺四乙酸二钠(EDTA)可替代蛋白质与多酚氧化酶类进行螯合,减少酚的氧化作用;PAL抑制剂2-氨基茚满-2-膦酸(2-aminoindane-2-phosphonic acid,AIP)可以通过抑制苯丙氨酸生物合成来减少褐变(Jones & Saxena, 2013);表没食子儿茶素没食子酸酯(EGCG)可以通过抑制PPO以抑制褐变(Saeleaw et al., 2017);高剂量的纳米碳可以防止褐化现象(冯璐等,2017)。这些不同抗褐化剂对褐化的抑制效果,都将成为未来研究的内容。
5.2 生根困难
木本植物组织培养普遍存在生根困难问题,如紫花含笑(Micheliacrassipes)组培苗生根率仅有33%(朱碧华等,2009),紫玉兰带芽茎段组培苗生根率仅有35%(陆秀君等,2009),玉兰品种‘Ann’的生根率只有16%(Parris et al., 2012),而有些种类甚至无法生根,只能进行到增殖培养阶段(郑珂媛,2017;杨梅等,2017;尤润等,2019)。
基因型、树种产地、培养条件等都可能是影响生根的因素,前人通过改善生根培养的条件、改变生根的方式等技术措施来促进生根。调节培养基中的生长调节剂种类和浓度等可以促进生根,如对难以生根的木兰品种‘黄鸟’可以通过降低其生根培养基中的蔗糖浓度(20 g·L-1)来促进有效生根(Wojtania et al., 2019);添加低浓度的AC可优化生根效果(陈金慧和施季森,2002;Parris et al., 2012);添加适宜的生根剂如新型植物活性剂DA-6有利于天女木兰组培苗生根(孙铭鸿等,2012)。对生根类型为诱导生根型的一些木兰科植物如紫花含笑(宋晓琛等,2014),可以适当调整培养基成分,诱导出愈伤组织,从而促进其不定根的形成。改变生根方式,如试管外生根、浸泡生根法是提高生根率的途径,郭治友等(2008)利用试管外生根将杂交鹅掌楸组培苗的生根率提高至83.3%。此外,间歇浸没式培养系统是近年来发展起来的一种植物组织培养系统,较之传统的固体培养,具有培养周期短、增殖率高、自动化程度高、培养通量大等特点(张杰等,2020),利用此系统或可促进生根。
6 研究展望
在我国木兰科植物的组织培养研究中,无菌短枝扦插途径的再生体系已相对完善,从灭菌到启动、增殖、生根的培养基与生长调节剂的选择虽有大量研究,但研究的植物种类有限。顶芽、茎段相较于其他外植体易于获得且诱导率高,无菌短枝扦插途径作为木兰科植物组织培养的主要再生途径,应考虑将更多具有优良特性的野生种质资源纳入研究范围。
器官发生途径、体细胞胚发生途径研究相对尚浅,器官发生途径中选择的外植体类型有限,其他植物中最常用于诱导愈伤组织的叶片却因为褐化而难以诱导愈伤,并且仅有极少的种类能诱导愈伤组织再分化为芽。体细胞胚发生途径在国内鲜有研究,并且存在体胚诱导率和分化成苗率低的问题。此外,木兰科植物组培中普遍存在褐化与生根困难的技术难题,目前尚未从根源上得到解决,这也限制了组培苗的大批量繁殖。
针对上述问题,未来木兰科植物的组织培养需围绕以下几个方面重点展开研究。(1)全面探索木兰科不同植物种类的组织培养,特别是木兰属、含笑属以外的种类,通过组培的技术手段,保存更多珍稀濒危的野生种质资源;对于已经建立再生体系的品种,可进一步优化再生培养条件,提高再生效率,以备工厂化育苗之需。(2)探索更多种类的外植体的离体再生,尝试雄蕊、雌蕊、花被、花柱、花托、子房、叶柄、根等不常见的外植体种类。(3)针对增殖系数普遍较低的问题,可以通过研究增殖期间内源激素的变化来确定适宜的外源激素浓度与配比,并考虑环境因子如温度和光照对增殖的影响。(4)对于褐化问题,除探讨外植体类型与取材时期、预处理方式、不同种类的抗氧化剂、吸附剂对于褐化的抑制效果外,应结合酚类物质、PPO等相关酶的活性测定,鉴定褐化反应的底物,并研究组培褐化的分子调控机制,进一步揭示褐化机理,从而通过改变相关基因的表达从根源上减少褐化。(5)对于生根困难问题,可以通过改善生根培养的条件、改变生根的方式和添加适宜的生根剂来促进生根,并对生根的组培苗生理生化指标进行分析,在此基础上进行解剖学观察,判断生根类型、研究生根机理。(6)体细胞胚胎培养作为再生途径之一,可以克服生根困难的问题,但在国内却鲜有研究,应作为未来探索的重点。
在组培技术的应用方面,木兰科植物中珍稀濒危的种类众多,少数种如景宁木兰(Magnoliasinostellata)、华木莲(Manglietiadecidua)等的组织培养虽有初步研究(王倩颖等,2017;尤润等,2019),以及结合液滴玻璃化技术低温保存‘Ashei’木兰 (Magnoliamacrophyllavar.ashei)离体茎尖的例子(Folgado & Panis, 2019),但木兰科更多的濒危物种的种质资源有待利用组培技术保存。木兰科中一些种类如厚朴和凹叶厚朴等具有重要的药用价值,其组织培养和高产细胞系的建立能够为批量生产中药材原料药和厚朴酚类药物奠定基础。此外,组培技术还是基因工程技术的基础,将在木兰科植物基因功能验证、品种改良及优良新品种选育等方面发挥更大作用。

