Ca2+通道抑制剂对小麦根毛形成与伸长的影响
杨鹭生,项贵香,李国平*
(1.武夷学院 教务处实践科,福建 武夷山 354300;2.武夷学院 生态与资源工程学院,福建 武夷山 354300)
小麦根毛是由表皮细胞特异化而成顶端封闭、透明的管状突出物,具有扩大根的有效吸收面积从而促进水分与养分吸收的功能[1],当根表皮细胞膨胀后,便开始顶端生长,细胞质和细胞核还有一些新合成的细胞壁物质随着根毛的生长逐渐移到顶端[2]。Ca2+不仅是植物生长所需的大量元素,而且还是胞内重要的第二信使,对植物细胞的运动、伸长及其生理代谢有着重要的作用[3],在根毛的形成和伸长过程中,Ca2+参与细胞壁的重建。根毛顶端的Ca2+流参与控制根毛的生长方向,如增加或减少顶端一侧的外源Ca2+浓度,根毛生长方向将会发生改变[4]。邢树平等[5]用乙二醇二乙醚二胺四乙酸(EGTA)螯合根细胞中的Ca2+,则主根生长、根毛发生和生长都受到抑制,添加外源Ca2+即可消除这种抑制作用,说明了Ca2+在小麦根毛发生和生长中的重要性。根毛的伸长与顶端Ca2+浓度梯度有关,该梯度与顶端细胞质膜上的Ca2+内流有关[6],细胞质膜上的钙离子通道是细胞外Ca2+进入细胞质的主要途径,在细胞内钙离子水平调控过程中具有重要的作用,到目前为止,对植物细胞内钙通道的结构和功能了解较少,钙离子通道抑制剂如何抑制Ca2+进入细胞内尚未明确,而且钙离子通道抑制剂对根毛形成与生长的影响尚未明了[7]。因此本实验以普通小麦为材料,初步观察了不同Ca2+浓度在根毛发生和伸长方面的影响,采用不同的钙离子通道抑制剂对小麦根毛进行处理[8],比较抑制剂的抑制效果,观察根毛长度和数量的变化,观察去除抑制后根毛的生长情况,期望为研究钙离子抑制剂对根毛生长的影响和钙离子通道抑制剂的抑制机理积累资料。
1 材料与方法
1.1 材料
小麦种子购于莆田市秀屿区某种子店,置于室温干燥的地方保存。
1.2 试剂
H33258荧光染色液、3.7%多聚甲醛、1.0×10-2mol/L PBS、吖啶橙染色剂、CaCl2、EDTA、氯化铝、氯化镧、尼莫地平,均为分析纯。
1.3 主要仪器
荧光显微镜(OLYMPUSBX51日本奥林巴斯公司)、电子天平(Sartorius BS224S德国赛多利斯公司)。
1.4 试验方法
1.4.1 不同CaCl2浓度对根毛生长的影响
小麦种子用双蒸水浸泡12 h后,放在铺有湿润纱布的大培养皿中,25~28℃暗培养24 h。挑选刚露白且大小基本一致的种子,放入铺有湿润滤纸的培养皿中(直径9 cm,每皿15~20粒种子)。然后向每个培养皿中加入约10 mL培养液(分别为dd H2O、1.0×10-4、1.0×10-3、1.0×10-2、5.0×10-2、0.1 mol/L的CaCl2),并贴好标签,置于25℃光下3 000 Lx的培养室培养。培养24、48、72 h后,随机取5粒小麦种子,取主根用0.01%吖啶橙染色1~2 min,制片后便可用常规显微镜观察,测量长度时选择距根尖一定距离的根毛,再求其平均值即为该浓度下根毛的长度,统计数量时数主根上一定距离的根毛数量,每组实验重复三次。
1.4.2 钙离子通道抑制剂对根毛的影响
挑选大小基本一致且刚露白的小麦种子放入含有10 mL钙离子通道抑制剂(分别为2.0×10-2、4.0×10-2、6.0×10-2、8.0×10-2、0.1 mol/L的氯化铝、氯化镧、尼莫地平)的培养皿中,培养24、48、72 h后,随机取5粒小麦种子,根毛的观察方法同1.4.1。
1.4.3 钙离子通道抑制剂的减弱与消除
在根毛生长被抑制的条件下培养24 h,往含有钙离子通道抑制剂的第一组培养皿中加入1.0×10-2mol/L CaCl2的培养液,第二组培养皿加入dd H2O,以不添加任何其他培养液的根毛为对照,静置15 min,倒掉一半的混合液继续培养,24 h和48 h定时观察根毛的生长情况。
1.4.4 小麦细胞核的观察
挑选培养一定时间的小麦主根,用多聚甲醛固定1~2 min,PBS洗2~3遍,用滤纸吸干后再滴加H33258荧光染色液(H33258染色时应避光染色),10 min后再用PBS冲洗多余染色液,压片后在OLYMPUSBX 51观察观察拍照。
2 结果与分析
2.1 不同CaCl2浓度对根毛生长的影响
小麦根毛在dd H2O、1.0×10-4、1.0×10-3、1.0×10-2、5.0×10-2、0.1 mol/L CaCl2中培养24、48、72 h后,观察结果见表1。
由表1可知,小麦根毛在1.0×10-4~1.0×10-3mol/L CaCl2培养液中的生长与对照组差异不大,在1.0×10-2mol/L CaCl2培养液中根毛的长度和数量均达到最大值,但在5.0×10-2~0.1 mol/L CaCl2培养液中,小麦根毛长度随浓度的增加不断减少,比对照组减少25%~47%,但根毛数量变化较小。
根尖任一表皮细胞都可能产生根毛,dd H2O处理4 h后根毛在伸长区的突起形态,突起部位一般位于细胞的中前部,根毛生长疏密不定(图1),生毛细胞与非生毛细胞随机排列,说明根毛的生长具有随机性[9]。正常生长的根毛垂直于主根,且不表现出向地性,在伸长区开始形成根毛,分化区根毛成熟,整个主根上根毛的长度不一,如图2。
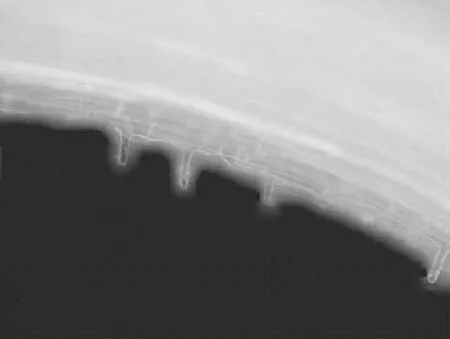
图1 正常小麦根毛的突起部位(20×)Figure 1 The formation of the normal wheat root hair(20×)
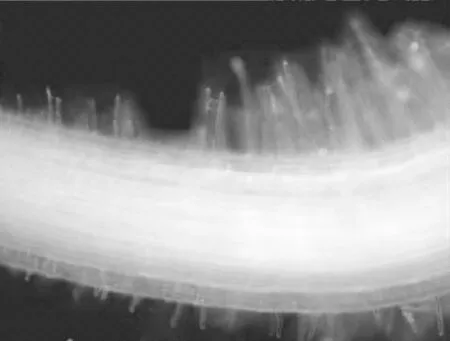
图2 正常生长的根毛(10×)Figure 2 The growth of the normal wheat root hair(10×)
dd H2O处理24 h后经H33258染色液避光染色,在荧光下观察得到的小麦根毛形态图,主根表皮细胞的细胞核随着根毛突起而移向根毛顶端,但细胞核的移动速度往往比根毛的生长速度慢(图3)。随着根毛的生长,成熟根毛的细胞核移至顶端,顶端会发生加厚的现象(图4)。

图3 细胞核随根毛的生长而移动(40×)Figure3 The nucleus move ahead with the growth of root hair(40×)

图4 成熟根毛的细胞核移至顶端(40×)Figure4 Showing the nucleus in the top of the mature root hair(40×)
根毛在dd H2O中培养48 h后,经H33258避光染色并在荧光显微镜下放大100倍,可观察到根毛的单个细胞拟长方形,细胞核被液泡挤压到细胞壁(图5)。把小麦主根的四分之三浸泡在1 mol/L CaCl2溶液中培养24 h,可观察到露在空气中的根毛生长速度明显大于浸在0.1 mol/L CaCl2中根毛的生长速度(图6)。如果把小麦根系完全浸于培养液内,难以观察到根毛的发生,所以在实验过程中应根据所用培养皿的大小和滤纸的多少,加入一定体积的培养液,使小麦主根长出后正好一面接触培养液,其它各面暴露在空气中以利于观察。

图5 成熟根毛的单细胞(100×)Figure 5 The single cell of the mature root hair(100×)
2.2 EDTA对小麦根毛生长的影响
往含有1.0×10-2mol/L CaCl2的培养基中加入不同浓度的EDTA,实验结果见表2。
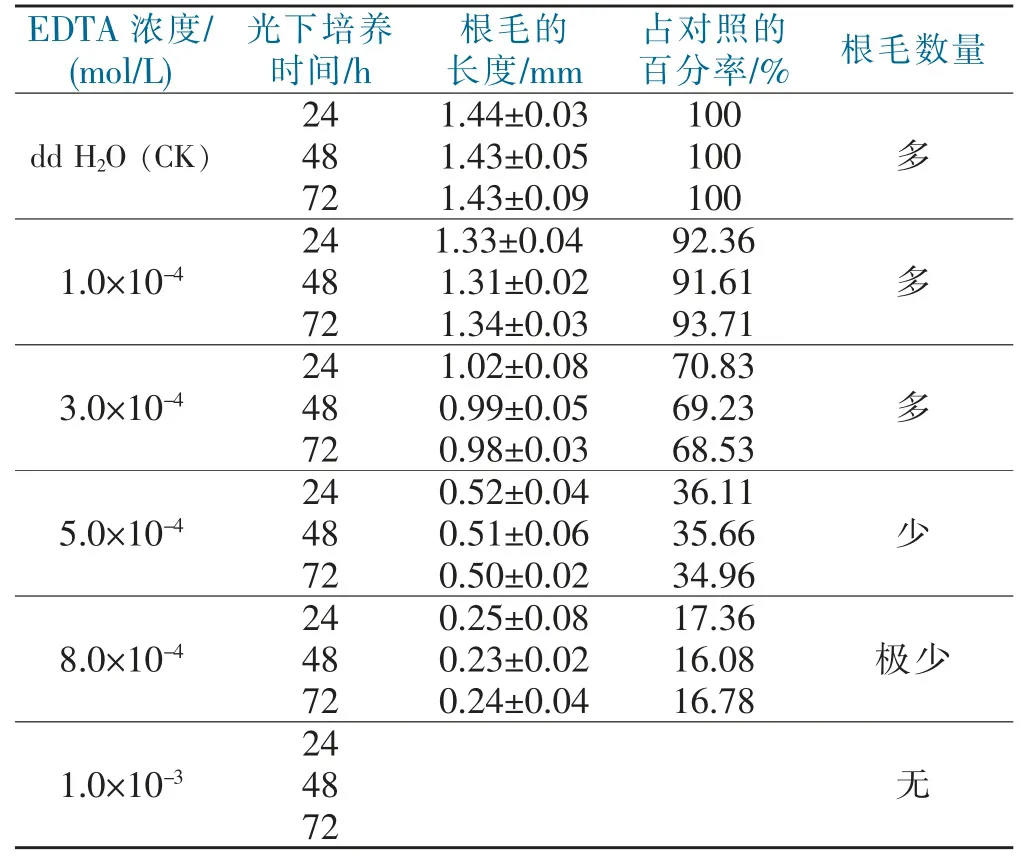
表2 EDTA对小麦根毛形成与伸长的影响Table 2 The effects of different concentrations of EDTA on the formation and growth of wheat root hair
由表2可知,不同浓度的EDTA对小麦根毛的形成与伸长抑制程度不同。1.0×10-4~3.0×10-4mol/L EDTA对根毛的影响比较小,根毛数量较多,长度比对照减少8%~30%。3.0×10-4~5.0×10-4mol/L EDTA,根毛长度急剧变短,长度比对照减少30%~66%。浓度在5.0×10-4mol/L以上时,根毛受抑制明显,根毛数量变少,而且长度极短,比对照少66%~84%。在1.0×10-3mol/L EDTA培养条件下,小麦根毛严重受阻,并且无根毛形成(见图7)。
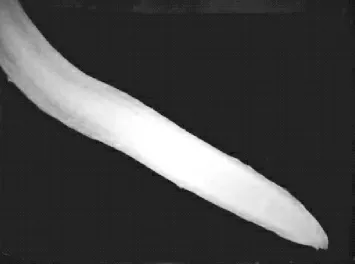
图7 1.0×10-3 mol/L EDTA处理抑制根毛形成(4×)Figure 7 The treatment of 1 mmol/L EDTA completely inhibit the growth of root hair(4×)
EDTA能螯合细胞中的Ca2+,而且随着EDTA浓度的增大,根毛的长度和数量变化明显,用1.0×10-3mol/L EDTA处理24 h后,根毛生长完全受到抑制(图7)。
2.3 钙离子通道抑制剂对根毛生长的影响
以氯化铝、氯化镧、尼莫地平为抑制剂,浓度梯度分别设为2.0×10-5、4.0×10-5、6.0×10-5、8.0×10-5、1.0×10-4mol/L,测量根毛的长度,结果见图8。
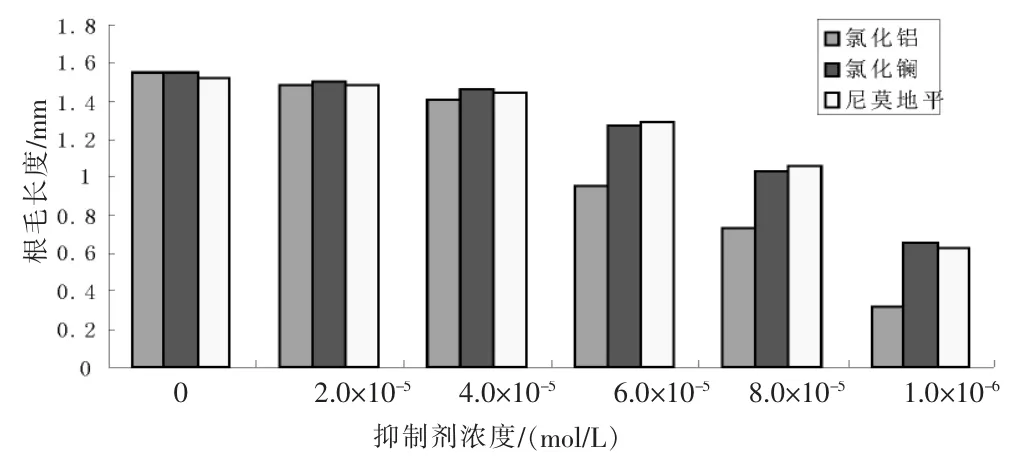
图8 不同抑制剂对根毛生长的影响Figure 8 The effects of different calcium channel blockers on the growth of wheat root hair
由图8可知,抑制剂的抑制效果与浓度有关,浓度越大抑制能力越强。浓度为2.0×10-5~4.0×10-5mol/L时,氯化铝、氯化镧和尼莫地平的抑制效果均不明显,根毛的生长情况较好;浓度为6.0×10-5~8.0×10-5mol/L时,氯化铝处理过的根毛长度急剧变短,长度比对照组减少39%~53%,而氯化镧和尼莫地平处理过的根毛长度变化较不明显,均比对照减少20%~30%;浓度达到1.0×10-4mol/L时,氯化铝严重抑制根毛的生长,根毛长度比对照组减少79%。可见不同钙离子通道抑制剂的作用效果不同,无机抑制剂的氯化铝作用效果比氯化镧和尼莫地平强。
2.4 钙离子通道抑制剂的减弱与消除
在根毛完全受抑制的条件下培养24 h,再往培养皿中分别加入dd H2O、1.0×10-2mol/L CaCl2的培养液混匀后静置培养24 h和48 h观察,以未处理的根毛作对照,结果见表3。
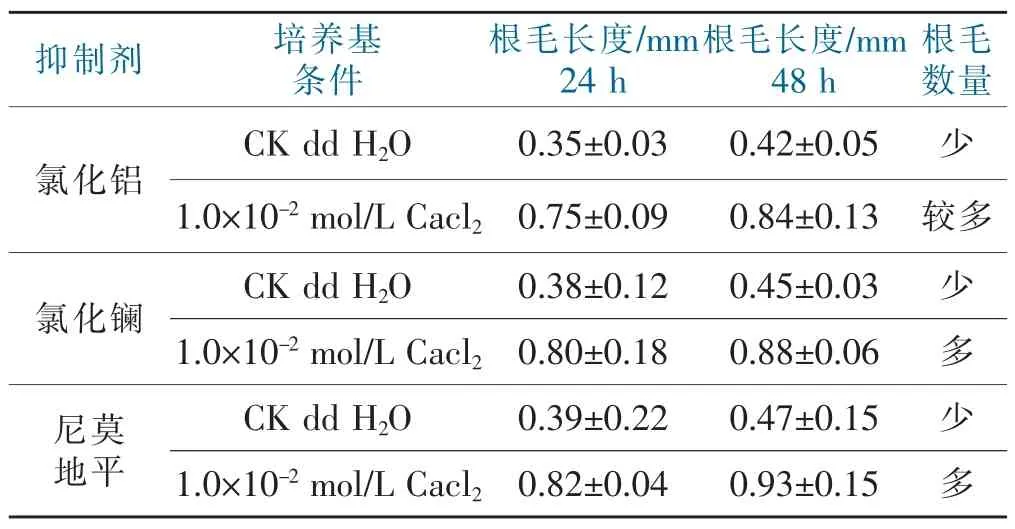
表3 外源Ca2+对抑制剂的减弱与消除Talle 3 The weakening and elimination effect of exogenous Ca2+on the inhibition of calcium channel blocker
由表3可知,对照组没有根毛发生,外加的dd H2O和1.0×10-2mol/L CaCl2溶液均能够减弱抑制剂的抑制作用,并且形成少量比正常成熟根毛短的根毛,用dd H2O培养时根毛的生长速度缓慢,从开始加入dd H2O至培养24 h,根毛的生长速度比较快,而24~48 h,根毛的长度变化不明显,但仍然有伸长的现象。外加1.0×10-2mol/L CaCl2溶液恢复根毛的生长的能力比较强,并且根毛数量明显增多。说明减小抑制剂的浓度或者添加外源Ca2+均能减弱或消除抑制剂的抑制作用。
加入1.0×10-2mol/L CaCl2培养24 h后,根毛可以恢复生长,但是根毛长度短于正常根毛的长度,根毛数量较多(图9)。根毛形态发生变化,平滑的根毛会发生弯曲,且有部分折叠的现象(图10)。

图9 抑制解除后根毛恢复生长(4×)Figure 9 The formation and growth of root hair recovered after disinhibition(4×)
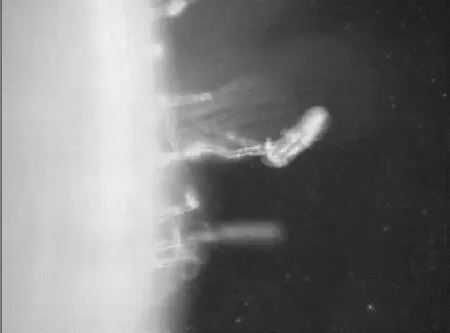
图10 抑制解除后根毛发生弯曲(20×)Figure 10 The root hair curved after disinhibition
3 讨论与结论
钙离子对小麦根毛形成和伸长生长具有重要调控作用[5]。本实验结果表明,1.0×10-4~1.0×10-3mol/L Ca2+对小麦根毛的生长影响不大,而且在dd H2O培养下小麦能够正常生长,说明小麦种子内含有一定游离的钙离子能够满足初期生长发育所需。1.0×10-2mol/L CaCl2对根毛生长具有促进作用。然而并不是浓度越高越能促进生长,当5.0×10-2~1.00×10-1mol/L Ca2+时根毛的生长受到抑制,可能是外源Ca2+浓度太高会抑制IP3受体系统调节外源Ca2+的进入,阻碍钙离子通道的开放,因此根毛的长度变短,但对根毛的数量影响不大[10]。用不同浓度的EDTA加到含有1.0×10-3mol/L Ca2+的培养基中,浓度3.0×10-4mol/L EDTA开始对根毛有明显的抑制作用,1.0×10-2mol/L EDTA处理时根毛完全不生长,说明EDTA能够螯合根毛自身存在或者游离的Ca2+,与Ca2+形成稳定的水溶性络合物,从而抑制根毛的生长。
不同的Ca2+通道抑制剂对小麦根毛生长有不同的抑制效果,无机抑制剂氯化铝的抑制作用最强,La3+和Al3+会减弱原生质体的Ca2+流动,也会影响细胞质膜和液泡膜囊泡上的Ca2+流动。尼莫地平对原生质体、细胞质膜、液泡膜囊泡以及内质网膜上的钙通道影响比较小,但会减弱钙通道的开放程度也会使钙离子通道的开放时间缩短,因此对小麦根毛表现抑制作用,但抑制效果没有氯化铝明显[7]。去除抑制剂后分别加入dd H2O和1.0×10-2mol/L的Ca2+,根毛恢复生长的能力为1.0×10-2mol/L CaCl2>ddH2O>CK,再次说明Ca2+在根毛生长中的重要性。本研究从细胞水平观察根毛细胞的生长情况和形态结构来推断钙离子通道抑制剂的抑制强度,还未能深入到分子水平研究钙离子通道的分子结构和开关机制,而且还不能说明钙信号对植物细胞代谢、生长发育的具体影响,抑制机理尚不明确,如抑制剂是如何通过控制分子开关来调节钙离子的出入等,因此Ca2+对小麦根毛生长发育的研究有待进一步深入。

