高良姜素对卵巢癌A2780细胞增殖、迁移和凋亡影响的研究
任春慧 冯 晨 李婉玉 方 超 毛艺纯 冯 华*
(1.牡丹江医学院附属红旗医院核磁共振科,黑龙江 牡丹江,157011;2.牡丹江医学院附属红旗医院骨外一科,黑龙江 牡丹江,157011;3.牡丹江医学院病理生理学教研室,黑龙江 牡丹江,157011)
卵巢癌(ovarian cancer,OC)是女性生殖系统最常见的恶性肿瘤之一。约80%患者就诊时已处于晚期。其常规治疗方法是手术切除联合化疗药物,但预后并不十分理想[1-2]。高良姜素(Galangin,GLA)是中药高良姜的主要活性成分,其不仅具有抗炎、抗氧化、降血脂等作用,而且表现出一定的抗癌活性[3-5]。有研究表明PI3K/AKT信号通路是肿瘤细胞内最重要的信号转导通路之一,在肿瘤细胞增殖、迁移、侵袭、凋亡、细胞周期进程及血管形成中发挥着重要作用[6-8]。本研究以GLA为研究对象,旨在探讨GLA是否对卵巢癌A2780细胞增殖、迁移以及凋亡能力产生影响,以及是否通过PI3K/AKT信号通路产生抑癌作用。
1 材料与方法
1.1 材料
1.1.1 试剂
GLA(G100561),相对分子量270.24(MW),纯度>98%,购自上海阿拉丁生物科技有限公司。卵巢癌A2780细胞购自 武 汉procell公 司;GAPDH(WL01114)、AKT(WL0003b)、p-AKT(Ser473)(WLP001a)、Bcl-2(WL01556)和Bax(WL01637)抗体(万类生物,沈阳);CCK-8试剂盒(博士德,武汉);BCA蛋白定量试剂盒(北京普利莱基因技术有限公司);TUNEL细胞凋亡试剂盒(碧云天,武汉);流式凋亡检测试剂盒(万类生物,沈阳)。
1.1.2 仪器设备
酶标仪(生产企业:Molecular Devices公司,型号:SpectraMax 190);荧光正置式生物显微镜(生产企业:日本尼康公司,型号:Eclipse Ci-L);流式细胞仪(生产企业:美国BD公司,型号:Accuri C6);CO2恒温细胞培养箱(生产企业:日本三洋公司,型号:MCO-20AIC)。
1.2 方法
1.2.1 细胞培养
将卵巢癌A2780细胞加入含10%胎牛血清、1%青霉素和链霉素的RPMI 1640培养基中,置于37℃、5% CO2的培养箱培养,根据细胞生长情况,隔天换液,镜下观察细胞密度达到70%~80%时可以进行传代。细胞每隔2~3天传代一次。
1.2.2 CCK-8法
A2780细胞经胰酶消化后,离心5 min,1 000 rpm/min,离心半径10 cm;制备悬液;使用细胞计数板计数,以8×103个/孔的细胞密度培养于96孔培养板中过夜,每孔加入100 μL完全培养基,平行设置3个重复孔,用不同浓度梯度GLA(0 μmol/mL、1 μmol/mL、5 μmol/mL、10 μmol/mL、20 μmol/mL、30 μmol/mL、40 μmol/mL、50 μmol/mL、60 μmol/mL、70 μmol/mL、80 μmol/mL)作用于A2780细胞24 h后,向每孔中加入10 μL CCK-8试剂,将96孔培养板置入CO2培养箱中继续孵育1~2 h。于酶标仪450 nm处测定OD值,根据测定的OD值绘制细胞存活率的柱状图,细胞存活率(%)=[OD(实验组)-OD(空白对照组)]/[OD(正常对照组)-OD(空白对照组)]×100%。确定不同浓度作用下GLA对于卵巢癌SKOV3和A2780细胞的影响;计算A2780细胞的IC50值,IC50=1 g-1[Xm-i(∑p-0.5)]。根据IC50值,选取细胞生存率>60%且数值较高浓度作为GLA给药浓度,用于后续实验。同时再根据实验分组,采用不同时间点(24 h、48 h、72 h)的不同浓度GLA作用于卵巢癌A2780细胞,于酶标仪450 nm处测定各组OD值,根据测定的OD值绘制细胞生存曲线。
1.2.3 细胞分组
取对数生长期细胞加入不同浓度GLA,根据GLA对于卵巢癌A2780细胞的IC50值确定加药浓度,共分为4个组:①对照组,即0 μmol/mL组;②10 μmol/mL 组;③20 μmol/mL组;④40 μmol/mL组。
1.2.4 细胞划痕实验
细胞传代,以5×106个/孔细胞将A2780细胞常规培养于6孔板中,倒置显微镜下观察,当培养的细胞融合达到80%以上时,用200 μL移液器吸头在6孔板内做划痕,每孔用PBS缓冲液冲洗漂浮细胞,再分别加入不同浓度(0 μmol/mL、10 μmol/mL、20 μmol/mL、40 μmol/mL)的GLA,在无血清的培养基中继续培养。在倒置光学显微镜下,分别于0 h,24 h,48 h在40倍的放大倍数下拍照获得图片。用Image J软件测量划痕面积。细胞迁移率=(0 h划痕面积-24 h/48 h划痕面积)/0 h划痕面积×100%。
1.2.5 流式细胞术
细胞传代,以5×105个/孔将卵巢癌A2780细胞常规培养于6孔板中过夜,再分别加入0 μmol/mL、10 μmol/mL、20 μmol/mL和40 μmol/mL的GLA在CO2培养箱中继续培养24 h,将每孔中的细胞用不含EDTA的胰酶消化,将细胞重悬于1 mL预冷的PBS(pH 7.2~7.3)中洗涤2次;调整转速为1 500 rpm/min,离心半径6.5 cm,离心10 min;弃上清,加入500 μL比例为1∶100的Binding buffer;在膜联蛋白结合缓冲液中孵育细胞制备悬浮液,在室温避光5 min后,首先添加5 μL的Annexin V-FITC,再次添加10 μL的Propidium Iodide进行染色,室温下避光孵育15 min。在1 h以内用流式细胞仪上机检测凋亡细胞的百分比,细胞凋亡率(%)=(凋亡细胞数/总体细胞数)×100%,早期凋亡和晚期凋亡细胞均记为凋亡细胞。实验重复3次。
1.2.6 TUNEL实验
细胞传代,以每孔接种1×105个细胞将A2780细胞接种于24孔板中过夜,再分别加入不同浓度(0 μmol/mL、10 μmol/mL、20 μmol/mL和40 μmol/mL)的GLA在CO2培养箱中继续培养细胞24 h,胰酶消化,用PBS缓冲液冲洗2次,将细胞于4%的多聚甲醛在pH 7.4的NaH2PO4溶液中固定30 min,PBS缓冲液洗涤细胞3次,切片浸于0.3%Triton X-100中透化5 min;用PBS缓冲液冲洗3次;在37℃避光情况下向样品中加入TUNEL 检测液(50 μL TdT 和450 μL 荧光素标记的dUTP液),避光,37℃孵育60 min;DAPI室温下复染细胞核15 min;将细胞放入终止缓冲液孵育10 min,蒸馏水冲洗,抗荧光衰减封片剂封片,荧光显微镜(生产企业:日本OLYMPUS,型号:Olympus BX51)下观察阳性细胞数,TUNEL阳性产物呈现绿色荧光,DAPI染色细胞呈现蓝色荧光。100倍放大视野下随机选取7个位置进行拍照,并进行细胞计数,凋亡细胞百分比=绿色荧光细胞数/蓝色核细胞数×100%。
1.2.7 Western Blot法
细胞传代,取卵巢癌A2780细胞接种于6孔板中,孵育过夜后用不同浓度(0 μmol/mL、10 μmol/mL、20 μmol/mL和40 μmol/mL)的GLA处理细胞24 h,胰酶消化,用4℃预冷的PBS缓冲液冲洗2次,加入RIPA裂解液(RIPA∶PMSF=100∶1),置于冰上裂解0.5~1 h;小心用细胞刮刀将细胞沿同一方向刮下,移入1.5 mL EP管中;在4 ℃、12 000 rpm/min(离心半径6.5 cm)下离心15 min,小心吸取上清液至标记的预冷1.5 mL EP管中。将蛋白样品利用BCA法测定蛋白浓度,根据BCA测定试剂盒说明书,配制蛋白标准溶液,根据检测样品数量,配制所需BCA工作液,按50(A液):1(B液)比例,充分混匀备用;将制备好的蛋白标准溶液和蛋白样品加入到96孔板中,向标准孔和样品孔中加入BCA工作液,200 μL/孔,在37℃培养箱中继续培养30 min;用酶标仪测定562 nm波长处每孔的OD值,根据不同浓度标准蛋白品的OD值,绘制标准曲线,计算样品中总蛋白浓度;计算出Western Blot实验所需上样量。按照4(5×蛋白上样缓冲液):1(蛋白样品)配制,100℃金属浴加热变性10 min,用于后续Western Blot实验。将等量的蛋白样品加入到12%SDS-聚丙烯酰胺凝胶,进行电泳分离,恒流200 mA转膜2 h左右。用5%脱脂奶粉对PVDF膜进行封闭,加入稀释的一抗Bcl-2(1∶500),Bax(1∶500),p-AKT(1∶500),AKT(1∶500)以 及GAPDH(1∶500),4 ℃冰箱孵育过夜。次日将过夜的一抗回收,加入TBST洗液,洗涤3次,10 min/次,加入按1∶5 000稀释的二抗室温孵育1 h,然后TBST洗涤3次,10 min/次,在避光条件下配制所需ECL发光液,现用现配,配制比例为A液∶B液=1∶1,备用。将PVDF膜上均匀涂满ECL发光液,在化学发光成像仪(生产企业:美国GE公司,型号:Amersham Imager600)下显影,GAPDH为内参,用Image J软件计算灰度值。实验重复3次。
1.3 统计学分析
2 结果
2.1 GLA对卵巢癌A2780细胞增殖的影响
CCK-8法结果显示,在加入了GLA的卵巢癌A2780细胞株中,细胞增殖率减慢,且随着GLA浓度增加,细胞增殖率越低。见图1A。根据酶标仪测得450 nm的OD值计算GLA对A2780细胞的半数抑制浓度(IC50)约为52.10 μmol/mL。当GLA浓度达到50 μmol/mL时,A2780细胞存活率不足60%,故将GLA用药浓度梯度分别设定为0 μmol/mL(即对照组)、10 μmol/mL、20 μmol/mL和40 μmol/mL。细胞增殖曲线结果显示,随着药物作用时间的延长和药物浓度的增加,与对照组相比,GLA组细胞存活率显著降低,差异具有统计学意义(P<0.01)。见图1B。
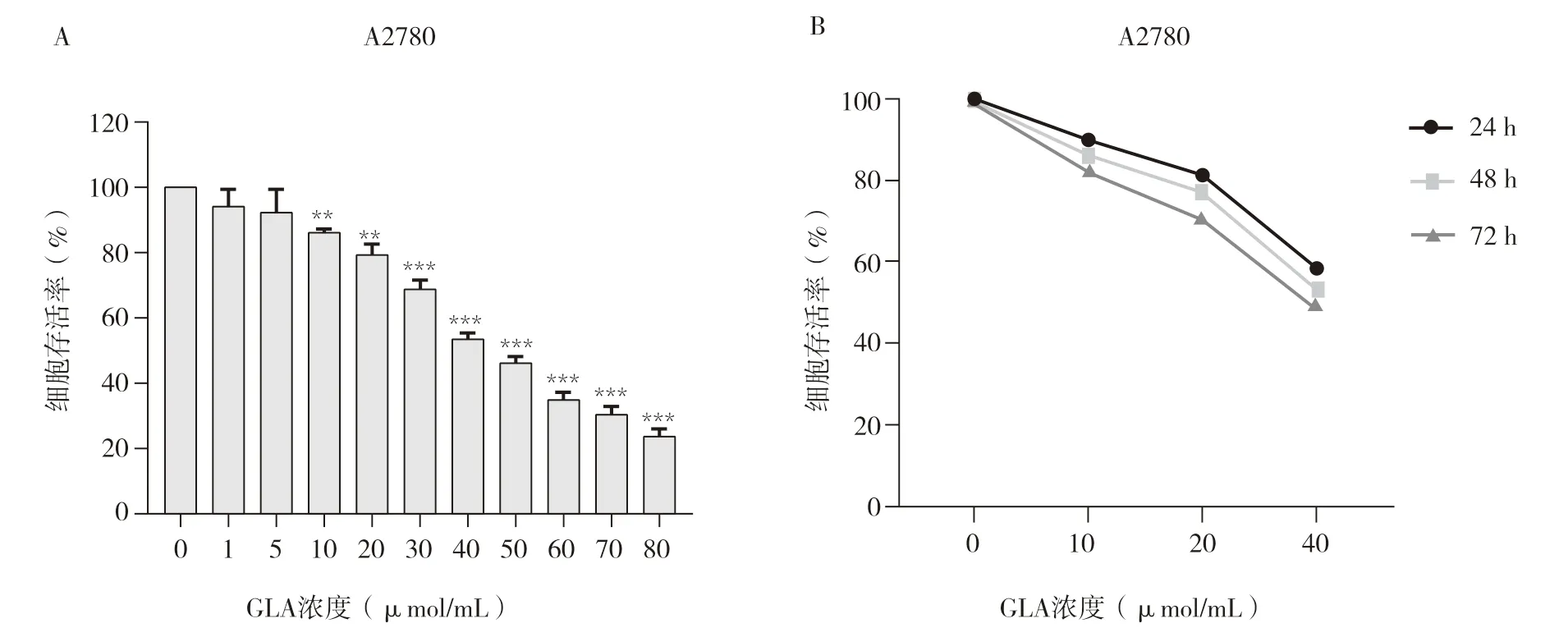
图1 GLA对卵巢癌A2780细胞增殖的影响
2.2 GLA对卵巢癌A2780细胞迁移的影响
细胞划痕实验结果表明,在划痕24 h和48 h后,和对照组相比,GLA各组细胞迁移率逐渐降低,划痕48 h的细胞迁移率明显大于划痕24 h的细胞迁移率。见图2A。A2780细胞在划痕24 h后,对照组细胞迁移率为(67.83±2.7)%,而GLA组 细 胞 迁 移 率 分 别 为(45.33±2.5)%(P<0.05)、(29.67±7.2)%(P<0.01)、(26.67±3.7)%(P<0.01);在 划痕48 h后,对照组细胞迁移率为(86.50±3.5)%,而GLA组细胞迁移率分别为(59.67±4.1)%(P<0.05)、(49.33±5.0)%(P<0.01)、(30.33±4.9)%(P<0.001)。见图2B。表明GLA可抑制A2780细胞的迁移能力,呈剂量依赖性关系。

图2 GLA对卵巢癌A2780细胞迁移的影响
2.3 GLA对卵巢癌A2780细胞凋亡的影响
流式细胞术结果显示,不同浓度GLA作用于A2780细胞,对照组的总细胞凋亡率为(5.27±0.82)%,而GLA组的总细胞凋亡率分别为(6.84±0.82)%,(11.77±0.6)%,(17.79±1.14)%,各组实验数据差异均有统计学意义(P<0.05)。在TUNEL实验中,TUNEL染色细胞呈现绿色荧光,DAPI染色细胞呈现蓝色荧光,以TUNEL阳性细胞数与DAPI染色细胞总数之比表示凋亡率。结果显示,不同浓度GLA作用于A2780细胞,对照组细胞凋亡率最低,而GLA各组随着药物浓度的提升,细胞凋亡率呈逐渐上升趋势,差异有统计学意义(P<0.05)。数据量化见表1。为了进一步阐明GLA诱导细胞凋亡的机制,应用Western Blot实验检测不同浓度GLA作用于A2780细胞其Bcl-2和Bax蛋白的表达情况。与对照组相比,GLA各组Bcl-2表达降低,而Bax表达升高,呈浓度依赖性,差异有统计学意义(P<0.05)。见图3A、B、C。数据量化见表2。结果表明,GLA以剂量依赖性诱导A2780细胞的凋亡。
表1 A2780细胞各实验组细胞凋亡率 (±s,%)

表1 A2780细胞各实验组细胞凋亡率 (±s,%)
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001。
组别 细胞凋亡率GLA(0 μmol/mL) 5.97±0.12 GLA(10 μmol/mL) 26.03±4.82*GLA(20 μmol/mL) 33.98±2.87**GLA(40 μmol/mL) 62.20±4.94***
表2 A2780细胞各实验组Bcl-2、Bax蛋白相对表达量 (±s)

表2 A2780细胞各实验组Bcl-2、Bax蛋白相对表达量 (±s)
注:与对照组相比,*P<0.05,**P<0.01。
组别 Bcl-2 Bax GLA(0 μmol/mL) 1.0±0.1 1.0±0.08 GLA(10 μmol/mL) 0.89±0.08* 1.36±0.1*GLA(20 μmol/mL) 0.70±0.06* 1.61±0.07*GLA(40 μmol/mL) 0.62±0.05* 1.85±0.19**
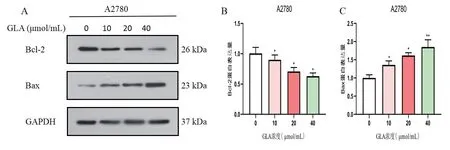
图3 GLA对卵巢癌A2780细胞凋亡蛋白的影响
2.4 GLA对卵巢癌A2780细胞PI3K/AKT信号通路蛋白的影响
应用Western Blot实验检测经过不同浓度GLA干预后,A2780细胞PI3K/AKT信号通路相关蛋白表达情况。结果显示,与对照组相比,GLA各组AKT蛋白表达差异无统计学意义(P>0.05),而p-AKT蛋白的表达显著下调。p-AKT/AKT的比率呈下降趋势,并且呈浓度依赖性,差异有统计学意义(P<0.05)。见图4A、B。数据量化见表3。

图4 GLA对卵巢癌A2780细胞PI3K/AKT信号通路蛋白的影响
表3 A2780细胞各实验组p-AKT/AKT蛋白相对表达量 (±s)

表3 A2780细胞各实验组p-AKT/AKT蛋白相对表达量 (±s)
注:与对照组相比,*P<0.05。
组别 P-AKT/AKT GLA(0 μmol/mL) 1.0±0.12 GLA(10 μmol/mL) 0.81±0.06*GLA(20 μmol/mL) 0.71±0.06*GLA(40 μmol/mL) 0.58±0.08*
3 讨论
随着人口老龄化的不断上升,OC患者每年以数十万的速度持续增长,OC已经成为影响女性生活质量的关键要素之一,并且在一些相对不发达国家,防治形势更为严峻。目前临床上主要缺乏对早期卵巢癌患者特异性诊断方法和行之有效的治疗药物。因此,寻找新的抗肿瘤药物已成为目前攻克卵巢癌急需解决的关键问题。GLA作为一种合成类抗癌药物,脂溶性较强,通过与癌细胞内蛋白质的融合从而进入其内部来发挥作用。卢丹等[9]发现GLA不仅可以通过线粒体途径促进胰腺癌PCNA-1细胞凋亡,而且还可以调控LC3-II/LC3-I和P62蛋白表达诱导细胞自噬。还有学者研究表明GLA可以抑制肾癌细胞增殖、迁移和侵袭,并通过线粒体途径诱导细胞凋亡[10]。
PI3K/AKT信号通路是OC最常见的重要通路,受某些转录因子和甲基化修饰的调控,其活性对于平衡细胞增殖和细胞死亡至关重要[11-12]。其对下游的底物分子和蛋白质进行调控,包括PI3K家族成员激活、PTEN功能失调、AKT1和AKT2扩增和mTOR活性降低等[13-15]。当AKT受到刺激之后,会发生磷酸化变成一种多功能蛋白激酶,是机体内重要的信号分子调节点。Gozde等[16]研究证实,AKT的激活可增强肿瘤细胞增殖并抑制其死亡。MK2206是一种变构型AKT抑制剂。它对AKT的亚型表现出了高度特异性的选择,可以同时靶向AKT1和AKT2。当MK2206与中药丹皮酚联合作用于卵巢癌SKOV3和A2780细胞时,这种联合疗法不仅诱导了细胞自噬,而且抑制了小鼠体内肿瘤细胞生长。这说明两种药物形成了有效的治疗组合,可能最大限度发挥了药效动力学,显示出了良好的抗癌效果。但目前国内外文献报道关于在卵巢癌中GLA作用于PI3K/AKT信号通路的相关研究则鲜有报道。
本研究选取GLA作为研究对象,CCK-8结果显示GLA可抑制A2780细胞的增殖能力,并呈时间和浓度依赖性,表明GLA能够抑制卵巢癌A2780细胞增殖活性。其他学者研究表明GLA也可抑制胰腺癌、肺腺癌、胃癌等细胞的增殖。OC的治疗难点不仅是卵巢癌细胞的增殖能力强,还有其强大的侵袭迁移能力更是会对临床治疗造成巨大的阻碍。细胞侵袭和迁移能力是评估肿瘤细胞恶性程度的一项重要指标[17-19]。通过划痕实验发现经过GLA干预后的卵巢癌A2780细胞向划痕区域移行减慢,其在划痕24 h和48 h的迁移率明显低于对照组。实验结果证明了GLA能够显著抑制卵巢癌A2780细胞的迁移能力,呈剂量依赖性。细胞凋亡可被一些突变基因所破坏,从而导致肿瘤细胞处于失控性生长状态,并且能够在复杂的微环境中获得生存信号[20]。本研究应用流式细胞术和TUNEL实验检测出GLA能够诱导卵巢癌A2780细胞的凋亡,并呈现一定的剂量依赖性。Western Blot实验结果显示GLA处理的A2780细胞Bax蛋白表达量增加,Bcl-2蛋白的表达受到了抑制。PI3K/AKT信号传导通路与OC的发生发展密切相关,一直是众多学者研究的重点。在本研究中,GLA组AKT蛋白表达无显著性差异,而p-AKT蛋白的表达显著下调。p-AKT/AKT的比率呈下降趋势,并呈浓度依赖性。结果表明GLA能够显著抑制PI3K/AKT信号通路激活,主要是通过调控PI3K/AKT蛋白磷酸化来发挥作用。
综上所述,GLA可能通过调控PI3K/AKT信号通路来抑制卵巢癌A2780细胞的增殖和迁移,诱导细胞的凋亡。通过上述的实验结果有力地支持了GLA可以作为一种潜在的治疗卵巢癌辅助用药,并提供了理论依据。

