潜在抗氧化剂在年龄相关性黄斑变性中应用的研究进展△
王 星 张岩岩 王利圆 高 睿 赵亮亮
年龄相关性黄斑变性 (AMD)是指随着年龄增加,视网膜组织退化、变薄引起黄斑功能下降,伴随有黄斑下新生血管和瘢痕形成,最终导致中心视力降低的致盲性眼病[1]。根据早期病理改变和临床表现,可分为干性AMD和湿性AMD[2]。干性AMD是最常见的类型,其病程进展较缓慢,以视网膜色素上皮细胞(RPE)萎缩、脂质沉积于Bruch膜形成玻璃膜疣为主要特征[3- 4],病变累及黄斑中心凹会发生中心视力的严重缺失[5];湿性AMD最大特点是血管内皮生长因子(VEGF)诱导的脉络膜新生血管形成[6]。AMD的发病机制涉及氧化应激、炎症、免疫失调和脂质代谢紊乱等诸多方面[7]。活性氧 (ROS) 介导的氧化应激是贯穿视网膜退行性病变整个过程的重要反应[8]。氧化应激本是机体的一种基本保护机制,然而在病理条件下过多的ROS与细胞内大分子反应,便会引起细胞死亡和组织损伤[9];并且RPE在光传导过程中耗氧量高,对氧化应激高度敏感,易受到ROS攻击而损伤甚至死亡[10],坏死性凋亡是氧化应激诱导RPE死亡的主要方式[11]。因此,基于外源性因素和RPE自身特点,持续的氧化应激损伤是AMD发生发展的重要机制之一[12],有效的抗氧化剂是AMD重要的治疗手段。
1 AMD药物治疗现状
近年来,有关AMD治疗的研究发展迅速,从抗炎、抗新生血管生成、抗氧化应激到神经保护、干细胞疗法,再到基因层面的新治疗靶点,治疗手段层出不穷。抗VEGF已作为湿性AMD的一线治疗手段,而干性AMD尚无针对性的治疗方案。目前,内源/外源性抗氧化剂在AMD治疗中具有较大潜力而被广泛研究,尤其是在干性AMD中,有望为AMD治疗提供新思路。
许多新兴的抗氧化剂在临床前细胞或者动物实验中效果明确,可使早期AMD病变进展延缓,显示出良好的发展前景[13]。但是,现有的大多抗氧化剂仍有局限性,药效弱而风险高是其主要的缺点。许多药物治疗后仅能维持视力相对稳定,在一定程度上延缓眼底黄斑变性的进展,但不能明显提高视力。因此,改善已有抗氧化剂存在的问题、寻找更多潜在的药物仍面临巨大挑战,这也提示开展更多、设计更完善的前瞻性临床研究以探索抗氧化剂在临床上转化的可行性至关重要。
2 治疗AMD的潜在抗氧化剂
如今越来越多植物化学物质被发现具有明显抗氧化能力[14-15]和抗衰老特性,包括多酚类、类胡萝卜素、中药单体和甾体生物碱等。其中,多酚类分为黄酮类多酚和非黄酮类多酚,前者主要包括黄酮/黄酮苷、黄酮醇、异黄酮、二氢黄酮、黄烷-3-醇和其他黄酮;后者包括花色素、水解丹宁、原花青素、芪类/二苯乙烯、简单酚酸和苯丙素衍生物等,具体内容见表1。此外,天然植物化学物质还有番茄红素、虾青素、番红花酸、红景天苷和姜黄素这5种类胡萝卜素,小檗碱、枸杞多糖、黄芪多糖、罗布麻宁、川弓嗪和余甘果提取物这6种中药单体,以及澳洲茄胺、蒜黎芦碱这2种甾体生物碱(表2),它们对于以慢性氧化应激及其产物的累积为主要机制的年龄相关性疾病(如AMD)具有积极的预防意义[16],这提示探讨植物化学物质在老年性眼病中的应用潜力是合理的且极具现实意义的。
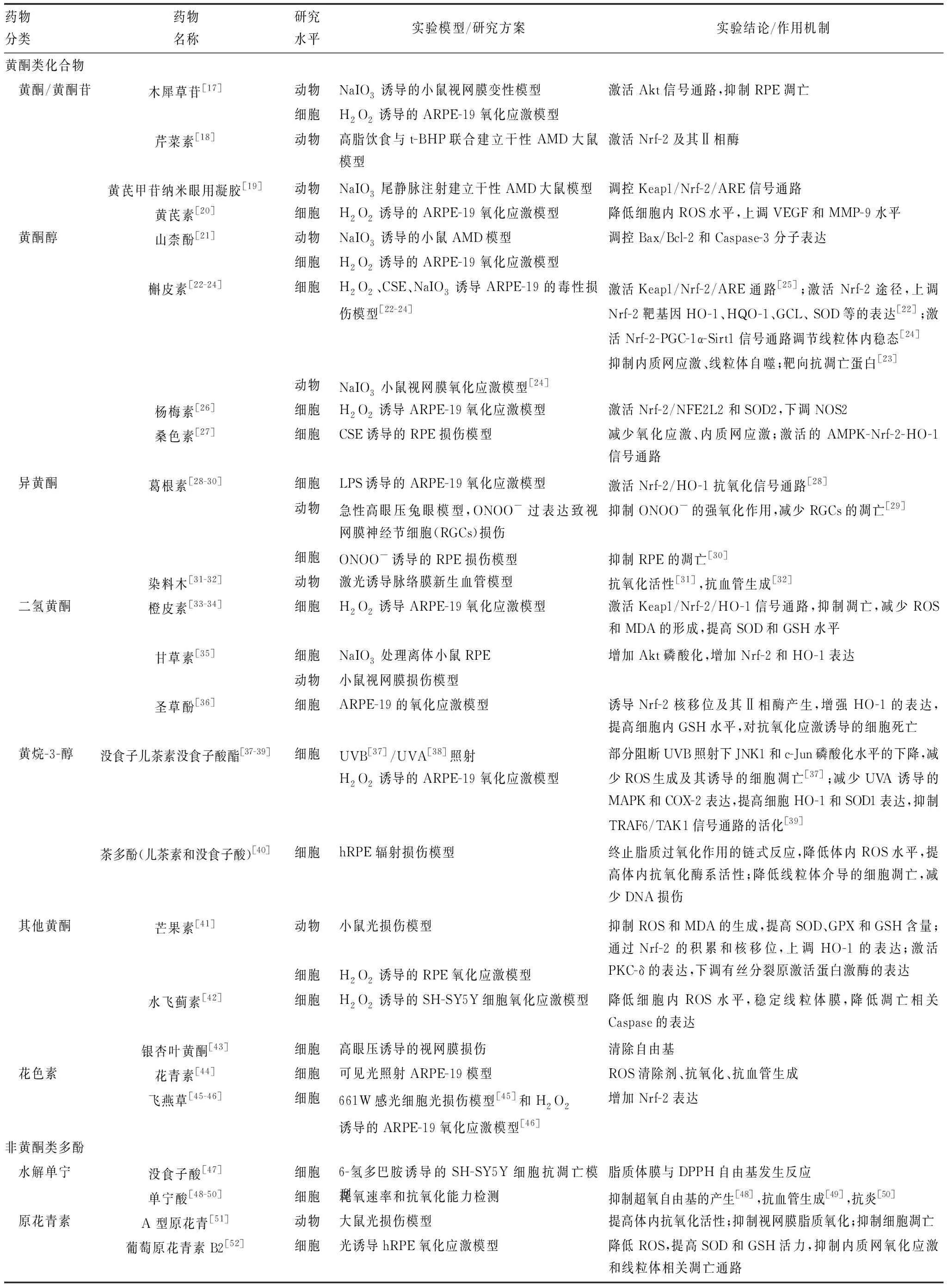
表1 治疗AMD的植物多酚类抗氧化剂

续表1
此外,许多非植物类的天然抗氧化剂,如以硫辛酸和甲钴胺为代表的维生素、以牛磺酸和N-乙酰半胱氨酸为代表的氨基酸衍生物,多不饱和脂肪酸、矿物质等均为AMD抗氧化药物的理想来源(表3)。除了天然存在的物质,人工合成的抗氧化剂虽然种类较少,但由于具有高效可控、生物利用度高等优势也具有极大的研究空间。目前,已有研究发现,N-叔丁基硝酮、普罗布考、纳米氧化铈、姜黄素类似物、柳氮磺吡啶、MG132、MTP131、PARP1抑制剂和D609等均有潜力用于AMD的治疗(表4)。
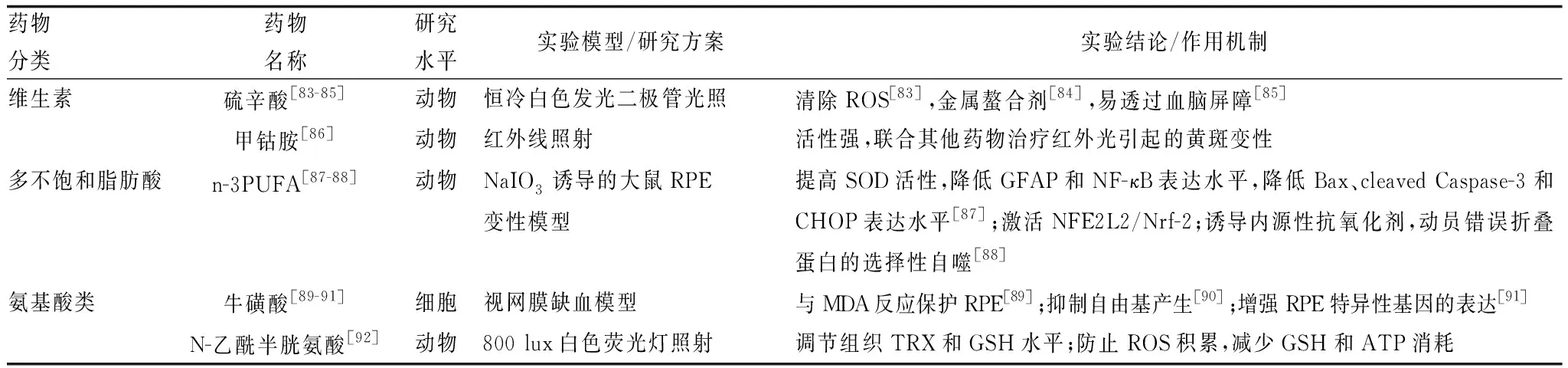
表3 治疗AMD的非植物类天然抗氧化剂
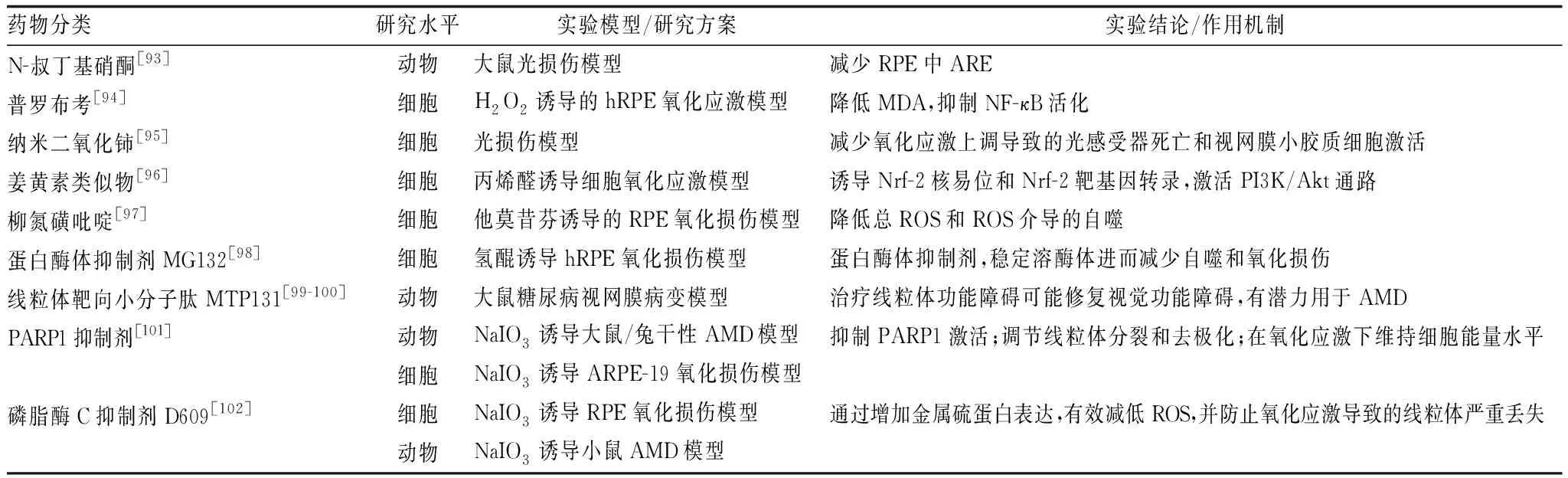
表4 治疗AMD的人工合成的抗氧化活性物质
在机制研究的基础上,已有大量处于不同研究阶段的临床试验来评估众多潜在抗氧化剂转化临床的潜力、明确其在人体使用时的有效性、安全性、起效时间、合适剂量等方面的重要意义(表5),为进一步推广至临床造福患者打下了坚实的基础。
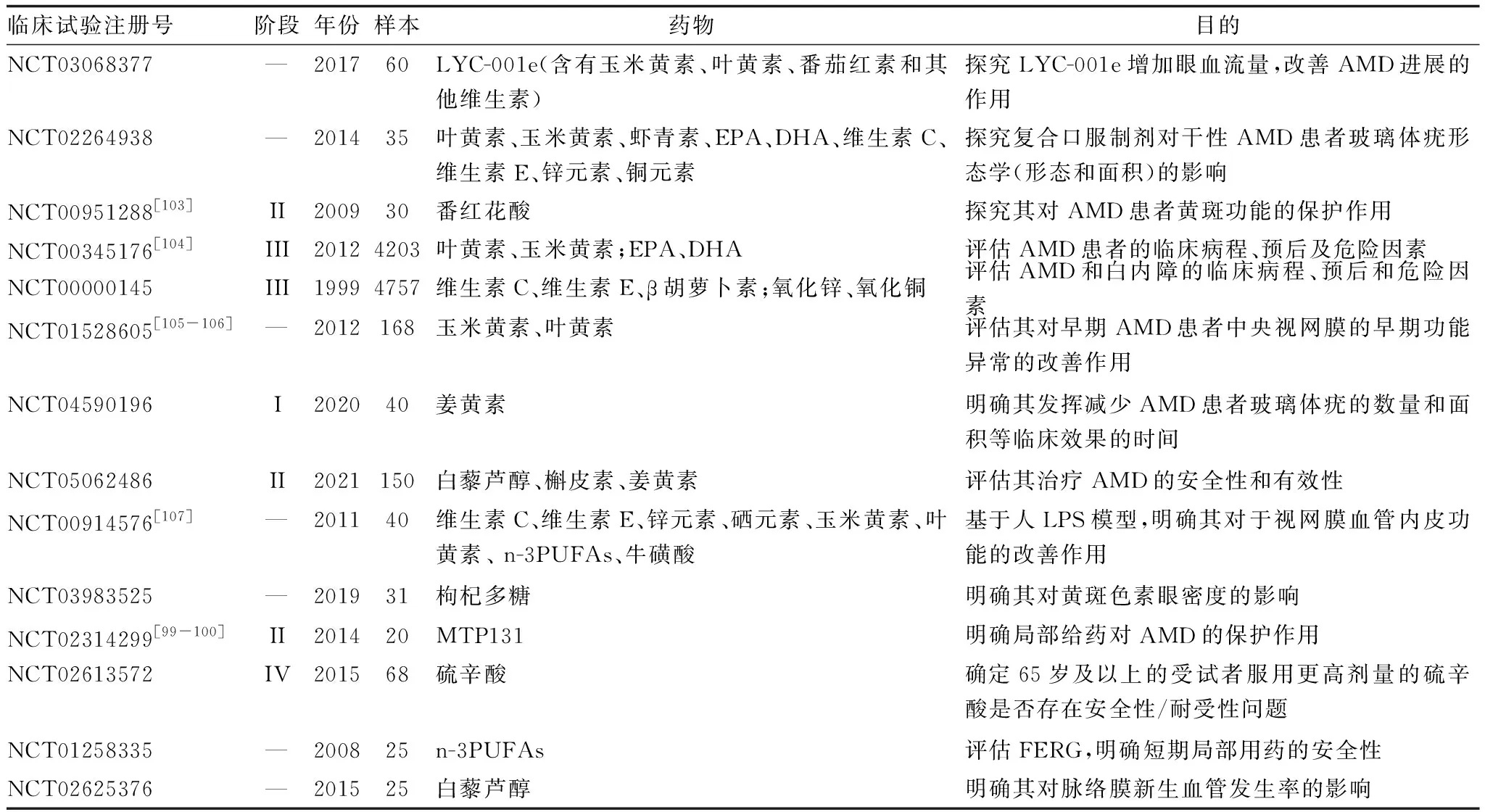
表5 抗氧化剂在AMD中应用相关临床研究的开展现状
2.1 主要研究模型在筛选防治AMD抗氧化制剂之前,需要建立视网膜氧化应激模型。主要分为两大类:一类是光损伤模型,可用光源有可见光、UVA/UVB、蓝光等;另一类为药物诱导模型,可用药物有氧化剂如NaIO3、H2O2、t-BHP、CSE、ox-LDL和细菌细胞壁的成分如LPS、脂磷壁酸(LTA)等。以上方法可用于细胞或动物来建立体外和体内模型,其中,常用的是ARPE-19和661W,而持续性高眼压或缺血再灌注等也可诱导视网膜损伤。
不同造模方法损伤RPE的具体机制各有侧重。与H2O2相比,氢醌诱导的ROS更少,而蛋白质羰基化水平更高、线粒体功能障碍和细胞活力丧失表现更为明显,且氢醌在阻断自噬、增加蛋白酶体活性、破坏溶酶体膜结构和功能上也具有一定作用[98];而NaIO3主要通过降低RPE中组织蛋白酶D的转录,造成溶酶体内铁蛋白降解障碍,导致铁蛋白在溶酶体中累积、释放到细胞外环境,则可能引起铁超载,损害RPE生存能力,引发AMD相应病变[108]。
2.2 主要作用机制各种潜在抗氧化剂发挥作用的具体机制是复杂多样的。其中,植物化学物质发挥抗氧化作用的机制几乎均是围绕核因子E-2-相关因子-2 (Nrf-2)和过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC-1α)在细胞抗氧化/解毒过程中主要的转录因子。有研究发现,Nrf-2/PGC-1α 双敲除的小鼠可表现出明显的AMD病理改变[8,109],这种模型已作为研究干性AMD发生机制极有价值的模型[110]。相应地,有条件地诱导或增强Nrf-2、PGC-1α活性的治疗方法可以实现对氧化应激的保护作用[8]。因此,活化的Nrf-2和PGC-1α诱导剂是极有价值的潜在保护和预防AMD的工具。
Nrf-2作为一种发生氧化应激的光感受器细胞的重要内源性保护因子,在视网膜组织中的表达、核转位及其与抗氧化反应元件结合等过程的增强,可使该因子调控的II相抗氧化酶基因如HO-1、NQO-1和GCL[22,111]、TRX、血红素加氧酶(Hmox-1)[112]等表达上调[10,22,70],进而降低细胞内ROS和MDA水平,提高SOD活性和GSH水平[113],促进细胞活力,抑制细胞凋亡[112],进而保护RPE免受药物、光照等诱导的氧化损伤;同时RPE自噬途径的加速也与Nrf-2激活的细胞保护作用有关[114];相反,Nrf-2缺乏导致NADPH降低放大氧化应激诱导的线粒体功能障碍进而损伤RPE[115],这提示Nrf-2可作为干性AMD的治疗靶点[116]。机制上,许多药物通过各种上游信号分子间接作用于Nrf-2发挥作用,如通过PI3K/AKT/mTOR通路[57]增加Akt磷酸化进而促进Nrf-2表达[111,117];通过Keap1/Nrf-2/ARE通路[25,118]、AMPK-Nrf-2-HO-1通路[119]、SQSTM1/p62[88,120]等直接或间接地激活Nrf-2来发挥抗氧化作用[111,117]。
PGC-1α是另一种参与线粒体能量代谢和生物合成的转录活化因子,对RPE代谢和氧化应激等过程均有调节作用,是RPE线粒体功能和抗氧化能力的重要驱动因子[121]。PGC-1α可通过上调抗氧化酶减轻氧化应激,并对抗其导致的DNA损伤反应[122];作为VEGF的重要调节因子,靶向该分子的药物可用于治疗湿性AMD,还可促进AMD线粒体的生物合成,负调控线粒体功能紊乱导致的细胞衰老,这些均为PGC-1α诱导剂在AMD发生发展中的抗氧化作用提供了理论基础。另外,AMPK和SIRT1对PGC-1α的翻译后修饰是PGC-1α激活的关键[79],也是许多药物微观机制的作用靶点。
此外,许多具有强还原性活性基团的药物可通过电子转移途径直接与RPE自由基反应,如脂质过氧化自由基[58,123-124]等,使其失去活性而被清除。某些药物还可以减少氧化应激的其他来源,如N-叔丁基硝酮可以抑制RPE中的A2E(N-亚视黄基-N-视黄基乙醇胺)光氧化[15],硫辛酸可以螯合铁离子来减少Fenton反应[84]等。姜黄素、绿原酸、普罗布考和多不饱和脂肪酸还可通过降低NF-κB表达水平来影响Bax、Bcl-2基因表达,降低Caspase-3和CHOP等的表达水平[21],进而降低氧化应激介导的RPE凋亡。还有一些药物可以动员错误折叠蛋白的选择性自噬,增强受损的细胞废物,包括AMD特异性的Aβ42肽的清除作用等,进而对抗氧化应激损伤[88];线粒体[99-100]、内质网[125]、溶酶体[98]等许多细胞器稳态的调节剂对于减少氧化应激损伤也发挥着重要的作用。
2.3 新型AMD药物的特点分析药物代谢方面的优势将有效推动AMD新型药物的进一步研究和使用。一方面,潜在的抗氧化剂中存在许多抗氧化能力与生物利用度兼优的药物,如多酚类化合物在人眼中的生物利用度很高。研究表明,圣草酚、木犀草素和槲皮素的生物利用度分别可以达到给药剂量的9%、28%和20%[126]。另一方面,给药方式将更加丰富,黄酮类化合物,如槲皮素和花青素[127-128]等在口服、静脉注射和腹腔给药等多种给药方式后均可以通过血-视网膜屏障,有效发挥抗氧化作用[15],这为从单一的局部给药转向更为方便的口服或者联合用药提供了基础。
不同药物的药理作用、不良反应以及适用人群不一致,这也增加了药物筛选的难度。药理作用方面,某些在其他疾病中具有正向作用的抗氧化剂反而会增加AMD的发病风险。如服用阿司匹林反而使AMD发生风险增加1倍[129];二聚化维生素A可以触发炎症因子和VEGF相关通路,促进AMD的发展[130]。不良反应方面,有些药物呈剂量依赖性,剂量过大时副作用增多,也不是防治AMD的最佳选择[131],如服用高浓度的木犀草素、芹菜素、杨梅素和槲皮素等治疗视网膜疾病时,可能引发细胞坏死,致使RPE活力显著降低[132]。再结合个体化因素,一些药物对特定人群产生不利作用,比如额外的硒摄入可能对身体状况较差的人有益,但身体状况较好的人可能更多表现其有害反应[133],在使用时应密切监测视网膜功能。
3 前景与展望
用于AMD治疗的新型抗氧化剂仍在不断探索挖掘中,如新近开展的向日葵中抗氧化植物化学物质的研究[134]、鸡蛋对于AMD保护作用的研究[135]等。但值得注意的是,新型AMD药物仍存在较大研究空间。目前这些药物研究大多局限于实验层面,对治疗AMD是否真正有效缺乏足够的证据,尚需进一步研究其内在机制,在临床上进一步明确其可行性。随着分子生物学技术发展,我们有望发现更多针对不同靶点、不同疾病阶段的药物,或人工合成安全高效抗氧化剂,为AMD的药物治疗带来新的希望。同时,抗氧化剂联合靶向其他机制药物,既协同增强药效又可减轻不良反应。未来应注重药物作用与患者需求相结合,将生物-心理-社会医学模式作为AMD的药物开发及选择的基本原则。

