苏木提取液调控lncRNA PCNA-AS1对乳腺癌细胞T-47D增殖、凋亡和迁移的影响
贾海明 李英 白文辉 李宗龙( 青海红十字医院乳腺科,青海 西宁 80000;2 绵阳市第三人民医院乳腺科)
据统计,2018年全球乳腺癌新确诊病例高达210 万例,死亡病例达63 万例〔1〕。虽然化疗、放疗和内分泌治疗在消除肿瘤细胞、抑制肿瘤生长、减少乳腺癌复发方面表现出一定优势,但往往伴随着较大的副作用和耐药性。因此,寻找具有抗肿瘤活性的天然产物可能为乳腺癌治疗提供替代策略。苏木是一种广泛分布于东南亚的药用植物,其心材入药具有活血散瘀、祛风止痛功效。现代药理学研究表明,苏木提取液还可诱导胃癌、口腔癌、头颈癌凋亡、抑制细胞生长〔2~4〕。然而苏木提取液在乳腺癌中抗肿瘤作用鲜有报道。增殖细胞核抗原反义RNA(PCNA-AS)1 基因是最近发现的长链非编码(lnc)RNA,有报道称结直肠癌中PCNA-AS1 异常表达与肿瘤浸润及TNM 分期显著相关〔5〕。PCNA-AS1 表达增加促进肝癌细胞增殖〔6〕。然而,PCNA-AS1 在乳腺癌中的功能仍不清楚。本研究通过体外细胞实验探讨苏木提取液对乳腺癌细胞T-47D 增殖、凋亡、迁移的影响,研究其抗肿瘤作用是否与调控PCNA-AS1 相关。
1 材料与方法
1.1 实验材料 乳腺癌细胞T-47D 购于中国科学院上海细胞库;PCNA-AS1 小干扰RNA(si-NC)及其对照(si-PCNA-AS1)、PCNA-AS1 过表达质粒(pcDNA-PCNA-AS1)及其对照(pcDNA)购于广州锐博生物公司;细胞计数试剂盒(CCK-8)、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购于上海贝博生物公司;山羊抗兔IgG 二抗、兔源B 细胞淋巴瘤(Bcl)-2、Bcl-2 相关X蛋白(Bax)、GAPDH 蛋白购于美国CST 公司;MMLV 逆转录酶、SYBR Premix Ex Taq Ⅱ试剂盒购于大连Takara 生物公司。
1.2 苏木提取液的制备 参照文献〔2〕方法制备苏木提取液,取即生药苏木煎煮3 次,每次40 min,合并煎液后将其沉淀、浓缩,3 000 r/min 离心20 min。然后超滤,分离提纯制得。
1.3 细胞培养、转染和分组 T-47D 细胞接种含有RPMI1640 培养基(添加10%胎牛血清、1%青链霉素双抗、0.2 U/ml 胰岛素)的培养瓶,放入37℃、CO2体积分数5%湿润培养箱中培养,每两天换液1 次,80%融合时以胰酶消化细胞按照1 ∶3比例传代。正常培养的T-47D 细胞为对照组。用含25、50、100 μg/ml苏木提取液的培养液孵育细胞48 h分别为苏木低剂量组、中剂量组、高剂量组,按照下述方法步骤检测T-47D 细胞增殖、迁移、凋亡及PCNA-AS1 表达变化。将对数期T-47D 细胞接种6 孔板,细胞60%融合时利用Lipofectamine 2000 将si-NC、si-PCNA-AS1 分别转染细胞,收转染48 h 细胞按照RT-qPCR 步骤检测转染效果。转染si-NC、si-PCNA-AS1 的细胞为si-NC 组、si-PCNA-AS1 组。用含100 μg/ml苏木提取液的培养液孵育转染si-NC、si-PCNA-AS1 细胞48 h 分别为苏木高剂量+pcDNA组、苏木高剂量+ pcDNA-PCNA-AS1。
1.4 CCK-8 实验检测细胞活力 将转染48 h 或未转染T-47D 细胞接种96 孔板,按照实验分组加入不同剂量的苏木提取液,孵育细胞48 h 后,更换为新鲜完全培养基,每孔中添加10 μl CCK-8 溶液在培养箱中继续孵育2 h。在450 nm 波长处用酶标仪测定各孔光密度(OD)值。细胞存活率以实验组和对照组OD 值比值表示。
1.5 平板克隆实验检测细胞克隆形成 每组取5×102个细胞铺于6 孔板,放入培养中常规培养,当出现肉眼可见菌落形成时用4%多聚甲醛固定10 min,再用0.1%结晶紫染色30 min,显微镜下统计菌落形成数(大于50 个细胞菌落为有效菌落)。
1.6 流式细胞术检测细胞凋亡 收获上述各组细胞,用磷酸盐缓冲液洗涤两次,用1×结合缓冲液重悬。按照凋亡检测试剂盒说明用Annexin V-FITC/PI 对细胞进行染色。流式细胞仪检测细胞凋亡情况。细胞凋亡率为早期凋亡(Annexin V-FITC 阳性,PI 阴性)率和晚期凋亡(Annexin V-FITC 阳性,PI 阳性)率之和。
1.7 Western 印迹检测Bcl-2 和Bax 蛋白表达 RIPA 裂解缓冲液裂解细胞,4℃下1 000 r/min 离心15 min收集上清,用蛋白检测试剂盒进行蛋白定量。取等量的蛋白样品进行聚丙烯酰胺凝胶电泳分离,然后转移到硝酸纤维素膜上。室温下用5%脱脂奶粉封闭膜1 h,再用特异性一抗(稀释比例均为1 ∶2 000)在4℃下与膜反应过夜,再用相应的二抗在室温孵育膜1 h。利用化学发光试剂进行显色反应,以Image J 软件分析各条带灰度值。目的蛋白表达量=目的蛋白灰度值/GAPDH 蛋白灰度值
1.8 划痕愈合实验检测细胞迁移 每组取5×105个细胞铺于6 孔板,当细胞生长至融合为一层时用无菌移液枪枪头垂直在细胞表面划一条直线,记为划痕0 h 并拍照。放入37℃、CO2体积分数5%培养箱24 h 为划痕24 h 并拍照。划痕愈合率=(0 h划痕距离-24 h 划痕距离)/0 h 划痕距离×100%
1.9 实时定量PCR(RT-qPCR)检测PCNA-AS1 表达 TRIzol 试剂提取各组细胞总RNA,使用M-MLV逆转录酶合成第一链cDNA,再用SYBR Premix Ex Taq Ⅱ试剂盒荧光定量PCR 上进行RT-qPCR。以GAPDH 为内参,2-ΔΔCt法计算PCNA-AS1 表达量。PCNA-AS1 上游引物5′-TTTGGACATACTGGTGAGG-3′,下游5′-A AGGTGTTGGAGGCACTC-3′;GAPDH上游引物5′-GGAGCGAGATCCCTCCAAAAT-3′,下游5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.10 统计学方法 采用SPSS18.0 软件进行t检验、单因素方差分析和SNK-q检验。
2 结 果
2.1 苏木提取液对T-47D 增殖凋亡的影响 相较于对照组,苏木低、中、高剂量组T-47D 细胞存活率、克隆形成数、Bcl-2 蛋白表达量显著降低(P<0.05),Bax 蛋白表达量、凋亡率显著升高(P<0.05)。且苏木低、中、高剂量组3 组间T-47D 细胞上述指标差异均有统计学意义(P<0.05)。见图1、表1、图2。
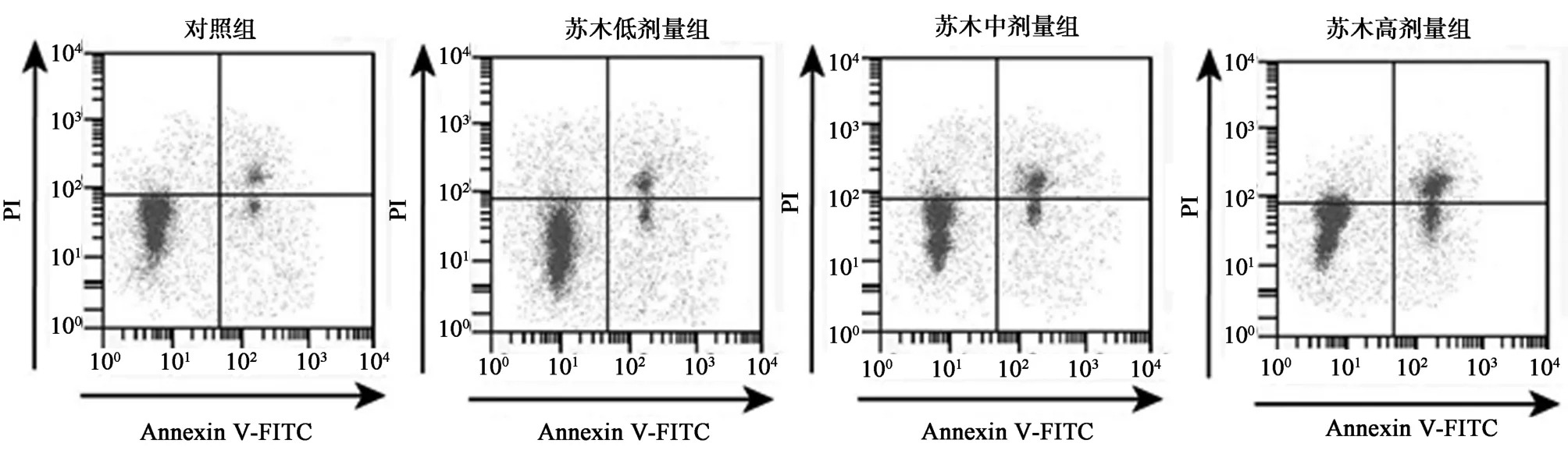
图1 苏木提取液对T-47D 凋亡的影响

图2 苏木提取液对T-47D 凋亡蛋白表达的影响
2.2 苏木提取液对T-47D 迁移及PCNA-AS1 表达的影响 相较于对照组,苏木低、中、高剂量组T-47D细胞划痕愈合率降低(P<0.05),PCNA-AS1表达量降低,差异均有统计学意义(均P<0.05),见表1。
表1 苏木提取液对T-47D 细胞存活率、克隆形成、凋亡、T-47D 迁移及PCNA-AS1 表达的影响(±s,n=3)

表1 苏木提取液对T-47D 细胞存活率、克隆形成、凋亡、T-47D 迁移及PCNA-AS1 表达的影响(±s,n=3)
与对照组比较:1)P<0.05;与苏木低剂量组比较,2)P<0.05;与苏木中剂量组比较,3)P<0.05
分组存活率(%) 克隆形成数(个) 凋亡率(%)BaxBcl-2PCNA-AS1划痕愈合率(%)10.78±0.060.97±0.0666.27±3.67苏木低剂量组86.52±3.671)106.33±6.181)10.29±0.511)0.26±0.021)0.62±0.041)0.80±0.041)50.76±2.571)苏木中剂量组 68.24±3.331)2) 82.33±5.731)2) 15.73±0.781)2) 0.44±0.031)2)0.42±0.031)2)0.66±0.031)2) 43.22±1.861)2)苏木高剂量组 47.82±2.801)2)3) 65.67±5.251)2)3) 23.34±0.861)2)3) 0.64±0.041)2)3) 0.23±0.021)2)3) 0.33±0.021)2)3) 35.00±1.551)2)3)F 值190.19853.706370.463190.400105.523136.00081.835 P 值对照组100.00±0.00125.00±7.356.54±0.340.14±0.0 0.0000.0000.0000.0000.0000.0000.000
2.3 干扰PCNA-AS1 对T-47D 增殖凋亡的影响相较于si-NC 组,si-PCNA-AS1 组T-47D 细胞存活率、克隆形成数、Bcl-2 蛋白表达量显著降低(P<0.05),Bax 蛋白表达量、凋亡率显著升高(P<0.05)。见图3、图4、表2。
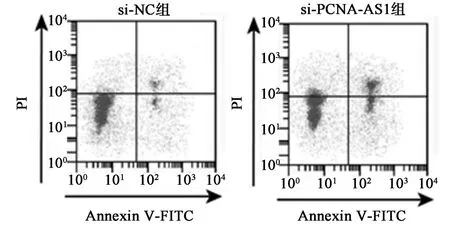
图3 干扰PCNA-AS1 对T-47D 凋亡的影响

图4 干扰PCNA-AS1 对T-47D 凋亡蛋白表达的影响
2.4 干扰PCNA-AS1 对T-47D 迁移的影响 相较于si-NC 组,si-PCNA-AS1 组T-47D 细胞PCNA-AS1 表达量显著降低,划痕愈合率显著降低(P<0.05)。见表2。
表2 干扰PCNA-AS1 对T-47D 存活率、克隆形成及凋亡、T-47D 迁移的影响(±s,n=3)

表2 干扰PCNA-AS1 对T-47D 存活率、克隆形成及凋亡、T-47D 迁移的影响(±s,n=3)
组别存活率(%) 克隆形成数(个) 凋亡率(%)BaxBcl-2PCNA-AS1 划痕愈合率(%)10.78±0.060.98±0.0566.33±3.74 si-PCNA-AS1 组54.46±2.9869.67±5.7920.84±0.790.53±0.040.31±0.020.37±0.0235.68±2.24 t 值26.6499.50628.39316.38312.87119.62012.177 P 值si-NC 组100.00±0.00 124.67±8.186.54±0.370.14±0.0 0.0000.0010.0000.0000.0000.0000.000
2.5 过表达PCNA-AS1 对苏木提取液处理的T-47D增殖凋亡的影响 相较于苏木高剂量+pcDNA 组,苏木高剂量+pcDNA-PCNA-AS1 组T-47D 细胞存活率、克隆形成数、Bcl-2 蛋白表达量升高,Bax 蛋白表达量、凋亡率降低,差异均具有统计学意义(均P<0.05)。见表3、图5、图6。
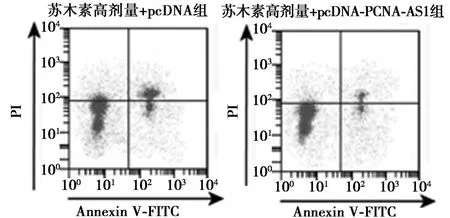
图5 过表达PCNA-AS1 对苏木提取液处理的T-47D 凋亡的影响

图6 过表达PCNA-AS1 对苏木提取液处理的T-47D 凋亡蛋白表达的影响
表3 过表达PCNA-AS1 对苏木提取液处理的T-47D 细胞存活率、克隆形成凋亡及迁移的影响(±s,n=3)

表3 过表达PCNA-AS1 对苏木提取液处理的T-47D 细胞存活率、克隆形成凋亡及迁移的影响(±s,n=3)
组别存活率(%) 克隆形成数(个) 凋亡率(%)BaxBcl-2PCNA-AS1 划痕愈合率(%0.23±0.020.33±0.0234.98±1.62苏木高剂量+pcDNA-PCNA-AS1 组 92.07±4.33 110.00±6.68 7.68±0.480.20±0.020.63±0.050.85±0.0555.80±2.64 t/P 值14.773/0.000 9.440/0.001 26.626/0.000 14.152/0.000 12.865/0.000 16.725/0.000 11.642/0.000苏木高剂量+pcDNA 组48.09±2.80 65.67±4.64 23.36±0.900.64±0.05)
2.6 过表达PCNA-AS1 对苏木提取液处理的T-47D迁移的影响 相较于苏木高剂量+pcDNA 组,苏木高剂量+pcDNA-PCNA-AS1 组T-47D 细胞PCNAAS1 表达量和划痕愈合率显著升高(P<0.05)。见表3。
3 讨 论
文献证实苏木活性化合物巴西木素、氧化巴西木素与顺铂联合可协同诱导结肠癌细胞凋亡和周期阻滞〔7〕。氧化巴西木素对皮肤癌细胞具有显著毒性作用〔8〕。苏木乙酸乙酯提取物通过激活活性氧途径促进急性髓性白血病细胞分化、诱导细胞凋亡〔9〕。苏木查耳酮还可诱导caspase 依赖和凋亡诱导因子(AIF)依赖性人结肠癌细胞凋亡〔10〕。本研究提示,苏木提取液显著降低T-47D 细胞存活率和克隆形成能力,抑制细胞迁移,并呈剂量依赖效应。凋亡是抗肿瘤药物诱导细胞死亡的最重要原因。Bax 和Bcl-2 是评估细胞凋亡的重要信号,促凋亡蛋白Bax 表达增加、抗凋亡蛋白Bcl-2 表达降低可有效促进线粒体释放凋亡效应因子并诱导凋亡发生〔11〕。Naik Bukke 等〔12〕研究表明巴西木素A 通过调控Bcl-2 蛋白表达可诱导乳腺癌细胞MCF-7 凋亡。本研究说明,苏木提取液可能通过线粒体途径诱导T-47D 细胞凋亡。
越来越多研究表明lncRNA 表达异常在肿瘤的启动、进展和转移中发挥关键作用〔13〕。PCNA-AS1位于染色体20p12.3,研究指出非小细胞肺癌组织中PCNA-AS1 表达上调,与晚期TNM 分期呈正相关,敲减PCNA-AS1 显著抑制非小细胞肺癌细胞增殖、细胞周期进程,抑制体内肿瘤形成〔14〕。此外,PCNA-AS1 高表达还与胃癌细胞的侵袭表型相关〔15〕。本研究发现,转染si-PCNA-AS1 干扰PCNAAS1 表达显著抑制T-47D 细胞存活、克隆形成和迁移能力,并诱导细胞凋亡。既往研究证实在乳腺癌中多种中药化合物的抗肿瘤作用与调控lncRNA 表达有关,如槐耳提取物通过下调lncRNA H19 表达抑制乳腺癌细胞存活率并诱导细胞凋亡〔16〕。黄芩素的抗肿瘤作用与上调lncRNA 配对盒基因8 反义RNA1(PAX8-AS1)表达相关〔17〕。本研究提示,苏木提取液可能通过调控PCNA-AS1 表达进而影响乳腺癌细胞T-47D 增殖、凋亡和迁移。下调PCNA-AS1表达是介导苏木提取液对乳腺癌细胞T-47D 发挥抗肿瘤作用的重要机制。然而,关于苏木在乳腺癌中发挥抗肿瘤作用的主要活性成分仍需进一步探究。
综上,苏木提取液可抑制乳腺癌细胞T-47D 增殖和迁移,并促进细胞凋亡,其抗肿瘤作用是通过下调PCNA-AS1 表达实现的。

