宫颈癌组织中DSG2、CENPM蛋白表达水平及临床预后意义
邓琦程 鲁锦 杨主娟 陈颖 (苏州大学附属第二医院妇产科,江苏 苏州 215004)
宫颈癌发病率占女性恶性肿瘤第三位,且近年来发病逐渐趋于年轻化〔1〕。虽我国在筛查技术和治疗方法均已取得较大突破,但肿瘤复发及转移仍是威胁女性生命安全的重要因素〔2〕。因此,寻找特定、有效的能够早期评估宫颈癌预后标志物对预防和治疗宫颈癌有重要意义。桥粒芯糖蛋白(DSG)2是DSG 的4 种亚型之一,主要在黏膜上皮细胞间的黏附上起重要作用〔3〕,既往已有相关研究发现,DSG2 参与多种恶性肿瘤疾病的细胞恶性转化〔4〕。着丝粒蛋白(CENP)M 是近年发现的促癌分子,具有促进肿瘤增殖及转移的作用〔5〕。既往有研究显示,CENPM 上调促进肝癌或胰腺癌恶性肿瘤发展和进展〔6〕。本研究拟分析宫颈癌组织中DSG2、CENPM 蛋白表达水平及临床预后意义。
1 资料与方法
1.1 一般资料 选取2013年7月至2017年7月苏州大学附属第二医院治疗的92 例老年宫颈癌患者,年龄60~71 岁,平均(66.34±3.23)岁。收集92 份宫颈癌组织(癌变组)和癌旁组织(距肿瘤边缘4 cm处,癌旁组),本研究已获得医院医学伦理委员会批准。纳入标准:①符合宫颈癌诊断标准〔7〕;②手术治疗且术前未行放化疗。排除标准:①伴有脑血管疾病、血液性疾病、神经系统疾病者;②临床资料不全者。另将85 例子宫肌瘤全子宫切除术患者的正常宫颈组织作为对照组,年龄60~72 岁,平均(66.54±3.33)岁。
1.2 免疫组织化学检测DSG2、CENPM 蛋白表达
两组标本均经60℃熔点石蜡包埋并4 μm 连续切片后,在二甲苯脱去石蜡,再用梯度酒精脱去苯至水及苏木素染色,采用柠檬酸修复液高温高压修复抗原,冷却磷酸盐缓冲液(PBS)漂洗,随后加入按1 ∶100稀释的一抗(产于北京中杉金桥生物技术有限公司的兔抗人DSG2 单克隆抗体)4℃孵育过夜,PBS 漂洗3 次,每次3 min,再加入二抗(产于北京中杉金桥生物技术有限公司的兔抗人CENPM 多克隆抗体)37℃孵育30 min,PBS 漂洗3 次,每次3 min,最后使用二氨基联苯胺(DAB,DaKo 公司)显色、苏木素复染、树脂胶封片,并在镜下观察染色情况。操作均严格按照SP 试剂盒说明书进行。
1.3 DSG2、CENPM 蛋白表达结果判定〔8〕DSG2阳性表达定位于细胞膜,呈黄素或棕黄色颗粒状分布;CENPM 阳性表达主要定位于细胞核,着色呈棕黄色或黄褐色分布。免疫结果由两位高年资的病理医师共同完成,随机选取30 个高倍镜视野(×400),每视野读200 个细胞,根据染色强度与阳性细胞百分比综合评分。染色强度:无色、浅黄色、棕色、深褐色分别为0、1、2、3 分。阳性细胞占总细胞百分比:<25%、26%~50%、51%~75%、>75%分别为1、2、3、4 分。阳性细胞百分比和染色强度平均分乘积为最终得分,≥3 分为阳性表达,<3 分为阴性表达。
1.4 随访 使用电话、门诊复诊或上门等方式进行随访,截止2022年7月31日或患者死亡。
1.5 统计学方法 采用SPSS23.0 软件进行χ2检验、Kaplan-Meier 法、多因素Cox 比例风险回归模型分析。
2 结 果
2.1 两组DSG2、CENPM 蛋白表达水平比较 癌变组 DSG2、CENPM 蛋白阳性表达率〔64 例(69.57%)、62 例(67.39%)〕均明显高于癌旁组〔27 例(29.35%)、29 例(31.52%)〕、对照组〔10 例(11.76%)、12 例(14.12%)〕,差异有统计学意义(均P<0.001),见图1。
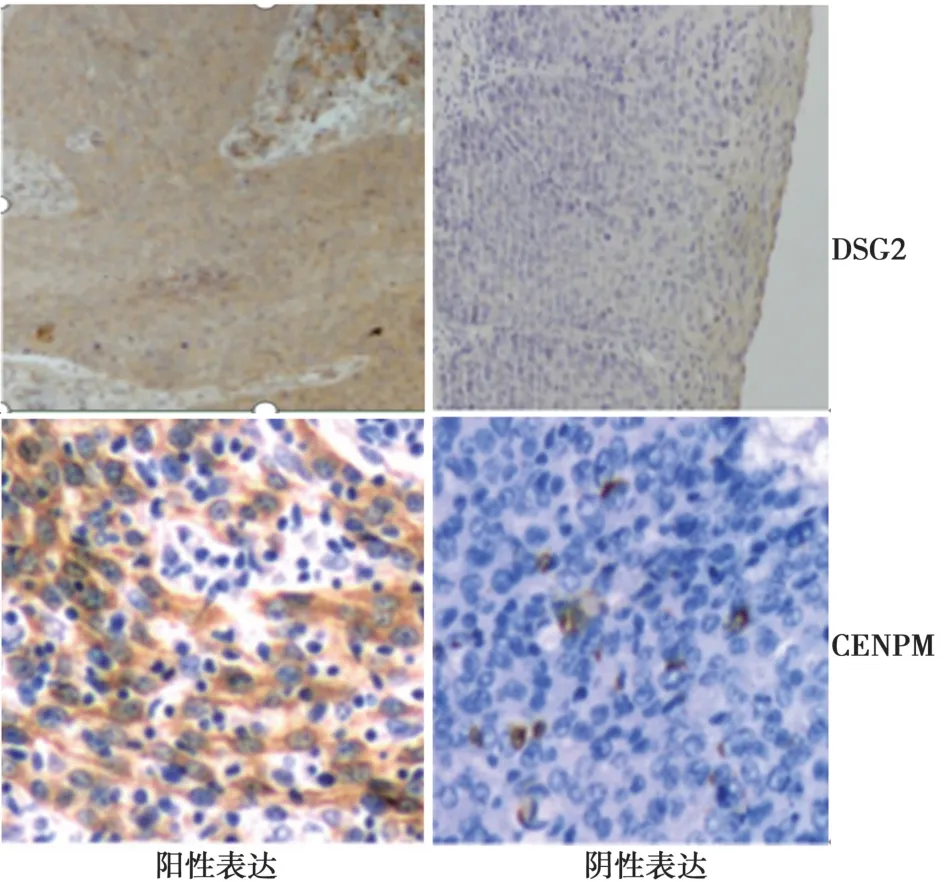
图1 DSG2、CENPM 在宫颈癌组织中表达(HE 染色,×400)
2.2 DSG2、CENPM 蛋白表达在宫颈癌患者临床特征的关系 DSG2、CENPM 蛋白表达在宫颈癌患者年龄、病理类型、肌层浸润深度均无明显差异(P>0.05);在宫颈癌FIGO 分期、分化程度、淋巴结转移有显著差异(P<0.001),见表1。

表1 DSG2、CENPM 蛋白阳性表达与宫颈癌临床病理特征的关系(n,n=92)
2.3 宫颈癌患者预后生存情况 本研究患者自出院后随访时间为3~78 个月,5年生存率为45.65%(42/92) 。DSG 2 阳性、阴性患者5年生存率〔28.13% (18/64)、85.71% (24/28)〕 差异显著(χ2=26.037,P<0.001);CENPM 阳性、阴性患者5年生存率〔27.42%(17/62)、83.33%(25/30)〕差异显著(χ2=25.475,P<0.001)。
2.4 不同特征宫颈癌患者预后比较 FIGOⅡ期、低分化、淋巴结转移宫颈癌患者5年生存率明显降低(P<0.05),见表2。

表2 不同特征宫颈癌患者预后比较〔n(%)〕
2.5 宫颈癌患者预后多因素Cox 回归分析 FIGOⅡ期、低分化、淋巴结转移、DSG2 阳性、CENPM 阳性为宫颈癌患者预后危险因素(P<0.001),见表3。
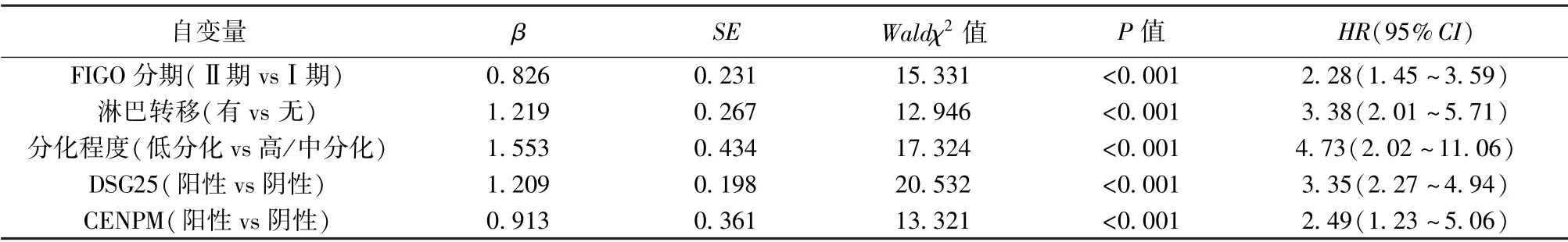
表3 宫颈癌预后多因素Cox 回归分析
3 讨 论
宫颈癌发病率仅次于乳腺癌,近年来该疾病受环境改变及性传播疾病影响,其发病率不仅逐年升高,且逐渐趋向年轻化〔9〕,据国家癌症中心对2015年宫颈癌统计显示,我国年新增确诊9.89 万例,死亡3.05 万例〔10〕。目前临床虽通过放疗、化疗、手术等综合治疗有效控制疾病进展,但对于宫颈癌晚期患者而言其治疗效果以及预后生存期仍不理想。相关文献显示,hTERT、Cep55、FoxM1 等多项因子与宫颈癌预后密切相关〔11,12〕。DSG2 基因位于第18 号染色体,由3 049 个碱基对组成,在鳞状上皮中呈桥粒细胞形式表达,在腺上皮细胞中呈半桥粒状,是促进肿瘤增殖和转移的生物标志物〔13〕。CENPM 是CCAN 蛋白家族的一员,位于内层动粒上,主要在免疫系统中发挥作用〔14,15〕。目前关于CENPM 在肿瘤的研究较少,但根据Oncomine 数据库显示,CENPM mRNA 在乳腺癌、肺癌、淋巴瘤、肝癌等多种癌症中显著高表达。本研究结果显示,DSG2、CENPM 在宫颈癌组织中表达升高,且参与宫颈癌患者恶性疾病的发生、发展。既往研究显示,胆管癌组织中DSG2高表达率高于癌旁正常组织〔16〕。同时有研究显示,与正常组织相比,CENPM 在乳腺癌组织上调〔17〕。本研究结果DSG2、CENPM 蛋白表达与宫颈癌预后密切相关,阳性表达提示患者预后不良。既往有关于肝移植术后肝癌复发的研究结果显示,CENPM 高表达组总体生存时间低于低表达组〔18〕。本研究进一步证实CENPM、DSG2 在宫颈癌发生、进展中有重要作用,有望作为评估患者预后的标志物。CENPE与CENPM 均属于CCAN 蛋白家族的一员,在有丝分裂过程中起重要作用。而既往有研究显示,下调CENPE 可使宫颈癌肿瘤细胞的凋亡率明显增加〔19〕。DSG2 是桥粒不可分割的组成部分,在多种癌症中维持细胞黏附,且当DSG2 基因敲除时能抑制宫颈癌细胞的增殖、迁移和侵袭〔20〕。
综上,宫颈癌组织中DSG2、CENPM 蛋白阳性表达增加,且FIGO Ⅱ期、低分化、淋巴结转移的宫颈癌患者阳性表达水平更高,DSG2、CENPM 蛋白阳性表达宫颈癌患者预后更差,二者有望作为临床诊治宫颈癌的有效生物标志物。

