Na2CO3- Na3PO4-H2O体系的相平衡研究
刘永刚,卢子钰,柳召刚
(内蒙古科技大学 材料与冶金学院,轻稀土资源绿色提取与高效利用教育部重点实验室,内蒙古自治区稀土湿法冶金与轻稀土应用重点实验室,内蒙古 包头 014010)
包头稀土矿碱分解后的水洗液中含有少量的磷酸钠和碳酸钠,直接排放会造成环境污染。废水可以结合水盐相图的方法进行研究,从中归纳其规律,把相图变成一种引导实践理论的工具[1]。目前,关于Na2CO3和Na3PO4水盐体系的研究较少。因此,文章对三元体系Na2CO3-Na3PO4-H2O的相平衡进行研究,为Na3PO4和Na2CO3的分离提供热力学数据。

Felmy研究了磷酸盐成分在ESP中Piter模型的增强型热力学数据库的开发[7]。Pan等[8]采用等温溶解平衡法和湿渣法研究了298.15 K和333.15 K下K2SO4-KH2PO4-H2O的三元体系。得到了体系的溶解度数据,并根据溶解度数据建立了298.15 K和333.15 K下K2SO4-KH2PO4-H2O的相图,并确定了上述体系中的固相。测量了298.15 K和333.15 K下体系的饱和溶液密度。该三元体系的热力学数据解释了在硫酸钾和磷酸二氢钾水溶液中制备磷酸二氢钾的合理性。Sadeghi等[8]研究了水盐体系的相分离磷酸盐和聚(丙二醇)及该体系盐析作用。测定了该体系的热力学数据,并绘制了相图。Silverio等[9]研究了UCON+(钠或钾)磷酸盐的液液平衡23 ℃下的水相两相系统。结果表明:相图中非均相区域的大小随着体系pH值的增加而增加。
Long J等[10]采用等温溶液饱和法测定了在288.15 K和303.15 K下KH2PO4-KCl-H2O体系的溶解度和密度。测定体系的结晶区发现KCl的结晶区远小于KH2PO4的结晶区。Yongsheng Ren等[11]通过等温溶液饱和法测定了KCl-KH2PO4-C2H5OH-H2O体系在313.15 K下的固—液相平衡和物化性质。并研究了其对晶体生长形态和产品质量的影响。Shen S等[12]研究了采用等温溶液饱和法和湿残渣法研究了303.15 K三元体系KH2PO4-NaH2PO4-H2O的相平衡。发现该三元体系中存在一个不变点、两条单饱和液体曲线和两个结晶场。该研究为磷酸二氢钾的制备和分离提供了指导。
1 实验材料与方法
1.1 实验材料
磷酸钠和碳酸钠(均为分析纯),上海阿拉丁生化科技股份有限公司;盐酸标准溶液,上海阿拉丁生化科技股份有限公司;酚酞指示剂,上海阿拉丁生化科技股份有限公司;甲基橙指示剂,上海阿拉丁生化科技股份有限公司;实验用水是去离子水。
1.2 实验设备
测氟仪,上海三信仪器厂;pH/离子浓度测量仪(MP523型),上海雷磁仪器有限公司;X射线多晶衍射仪(Smart-Lab-9kw);电子分析天平(MP5002型),上海精密仪器有限公司;H-4恒温水浴锅,金坛市城西丽华实验仪器厂;JJ-1精密磁力搅拌器,江苏金坛市金城国胜实验仪器厂;水银温度计(规格100 ℃)。
1.3 实验方法
此实验温度分别为298.15 K、318.15 K和333.15 K。往该温度下饱和磷酸钠溶液中梯度加入碳酸钠固体,再往该温度下饱和碳酸钠溶液中梯度加入磷酸钠固体,并将调配好的溶液转移到塑料瓶中。实验时间为3 h,直至达到双饱和状态。实验完成后,静置溶液 0.5 h,使沉淀充分沉降,分别取上清液和湿渣进行物化性质分析。
1.4 分析方法与检测
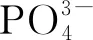
混合Na2CO3含量先测碱度[15],再计算碱度与磷酸钠含量的差值。计算公式如下:
2 结果与讨论
2.1 实验结果
表1、表2和表3分别是298.15 K、318.15 K和333.15 K下三元Na2CO3-Na3PO4-H2O体系的固液平衡组成数据,表中列出了平衡液相组成和湿固相组成,成分均包含了Na2CO3和Na3PO4。此外还有平衡液相密度数据。
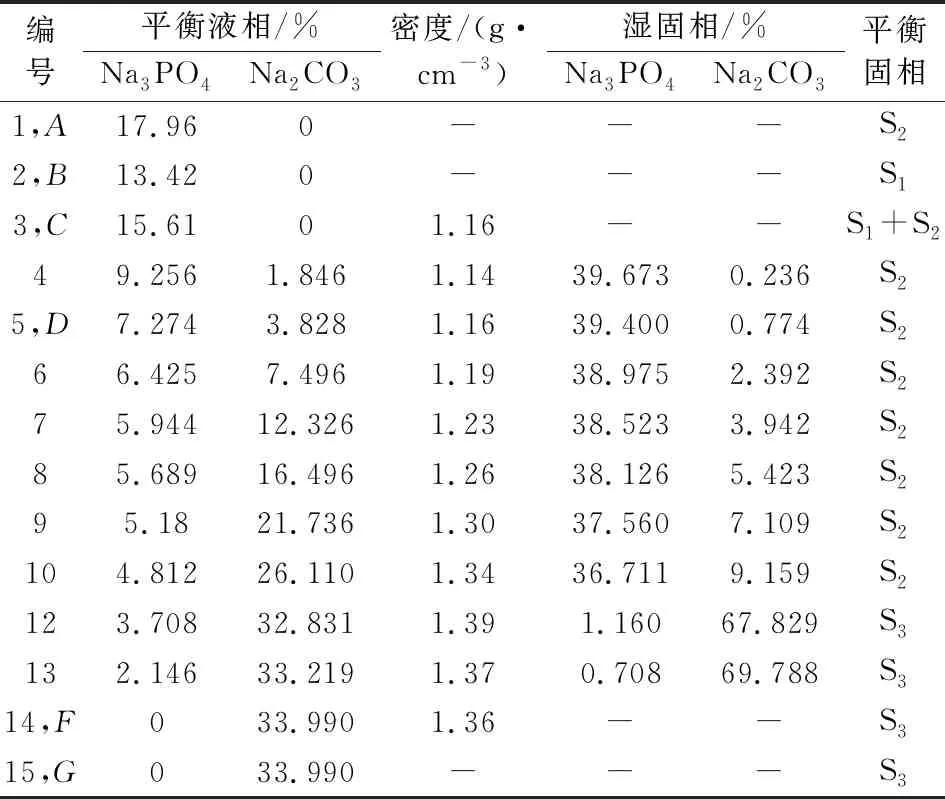
表1 三元体系Na2CO3-Na3PO4-H2O在298.15 K固液平衡组成
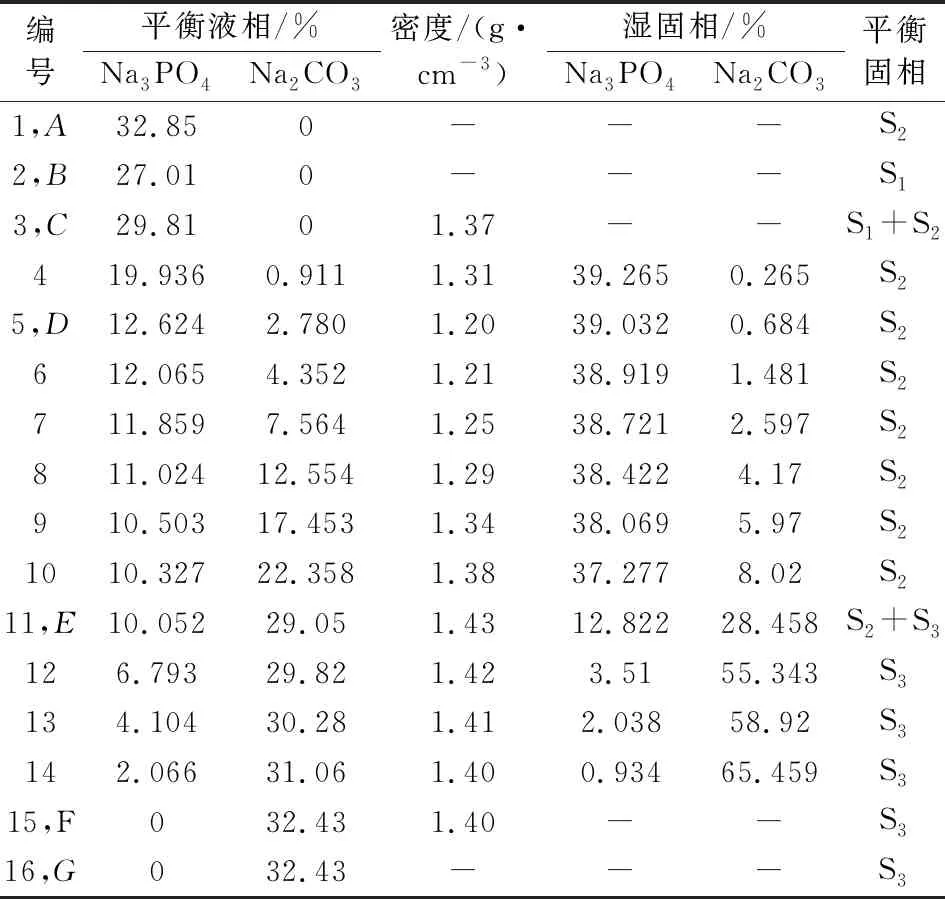
表2 三元体系Na2CO3-Na3PO4-H2O在318.15 K固液平衡组成
根据表1、表2和表3的数据得出,其中平衡液相和湿固相中分别包含的是Na3PO4和Na2CO3的质量分数。平衡固相中包含3种固相,其中的S1、S2和S3分别为Na3PO4·12H2O、Na3PO4·8H2O和Na2CO3·H2O。
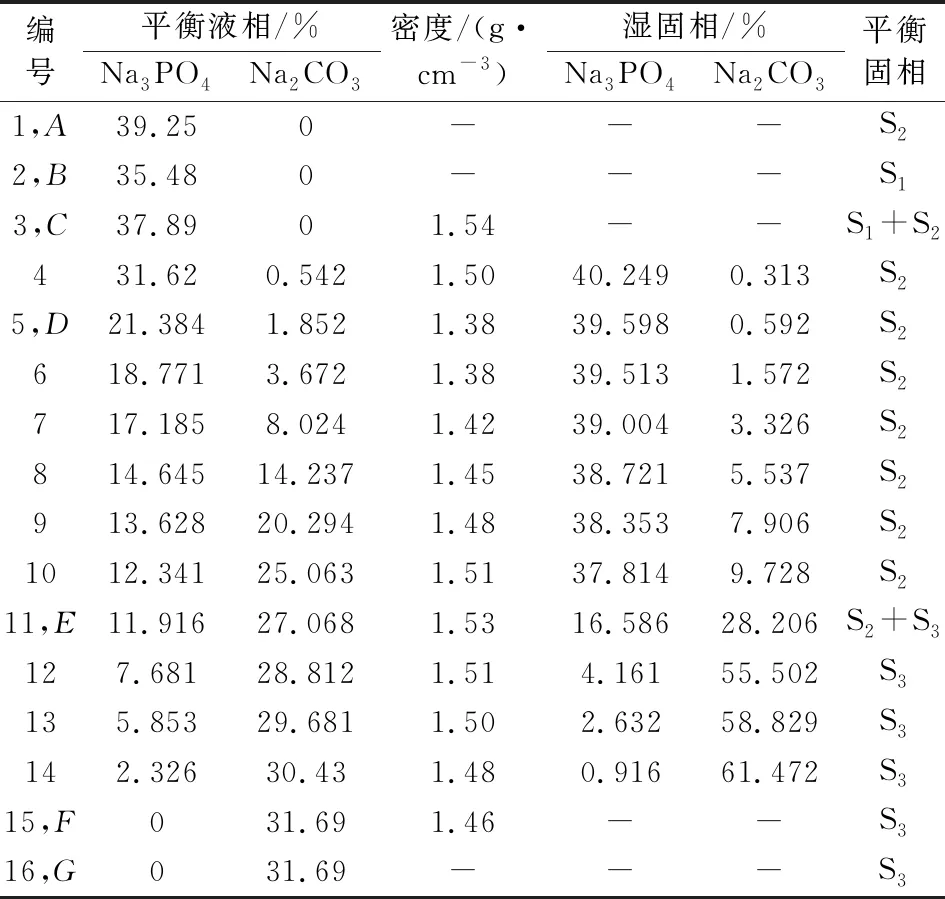
表3 三元体系Na2CO3-Na3PO4-H2O在333.15 K固液平衡组成
表中点A、点B和点G是三个固相点,分别对应Na3PO4·8H2O、Na3PO4·12H2O和Na2CO3·H2O。三个点的热力学数据随温度变化而变化。在升温过程中,点A中w(Na3PO4)分别为17.96%、32.85%和39.25%,点B中w(Na3PO4)分别为13.42%、27.01%和35.48%,点G中w(Na2CO3)分别为33.99%、32.43%和31.69%。点C是单盐饱和点,在298.15 K、318.15 K和333.15 K时w(Na3PO4)分别为13.42%、29.81%和35.48%。说明随温度的升高,Na3PO4·12H2O饱和溶液的溶解度逐渐增大。
点D存在Na3PO4·12H2O和Na3PO4·8H2O的两种水合物。点E是该三元体系唯一共饱点,其中的平衡固相包含Na3PO4·8H2O和Na2CO3·H2O。点F是单盐饱和点。
根据表1、表2和表3数据,绘制了298.15 K、318.15 K和333.15 K下三元体系Na2CO3-Na3PO4-H2O的平衡相图(图1~图3)。
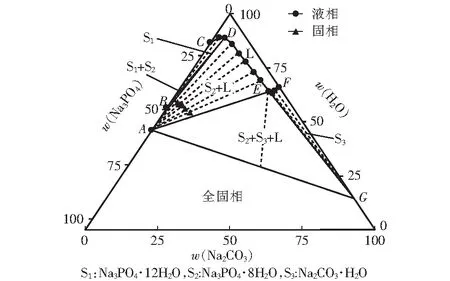
图1 298.15 K时Na2CO3-Na3PO4-H2O三元相图
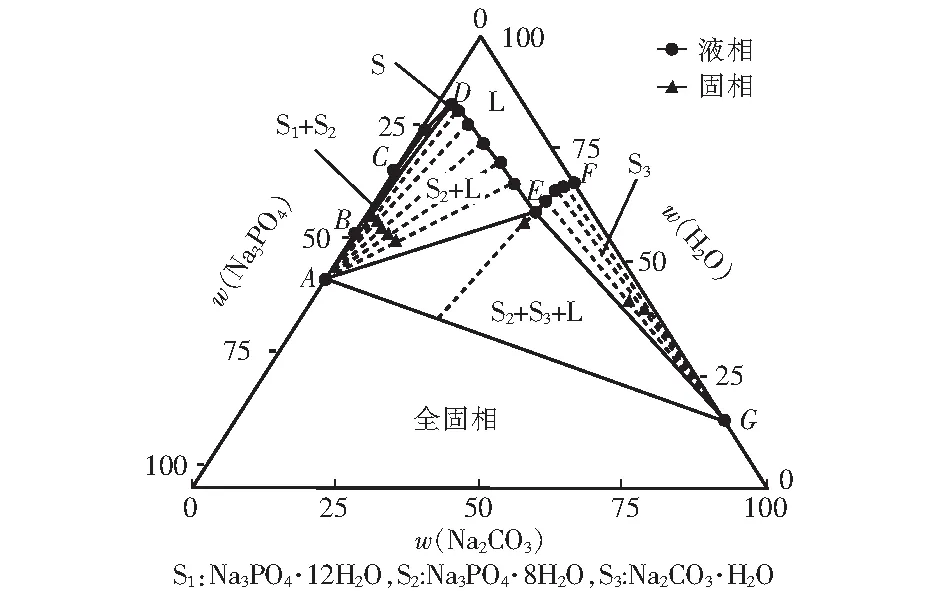
图2 318.15 K时Na2CO3-Na3PO4-H2O三元相图
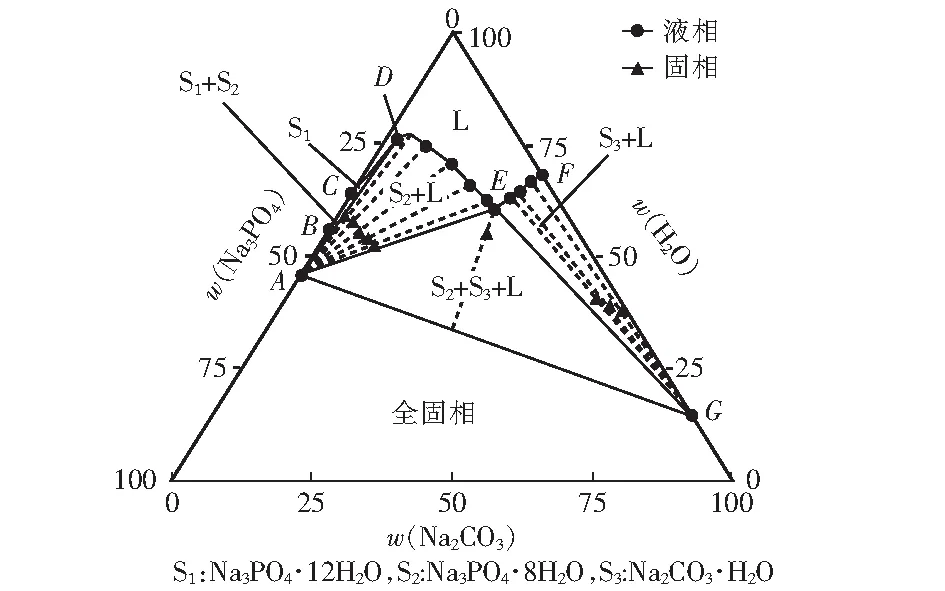
图3 333.15 K时Na2CO3-Na3PO4-H2O三元相图
由图可见,Na2CO3-Na3PO4-H2O体系中无复盐和固溶体。该体系稳定相图包含1个液相区、3个单盐结晶区、1个混合结晶区、1个全固相区、1条液相线、 1个共饱点。相图中固液共存相区包含Na3PO4·12H2O+L相区、Na3PO4·8H2O+L相区、Na2CO3·H2O+L相区、Na3PO4·12H2O+Na3PO4·8H2O+L相区和Na3PO4·8H2O+Na2CO3·H2O+L相区。该体系共饱点的成分是Na3PO4·8H2O+ Na2CO3·H2O,在图中用E点表示。
通过对比可以看出,随着温度的升高,液相区面积逐渐增大。溶液中的磷酸钠在低温时易于稳定,随着碳酸钠的质量分数逐渐增加,二者最终达到双饱和。与之不同的是,当体系不断升温时,溶液中的磷酸钠溶解度不断增加,而碳酸钠的溶解度无明显变化。
2.2 物化性质研究
2.2.1 密度分析
根据表1、表2和表3中的密度数据,以Na2CO3的质量分数为横坐标,溶液密度为纵坐标,绘制了298.15K、318.15 K和333.15 K下三元体系Na2CO3-Na3PO4-H2O的密度折线图,见图4。
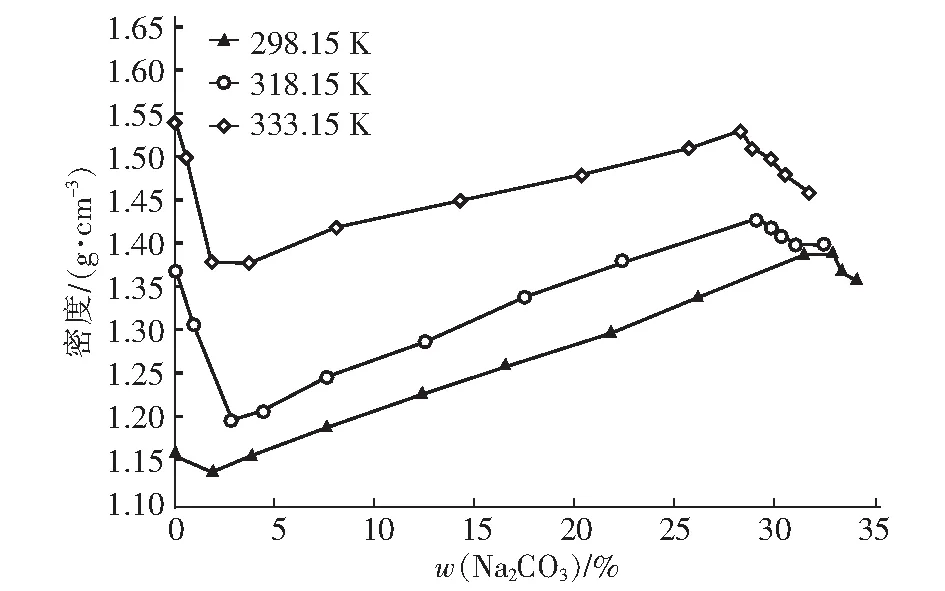
图4 298.15 K、318.15 K和333.15 K时Na2CO3-Na3PO4-H2O的密度
密度曲线分为三个阶段,分别为第一次下降段、上升段和第二次下降段。第一次下降段是在向溶液中加入碳酸钠初期的变化曲线,该过程随着碳酸钠的加入磷酸钠含量逐渐减少;上升段是磷酸钠含量稳定到恒定值,然后往溶液中加入碳酸钠,碳酸钠继续溶解到溶液中,该过程中的磷酸钠质量分数随碳酸钠的增加缓慢减少;第二次下降段是碳酸钠含量基本保持不变,磷酸钠含量大幅减少的过程。
2.2.2 pH值分析
根据检测平衡液相所得到的pH值数据,以Na2CO3的质量分数为横坐标,pH值为纵坐标,绘制了298.15 K、318.15 K和333.15 K下三元体系Na2CO3-Na3PO4-H2O的pH值折线图,见图5。
由图5可以看出,体系中无碳酸钠存在时,298.15 K、318.15 K和333.15 K三条曲线pH值分别为11.48、11.46、11.41。碳酸钠含量较少时,三条曲线pH值整体都在降低,298.15 K、318.15 K和333.15 K时曲线降到11.43、11.42和14.0。随着碳酸钠含量的增加,曲线pH值呈上升趋势,298.15 K、318.15 K和333.15 K分别到达最大值12.08、11.97和11.79。当体系中w(Na2CO3)超过28.25%,三个温度下的pH值下降明显,298.15 K、318.15 K及333.15 K时体系pH值对应下降到为11.98、11.9和11.6。当碳酸钠质量分数相同时,温度是影响液相pH值的主要因素,pH值随温度增加逐渐降低。
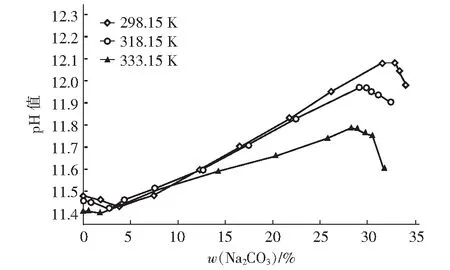
图5 298.15 K、318.15 K和333.15 K时Na2CO3-Na3PO4-H2O的pH值
2.2.3 XRD分析
图6是三元体系Na2CO3-Na3PO4-H2O共饱点E的X射线衍射图。E点衍射峰与Na2CO3·H2O的特征峰吻合较好,说明该体系共饱点E的平衡固相中包含Na3PO4·8H2O和Na2CO3·H2O。
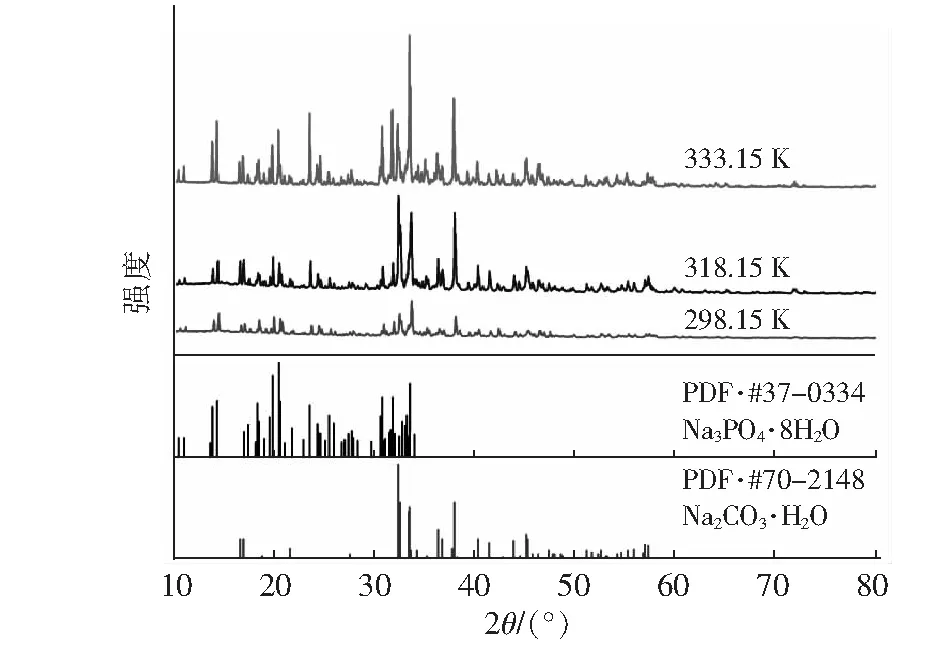
图6 Na2CO3-Na3PO4-H2O体系E点(共饱点)X射线衍射图
3 结论
1)该体系中无复盐和固溶体产生,但是体系中的Na3PO4和Na2CO3均有水合物,该相图属于水合物I型体系。
2)该体系相图3个温度的相区无变化,均包含1个液相区,3个单盐结晶区,1个混合结晶区,1个全固相区;1条液相线,5条单变量溶解度曲线;1个共饱点,其中共饱点包含Na3PO4·8H2O和Na2CO3·H2O。
3)Na2CO3对Na3PO4有盐析作用,盐析作用随温度的升高而增大,但增幅很小。

