沉默lncRNA MEG3对慢性阻塞性肺疾病小鼠肺功能的改善作用及其机制
叶婷,余维巍,张存泰
1华中科技大学同济医学院附属同济医院临床营养科,武汉 430030;
2华中科技大学同济医学院附属同济医院老年医学科
慢性阻塞性肺疾病(COPD)是一种以肺部气流受限为主要特征的慢性、不可逆呼吸系统疾病,其临床发病率及病死率比较高,严重影响患者的生活质量[1]。既往研究显示,白细胞介素1β(IL-1β)与COPD急性加重频率、中性粒细胞计数和C反应蛋白(CRP)水平均呈正相关关系[2]。IL-1β水平升高与COPD患者NLRP3炎症小体激活以及中性粒细胞的活性密切相关,提示IL-1β与COPD患者的炎症反应有关[3]。本课题组前期也发现,COPD患者支气管肺泡灌洗液(BALF)中IL-1β水平增高,IL-1β与其肺功能呈负相关关系、与急性加重频率呈正相关关系。然而,目前关于IL-1β与COPD发生的临床前期研究均以失败告终[4]。因此,有必要深入研究IL-1β在COPD发生中的分子调控机制,发展恰当的靶向治疗手段。随着高通量测序技术日渐成熟,已有研究发现COPD患者的部分长链非编码RNA(lncRNA)出现差异表达[5],其中lncRNA MEG3被报道参与了COPD的疾病进展过程[6]。2020年5月—2021年11月,本研究观察了沉默lncRNA MEG3对COPD小鼠肺组织、BALF中IL-1β表达及肺功能的影响,探讨lncRNA MEG3是否通过IL-1β参与COPD小鼠的肺损伤。现报告如下。
1 材料与方法
1.1 材料实验动物:SPF级野生型雄性C57BL/6J小鼠32只,10~12周龄,体质量(24±2)g,由华中科技大学同济医学院动物实验中心提供,许可证号:WYTJH(e)2019-0044。主要试剂:lncRNA MEG3 siRNA及阴性对照siRNA(NC siRNA)均购自上海吉玛基因股份有限公司,分别溶解于不含RNA的无菌水中,取适量于室温下孵育30 min,形成siRNA-Li⁃pofectamine和NC-Lipofectamine复合体(10 g/L);小鼠IL-1β PCR试剂盒购自美国Thermo Fisher Scien⁃tific公司,IL-1β抗体购自中国武汉赛维尔生物科技有限公司,IL-1β ELISA试剂盒购自武汉博士德生物工程有限公司;大前门香烟(焦油10 mg、烟碱0.8 mg、CO 12 mg)购自上海卷烟厂。
1.2 COPD小鼠模型构建与分组处理将32只野生型C57BL/6J小鼠随机分成control组、COPD组、COPD+NC组、COPD+siMEG3组,每组8只。除con⁃trol组小鼠外,均采用香烟烟雾烟熏的方法建立COPD模型,方法如下:将小鼠置于自制烟熏有机玻璃舱(40 cm×30 cm×16 cm)中,全身暴露在3支香烟的烟雾中,3次/天,每次间隔30 min,共持续12周。COPD+NC组、COPD+siMEG3组 同 时 尾 静 脉 注 射siRNA-Lipofectamine、NC-Lipofectamine复 合 体2.5 mg/kg,control组、COPD组注射等量生理盐水,1次/周,共注射12次。
1.3 标本获取各组小鼠最后一次烟熏后,经4%水合氯醛腹腔注射麻醉后固定,经下腔静脉采血,静置后低温离心获得血清,-70℃保存,同时取动脉血0.2 mL用于血气分析。立即暴露气管和双肺,在气管上段作一横行切口,并夹闭左侧主支气管,用注射器经气管切口向右肺缓慢注入4 mL磷酸盐缓冲液(PBS),并进行回收(回收率85%~95%),获得BALF,重复3次;将第1次的BALF离心后取上清,-70℃保存,取其沉淀与后两次BALF混匀并离心,弃上清,再将沉淀用1 mL PBS洗涤3次,转移至1.5 mL EP管中。取出左肺,将4%多聚甲醛溶液1 mL经左主支气管注入左肺,并将其浸泡于4%多聚甲醛溶液24 h。
1.4 肺组织病理观察取各组左肺下叶组织,常规进行脱水、石蜡包埋、切片,HE染色后显微镜下观察肺组织病理学改变。
1.5 动脉血氧合相关指标检测取各组小鼠动脉血0.2 mL进行血气分析,检测氧分压(PaO2)、二氧化碳分压(PaCO2)和pH,并计算氧合指数。
1.6 肺湿重/干重测定取各组小鼠左肺上叶组织,称其湿重后置于80℃烘箱中烘烤24 h,称其干重,计算肺湿重/干重。
1.7 lncRNA MEG3与IL-1β的 靶 控 关 系 分 析JASPER数据库预测lncRNA MEG3与IL-1β之间存在结合位点(OSID码图1A、B)。进行染色质免疫共沉淀实验:收集1×108个气道上皮细胞,使用3%的甲醛交联细胞10 min,加入1.5 mmol/L Glycine终止交联反应;依次裂解细胞膜和细胞核,使用超声将细胞核中的DNA片段剪切到250 bp左右;将超声后的DNA片段离心后取上清,加入钙调蛋白2抗体5 μg孵育过夜;以对应种属的IgG作为阴性对照,提取DNA进行荧光定量PCR检测,证实lncRNA MEG3与IL-1β启动子区域存在结合位点,提示二者存在靶控关系(OSID码图1C)。
1.8 肺 组 织 及BALF中lncRNA MEG3、IL-1β mRNA检测采用实时荧光定量PCR法。取各组肺组织及BALF,TRIzol法提取总RNA,测定浓度后按照试剂盒说明书逆转录为cDNA,采用SYBR-GreenⅠReal-time PCR Kit进行PCR反应。lncRNA MEG3引物序列:上游引物5'-ACCTCGTGTGGGGAAA⁃GATCA-3',下 游引 物5'-CCATCGCCAAACCACTG⁃GA-3';IL-1β引物序列:上游引物5'-CCGCAGCCTA⁃CATCATTC-3',下游引物5'-CGCCATAAGCCCTCC⁃TA-3';内参GAPDH引物序列:上游引物5'-AGGTC⁃GGTGTGAACGGATTTG-3',下游引物5'-TG⁃TAGACCATGTAGTTGAGGTCA-3'。采 用2-ΔΔCt法 计算目的基因相对表达量。
1.9 肺组织及BALF中IL-1β蛋白检测取各组肺组织及BALF,参照IL-1β ELISA试剂盒说明书检测肺组织及BALF中的IL-1β蛋白表达,严格按照试剂盒说明书操作。
1.10 统计学方法采用GraphPad Prism 9.0统计软件。计量资料采用Kolmogorov-Smirnov正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理情况比较control组小鼠肺组织完整,未见明显的炎症细胞浸润,无明显肺泡水肿及结构破坏,支气管平滑肌层及管壁结构完整无明显异常;COPD组及COPD+NC组小鼠肺泡结构紊乱,部分肺泡可见不规则扩大,肺泡、小气道及肺血管可见大量炎症细胞浸润;COPD+siMEG3组小鼠肺泡结构较COPD组及COPD+NC组完整,肺泡、小气道和肺血管少量炎症细胞浸润,支气管平滑肌层及管壁结构偶见异常。见OSID码图2。
2.2 各组小鼠氧合指数和肺湿重/干重比较见表1。
表1 各组小鼠氧合指数和肺湿重/干重比较(±s)
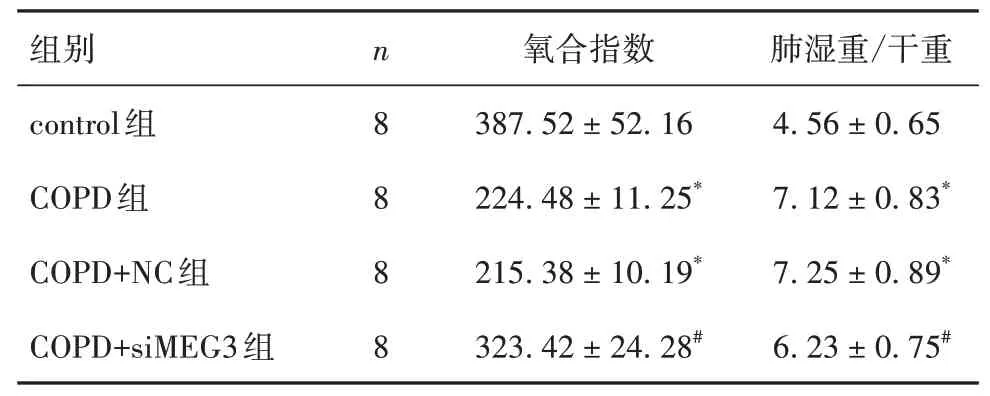
表1 各组小鼠氧合指数和肺湿重/干重比较(±s)
注:与control组比较,*P<0.05;与COPD组、COPD+NC组比较,#P<0.05。
?
2.3 各组小鼠肺组织、BALF中lnc RNA MEG3及IL-1β mRNA、蛋白比较见表2。
表2 各组小鼠肺组织、BALF中lnc RNA MEG3及IL-1β mRNA、蛋白表达比较(±s)

表2 各组小鼠肺组织、BALF中lnc RNA MEG3及IL-1β mRNA、蛋白表达比较(±s)
注:与control组比较,*P<0.05;与COPD组、COPD+NC组比较,#P<0.05。
?
3 讨论
炎症一直以来都是COPD发病机制的研究重点,吸烟是COPD慢性持续炎症反应的主要诱因,但部分COPD患者戒烟后肺部炎症反应却持续进展,进一步探索炎症反应的相关机制十分必要。既往研究证实,IL-1β明确参与了COPD的发生发展[7]。IL-1β信号传导与香烟烟雾和感染引起的慢性炎症、气道重塑和肺气肿有关,并且与几乎所有已知的COPD相关介质和疾病过程相互作用或影响[8]。研究显示,IL-1β是COPD发病过程中肺上皮—间质单位(EMTU)中上皮—成纤维细胞通讯紊乱的主要驱动因素[9]。COPD小鼠肺上皮细胞及巨噬细胞中IL-1β高表达,导致强烈的炎症反应,并伴有肺气肿和气道重塑[10];IL-1β与IL-1R1结合形成IL-1R1复合物,通过经典Toll白细胞介素受体(TIR)/骨髓分化初级反应基因88(MyD88)途径激活信号传导,该通路特异性地导致转录因子的核转位,例如p38丝裂原相关蛋白激酶、c-Jun N-末端激酶、激活蛋白1和NF-κB,可促进多种炎症细胞因子和生长因子的表达[11]。然而,IL-1β拮抗剂在临床上却未成功转化为COPD的治疗方案,究其原因如下:①未使用IL-1β特异性拮抗剂;②IL-1β拮抗剂的使用时机不清楚;③无法判断IL-1β拮抗剂在肺组织中是否达到合适的血药浓度;④COPD中存在不同的表型,尚缺乏针对不同表型的研究方案[12]。上述因素可能制约了IL-1β拮抗剂的临床应用,同时目前亦缺乏对IL-1β相关信号通路的了解,可能无法从单一途径来阻断IL-1β的致炎作用,需要对IL-1β的上游信号通路进行进一步研究[4]。本研究进一步证实,吸烟所致COPD小鼠的肺组织及BALF中存在IL-1β mRNA及蛋白表达升高,可能参与了COPD小鼠的炎症反应。
为了探索了IL-1β的上游信号通路,本研究通过RPIseq数据库预测了lncRNA MEG3与IL-1β启动子的潜在作用位点;通过染色质免疫共沉淀实验验证lncRNA MEG3与IL-1β启动子上存在结合位点,提示lncRNA MEG3可能通过影响IL-1β启动子来调节IL-1β的表达。本研究结果显示,敲减lncRNA MEG3可以改善COPD小鼠的肺组织病理及肺功能,并且对IL-1β表达具有调控作用。既往研究显示,lncRNA MEG3在COPD患者肺组织中表达上调,与第一秒用力呼气量占所有呼气量的比例呈负相关关系,敲减lncRNA MEG3可减轻香烟烟雾诱导的肺上皮细胞凋亡、炎症反应及细胞毒性[13]。与本研究结果一致。lncRNA MEG3还可能通过调节p53、NF-кB的表达介导人支气管上皮细胞凋亡和自噬等,我们进一步探索了lncRNA MEG3对下游炎症因子IL-1β的调控效应,证实了lncRNA MEG3在COPD发生发展中具有重要作用。研究显示,在COPD患者的肺组织和经香烟烟雾提取物(CSE)处理的16HBE细胞中lncRNA MEG3表达上调。本研究结果显示,与control组比较,COPD组肺湿重/干重升高,氧合指数降低,肺组织lncRNA MEG3表达升高且肺组织、BALF中IL-1β mRNA、蛋白均升高,提示COPD小鼠存在明显肺损伤及lncRNA MEG3、IL-1β表达升高;与COPD组比较,COPD+siMEG3组肺湿重/干重降低,氧合指数升高,肺组织lncRNA MEG3表达降低且肺组织、BALF中IL-1β mRNA、蛋白均降低,提示沉默lncRNA MEG3可通过降低IL-1β表达而减轻COPD小鼠的肺损伤。
综上所述,COPD小鼠肺组织及BALF中lncRNA MEG3及IL-1β表达均升高,lncRNA MEG3可能通过结合IL-1β启动子区上调IL-1β表达,从而促进气道炎性损伤,加速COPD的病理进程;沉默lncRNA MEG3可通过降低IL-1β表达而减轻COPD小鼠的肺损伤,从而发挥肺保护作用。但是本研究在小鼠BALF中未检测到lncRNA MEG3表达,提示lncRNA MEG3可能是通过组织水平调节IL-1β表达,lncRNA MEG3是否能够调控IL-1β相关炎症通路,以及具体的调控机制仍需进一步研究。

