miR-145-5p对肾缺血/再灌注损伤大鼠的肾脏保护作用及其机制
李莎莎,刘晓茜,黄静,杜林娜,贾盼攀,李露
西安医学院第一附属医院肾内科,西安 710077
肾缺血/再灌注(I/R)损伤是导致急性肾损伤(AKI)发病和患者死亡的重要因素,目前仍没有有效的治疗方法[1]。自噬是一种高度保守的真核细胞再循环过程,可诱导细胞质成分在溶酶体中被吞噬和降解[2]。自噬被认为在缺血、缺氧、营养缺乏、遗传毒性、感染、未折叠蛋白反应等应激条件下被高度诱导,以上这些均参与了肾I/R损伤的发病过程[3]。然而,目前自噬在肾I/R损伤中发挥保护性还是破坏性的作用仍然存在争议。研究发现,miR-145-5p在心肌和脑组织缺血/再灌注损伤过程中发挥了关键作用[4-5]。本课题组前期研究证实,骨髓间充质干细胞分泌的外泌体将miR⁃145⁃5p传递到肾细胞,并通过减轻氧化应激损伤和炎症反应来抑制细胞凋亡,进而减轻了肾I/R损伤。但目前miR⁃145⁃5p能否通过改变肾组织的自噬水平而减轻肾I/R损伤尚不清楚,且其分子机制亦需进一步探究。2022年3月—8月,本研究观察了miR-145-5p过表达对肾I/R损伤大鼠的肾脏保护作用,并探讨其机制是否与调控自噬和其他信号通路激活有关,为临床以miR-145-5p为靶点治疗肾I/R损伤提供理论依据。
1 材料与方法
1.1 材料实验动物:清洁级雄性SD大鼠40只,10~12周龄,体质量(200±20)g,购自空军军医大学实验动物中心,许可证号:SYXK(陕)2019-001。主要试剂:血尿素氮(BUN)、血清肌酐(Scr)试剂盒购自南京建成生物工程研究所,TUNEL检测试剂盒购自瑞士Roche公司,逆转录TaqMan miRNA试剂盒购自美国Thermo公司,AKT特异性抑制剂LY294002购自美国GlpBio公司;促凋亡蛋白Bax、抗凋亡蛋白Bcl-2,蛋白激酶B/雷帕霉素靶蛋白(AKT/mTOR)信号通路相关蛋白磷酸化蛋白激酶B(p-AKT)、蛋白激酶B(AKT)、磷酸化雷帕霉素靶蛋白(p-mTOR)、雷帕霉素靶蛋白(mTOR),自噬相关蛋白微管相关蛋白轻链(LC3)、肌球蛋白样Bcl-2结合蛋白(Beclin1)、自噬相关蛋白5(Atg5)和内参β-ac⁃tin抗体均购自美国Abcam公司;miR-145-5p agomir购自上海吉玛制药技术有限公司。
1.2 动物分组及处理将40只SD大鼠随机分成Sham组、I/R组、I/R+agomir组、I/R+agomir+LY组,每组10只。除Sham组外均建立肾脏I/R损伤模型:腹腔注射2%戊巴比妥钠50 mg/kg进行麻醉,腹腔注射肝素钠500 U,开腹后游离双侧肾脏,切除右肾,夹闭左肾动、静脉60 min后开放,逐层缝合腹壁;Sham组仅给予切开及关闭腹腔操作,不予血管夹闭。I/R+agomir组和I/R+agomir+LY组在I/R操作前3 d经尾静脉注射miR-145-5p agomir 10 nmol/L,I/R+agomir+LY组同时腹腔注射LY294002 50 mg/kg,Sham组和I/R组经尾静脉注射等量PBS溶液。各组分组处理2 d后用戊巴比妥钠麻醉大鼠,心脏穿刺采血处死。4%多聚甲醛固定液经心脏进行全身灌注,待肾脏颜色消退后立即取出肾脏,将右肾组织快速放入1.5 mL冷冻管中,液氮保存;左肾组织沿长轴纵向切开,4%多聚甲醛固定。
1.3 肾组织miR-145-5p检测采用qRT-PCR法。取各组液氮保存的右肾组织,RNA提取试剂盒提取总RNA,并进行逆转录。PCR引物序列:miR-145-5p上游引物5′-GTCCAGTTTTCCCAGGAATCCCT-3′、下 游 引 物5′-GCTGTCAACATACGCTACGTAACG-3′,内参U6上游引物5′-TAAAATCTATACACGAC⁃GGCTTCG-3′、下 游 引 物5′-TACTGTGCGTTTA⁃AGCACTTCGC-3′。使用TaqMan miRNAs检测试剂盒进行PCR反应。PCR反应条件:94℃30 s,94℃5 s,60℃30 s,共40个循环。采用2-ΔΔCt法计算miR-145-5p相对表达量。
1.4 肾功能检测收集各组大鼠的血样,4℃条件下3 000 r/min离心20 min,收集上清。按照BUN、Scr试剂盒说明书操作,检测血清BUN、Scr水平。
1.5 肾组织病理观察采用HE染色。取各组4%多聚甲醛固定的左肾组织,4 μm厚度切片。将石蜡切片在100%二甲苯和二甲苯与乙醇(比例为1∶1)的混合溶液中浸泡15 min,脱蜡,分别在100%、95%和75%乙醇中浸泡1 min,生理盐水清洗。苏木精染色30 min,加入伊红复染,光镜下观察肾组织病理变化。对肾组织损伤情况进行评分,评分为0~4分,分数越高提示肾组织损伤越严重[6]。
1.6 肾组织细胞凋亡检测采用TUNEL法。取各组肾组织石蜡切片,经脱蜡水合后用PBS液小心振荡洗涤,用0.1% Triton X-100打孔5 min。按照TUNEL检测试剂盒说明书,将1号和2号液按照1∶9的比例混合配制,37℃避光孵育1 h后,PBS液振荡洗涤3遍。DAPI对细胞核进行染色,37℃避光孵育5 min。激光扫描共聚焦显微镜照像,以发绿色荧光细胞数占蓝色荧光细胞数的百分比计算细胞凋亡率。
1.7 肾组织LC3B检测采用免疫荧光法。取各组肾组织石蜡切片,经脱蜡水合后用PBS液小心振荡洗涤,0.1% Triton X-100打孔5 min。按照LC3B抗体试剂盒说明书,将LC3B和PBS液按照1∶200的比例混合配制,4℃避光孵育12 h,PBS液振荡洗涤3遍;将荧光二抗和PBS液按照1∶300的比例混合配制,37℃避光孵育2 h,PBS液振荡洗涤3遍。DAPI对细胞核进行染色,37℃避光孵育5 min。激光扫描共聚焦显微镜照像,采用Image J软件分析LC3B免疫荧光强度。
1.8 肾组织AKT/mTOR信号通路及凋亡、自噬相关蛋白检测采用Western blotting法。取各组液氮保存的右肾组织,研磨后提取蛋白,BCA法测定蛋白浓度,进行蛋白定量。将蛋白经聚丙烯酰胺变性凝胶电泳(SDS-PAGE)分离,采用湿转法将蛋白转移到PVDF膜,5%脱脂牛奶室温封闭2 h,加入p-AKT、AKT、p-mTOR、mTOR、Bax、Bcl-2、LC3B、Be⁃clin1、Atg5(稀释比例均为1∶1 000)和β-actin(稀释比例为1∶2 000)一抗,4℃孵育过夜;TBST洗脱3次,加入辣根过氧化物酶标记的羊抗兔、羊抗鼠IgG二抗(稀释比例均为1∶5 000),室温孵育2 h;TBST洗脱3次,通过Bio-Rad照相系统采集照片,采用ImageLab软件分析条带灰度值,以β-actin为内参,计算目的蛋白相对表达量,计算p-AKT/AKT、pmTOR/mTOR及LC3Ⅱ/LC3Ⅰ。
1.9 统计学方法采用SPSS19.0统计软件。计量资料采用Shapiro-Wilk正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾组织miR-145-5p表达比较Sham组、I/R组、I/R+agomir组、I/R+agomir+LY组肾组织miR-145-5p相对表达量分别为1.04±0.14、0.46±0.15、1.51±0.18、1.46±0.14;与Sham比较,I/R组miR-145-5p表达明显降低,I/R+agomir组和I/R+agomir+LY组均明显升高(P均<0.01)。
2.2 各组大鼠肾功能指标及肾组织损伤评分比较与Sham组相比,I/R组及I/R+agomir+LY组肾组织切片示肾小球坏死和肥大,小管膨胀及铸型形成;与I/R组相比,I/R+agomir组肾小球坏死和肥大显著减轻,小管膨胀及铸型形成明显减少;见OSID码图1。各组血清BUN、Scr及肾组织损伤评分比较见表1。
表1 各组大鼠血清BUN、Scr及肾组织损伤评分比较(±s)

表1 各组大鼠血清BUN、Scr及肾组织损伤评分比较(±s)
注:与Sham组比较,*P<0.05;与I/R组、I/R+agomir+LY组比较,#P<0.05。
?
2.3 各组大鼠肾组织细胞凋亡率及凋亡蛋白表达比较与Sham组比较,I/R+agomir组、I/R组、I/R+agomir+LY组肾组织细胞凋亡率均升高,且I/R组、I/R+agomir+LY组升高更明显(P均<0.05);各组肾组织细胞凋亡情况见OSID码图2。与Sham组、I/R+agomir组比较,I/R组、I/R+agomir+LY组肾组织促凋亡蛋白Bax表达均升高,抗凋亡蛋白Bcl-2表达均降低(P均<0.05);见表2和OSID码图3。
表2 各组大鼠肾组织细胞凋亡率及凋亡蛋白表达比较(±s)
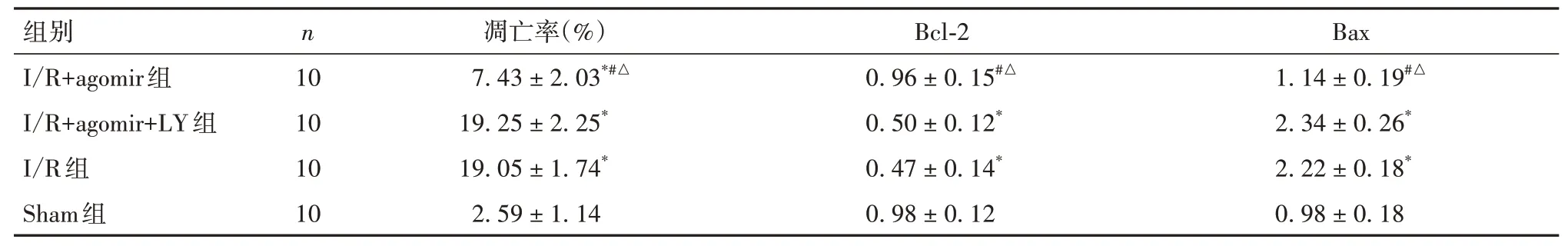
表2 各组大鼠肾组织细胞凋亡率及凋亡蛋白表达比较(±s)
注:与Sham组比较,*P<0.05;与I/R组比较,#P<0.05;与I/R+agomir+LY组比较,△P<0.05。
?
2.4 各组大鼠肾组织自噬相关蛋白表达比较与Sham组、I/R+agomir组比较,I/R组、I/R+agomir+LY组大鼠肾组织LC3B荧光表达强度、LC3Ⅱ/LC3Ⅰ、Beclin1蛋白表达均升高,Atg5蛋白表达均降低(P均<0.05);见表3和OSID码图4、5。
表3 各组大鼠肾组织自噬相关蛋白表达比较(±s)

表3 各组大鼠肾组织自噬相关蛋白表达比较(±s)
注:与Sham组比较,*P<0.05;与I/R组比较,#P<0.05;与I/R+agomir+LY组比较,△P<0.05。
?
2.5 各组大鼠肾组织AKT/mTOR通路相关蛋白达水平比较与Sham组、I/R+agomir组比较,I/R组、I/R+agomir+LY组大鼠肾组织p-AKT/AKT、p-mTOR/mTOR均降低(P均<0.05);见表4和OSID码图6。
表4 各组大鼠肾组织AKT/mTOR通路相关蛋白表达比较(±s)
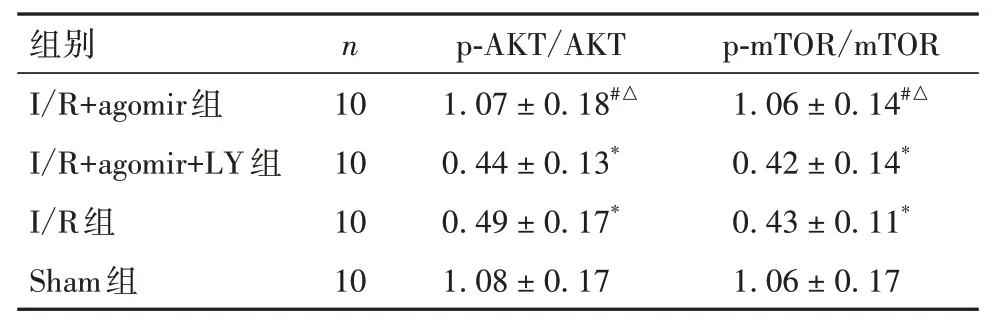
表4 各组大鼠肾组织AKT/mTOR通路相关蛋白表达比较(±s)
注:与Sham组比较,*P<0.05;与I/R组比较,#P<0.05;与I/R+agomir+LY组比较,△P<0.05。
?
3 讨论
AKI主要由肾I/R损伤、脓毒症和肾毒性药物(如顺铂、环孢素、马兜铃酸)引起,主要特点是通过肾小球滤过率检测到肾功能迅速下降。越来越多的研究证实,自噬参与了肾I/R损伤诱导的AKI[7]。此外,自噬在肾I/R损伤中也起双向调节作用,在肾I/R早期,适当的自噬激活有保护作用。KANG等[8]研究发现,盐酸戊乙奎醚可通过诱导自噬促进肾细胞增殖,并抑制细胞凋亡,进而抑制肾I/R损伤的发生发展。XIE等[9]研究发现,缺血预处理可通过上调自噬流促进自噬,以减轻肾I/R损伤。BIAN等[10]研究发现,自噬缺陷会加重肾损伤,并与C反应蛋白高表达相关。而在肾I/R损伤晚期过度激活自噬反而会加重肾脏损伤,一些抑制过度自噬的制剂被证明对肾I/R损伤具有肾保护作用。TAN等[11]证明,纤维母细胞生长因子10可以通过mTOR途径抑制过度自噬,从而保护肾I/R损伤大鼠的肾功能、减少其肾损伤评分。FANG等[12]研究发现,miR⁃30a⁃5p可通过调节Beclin⁃1/ATG16通路而减轻自噬,从而缓解肾I/R损伤。NAKAGAWA等[13]证明,使用mTOR抑制剂依维莫司诱导自噬反应,加重了AKI患者的肾小管功能障碍。因此,在不同的肾I/R损伤进程中,自噬对细胞存活和死亡有不同的调节功能。肾I/R损伤早期阶段自噬提供了保护作用,但晚期或过度自噬可促进细胞凋亡和后期细胞死亡,导致不可逆的细胞损伤。通过对肾I/R损伤不同阶段自噬进行靶向调节,可以起到缓解肾I/R损伤诱发AKI的作用,从而为预防和治疗肾I/R损伤提供新的治疗方法。本研究结果显示,与Sham组相比,I/R组大鼠肾组织细胞凋亡率、LC3B荧光强度、LC3Ⅱ/LC3Ⅰ及促凋亡蛋白Bax、Beclin1蛋白表达明显升高,抗凋亡蛋白Bcl-2及Atg5蛋白表达明显下降;这表明在肾I/R损伤大鼠晚期的自噬水平明显上调,通过抑制晚期过度自噬继而减少细胞凋亡可能成为预防和治疗肾I/R损伤的新策略。
多个在体和离体实验已表明,miR-145-5p对多种肾脏疾病的诊断和治疗具有指导意义[14]。有研究发现,miR-145-5p在心肌和脑组织I/R损伤的发生发展中发挥了关键作用[4-5]。近期研究发现,miR-145-5p参与到了细胞自噬的调控过程中[15]。然而,miR-145-5p能否通过调节晚期自噬发挥减轻肾I/R损伤的作用仍待进一步明确。本研究结果显示,与I/R组 相 比,I/R+agomir组 大 鼠 给 予agomir上 调miR-145-5p表达后,可以显著降低大鼠血清BUN、Scr水平及肾组织损伤评分,减少肾组织细胞凋亡率、LC3B荧光强度、LC3Ⅱ/LC3Ⅰ及促凋亡蛋白Bax、Beclin1蛋白表达,并升高抗凋亡蛋白Bcl-2及Atg5蛋白表达;这表明过表达miR-145-5p对肾I/R损伤大鼠的晚期自噬具有明显抑制作用,进而减轻了肾脏损伤。
自噬激活过程需要通过不同的信号通路介导,AKT/mTOR信号通路是其中重要的一条[16]。AKT又称蛋白激酶B(PKB),是一种丝氨酸/苏氨酸蛋白激酶,正常情况下调节下游多种靶蛋白表达。mTOR是自噬调节中研究最多的靶蛋白之一,细胞中的mTOR以两种复合物的形式存在,即mTOR1和mTOR2,调节自噬的主要为mTOR1[17]。在生长条件下,Ⅰ类PI3K激活丝氨酸/苏氨酸激酶AKT,之后通过一系列的调控使mTOR磷酸化,从而抑制自噬。而在营养饥饿、缺氧等应激下,mTOR信号通路被抑制,从而使自噬顺利被诱导[18]。通过AKT/mTOR信号通路对自噬进行调节,对于自噬介导相关疾病的干预有重要意义。此外,miR-145-5p与AKT/mTOR通路间也存在某种联系。GAO等[19]研究显示,通过海绵化miR-145-5p激活PRKCI/AKT/mTOR通路是circPARD3抑制自噬、促进喉鳞状细胞癌进展和化疗耐药的主要机制。因而,我们进一步猜想miR⁃145⁃5p可能是通过激活AKT/mTOR信号通路而抑制了晚期肾I/R损伤后自噬的过度激活,进而减轻肾I/R损伤。本研究结果显示,与Sham组比较,I/R组大鼠肾组织p-AKT/AKT、p-mTOR/mTOR均下降;与I/R组比较,I/R+agomir组大鼠肾组织中p-AKT/AKT、p-mTOR/mTOR均升高,表明miR⁃145⁃5p与AKT/mTOR信号通路间存在上下游调控关系;而腹腔注射AKT信号特异性抑制剂LY294002后的I/R+agomir+LY组较I/R+agomir组肾组织p-AKT/AKT、p-mTOR/mTOR均降低,提示LY294002阻断AKT/mTOR信号通路的同时,也阻断了miR⁃145⁃5p对肾I/R损伤大鼠晚期自噬的抑制作用,并且逆转了miR⁃145⁃5p对肾I/R损伤大鼠的肾脏保护作用。
综上所述,miR⁃145⁃5p可以通过激活AKT/mTOR信号通路来抑制晚期自噬的过度激活,从而减轻了肾I/R后大鼠的肾损伤,发挥肾脏保护作用。本研究阐明了miR⁃145⁃5p在肾I/R损伤中的保护机制,同时也为临床应用miR⁃145⁃5p作为靶点治疗肾I/R损伤提供了更详实的理论基础。

