消岩汤含药血清培养的乳腺癌MCF-7细胞增殖、迁移、侵袭能力变化及其机制
吕艳,耿强,韩燕燕,郑旭,李翀,兰福,赵杰
天津中医药大学第一附属医院病理科 国家中医针灸临床医学研究中心,天津 300381
乳腺癌是全世界女性最常见的恶性肿瘤,2018年全世界女性乳腺癌发病率和病死率分别为46.3/100 000和13.0/100 000,且均呈上升趋势[1]。尽管乳腺癌的诊疗取得了一定进展,但是放、化疗对患者的免疫系统带来的损害不可避免,因此寻求“减毒增效”的治疗方法是目前亟待解决的问题。乳腺癌的病因病机是“正气内虚,毒瘀并存”,治疗乳腺癌应扶正与祛邪相结合,在扶正的基础上解毒祛瘀。消岩汤正是以此为依据组方而成,方以生黄芪、太子参为君药,益气滋阴,扶正驱邪;白花蛇舌草、夏枯草、生牡蛎为臣药,清热解毒,软坚散结;郁金、姜黄为佐药,活血祛瘀,行气解郁。研究表明,消岩汤具有显著改善乳腺癌患者生活质量的功效,但分子机制不明确[2]。circRNA作为一类新型拼接RNA,在乳腺肿瘤的发生、发展中发挥重要作用。最新研究证实,敲低膀胱癌组织中的circRIP2基因可抑制转化生长因子β2(TGF-β2)活性,从而促进膀胱癌进展[3]。TGF-β2是重要的肿瘤免疫功能调节因子,乳腺干细胞中高表达的TGF-β2可诱发上皮—间质转化(EMT)[4-5]。2021年10月—2022年3月,本研究观察了不同浓度消岩汤含药血清对乳腺癌MCF-7细胞增殖、迁移和侵袭能力的影响,并观察其调控机制是否与circRIP2和TGF-β2有关,为探索消岩汤干预乳腺癌细胞生物学行为的分子机制提供理论依据。
1 材料与方法
1.1 材料细胞:乳腺癌MCF-7细胞购自中国科学院,使用含10%小牛血清的RPMI 1640细胞培养液,在37℃、5%CO2细胞培养箱中培养,胰蛋白酶溶液消化,每3 d传代一次。动物:BALB/C小鼠40只,体质量18~22 g,购自北京维通利华实验动物技术有限公司,批号:SCXK(京)2021-0006。主要试剂:GAPDH、TGF-β2、丝氨酸苏氨酸激酶2(RIPK2)一抗均购自美国ABclonal公司,TRIzol试剂购自美国Thermo公司,CCK-8试剂盒、Transwell小室均购自美国Millipore公司,无水乙醇、异丙醇均购自中国医药集团有限公司,RT逆转录试剂盒、SuperReal PreMix Plus均购自北京天根生化科技有限公司。
1.2 消岩汤含药血清制备消岩汤配伍组成:黄芪30 g、太子参15 g、郁金10 g、姜黄15 g、夏枯草10 g、生牡蛎15 g、白花蛇舌草10 g,分别按40 g/kg(临床成人日用量的20倍)、20 g/kg、10 g/kg溶解于生理盐水。将30只BALB/C小鼠分为三部分,每部分10只,分别灌胃给予40、20、10 g/kg的消岩汤,每次灌胃间隔24 h,连续3 d。小鼠末次灌胃后禁食禁水,12 h后眼眶取血法采血,无菌分离血清,经56℃、30 min灭活处理后,使用0.22 μm微孔滤膜过滤除菌,-20℃保存备用。另取10只BALB/C小鼠不予灌胃,仅采血获得血清,记为空白鼠血清。
1.3 细胞分组处理取对数生长期的MCF-7细胞,调整细胞密度为2×107/μL,以1×105/孔接种于6孔板,待细胞融合度达到80%,将细胞分为消岩汤含药血清4组、消岩汤含药血清2组、消岩汤含药血清1组、普通牛血清组、空白鼠血清组,依次加入1.2中制备的浓度比为4∶2∶1的消岩汤含药血清、普通10%小牛血清及空白鼠血清,每孔100 μL,均孵育24 h。
1.4 细胞增殖能力观察采用CCK-8法。取“1.3”分组处理的细胞,按1×103/孔接种于96孔板,并设置3个复孔,每孔加入培养基100 μL。分别培养24、48 h,每孔加入CCK-8溶液10 μL,在细胞培养箱内继续孵育4 h,使用酶标仪测定450 nm处的吸光度(OD)值。
1.5 细胞迁移能力观察采用细胞划痕实验。取“1.3”分组处理的细胞,用无菌枪头在长满的细胞中间位置划一直线,小心清洗去除漂浮细胞后(0 h)进行拍照,放入培养箱中进行培养。分别在培养24、48、72 h拍照,测量划痕距离(D)后计算24、48、72 h细胞迁移率。24 h细胞迁移率(%)=(D0 h-D24 h)/D0 h×100%,48 h细胞迁移率(%)=(D0 h-D48 h)/D0 h×100%,72 h细胞迁移率(%)=(D0 h-D72 h)/D0 h×100%。
1.6 细胞侵袭能力观察采用Transwell小室实验。提前准备好Transwell小室,在中间铺Matrigel胶。取“1.3”分组处理的细胞,胰酶消化后将5×105个细胞用培养基重悬至200 μL,加到Transwell上室;Transwell下室加入培养基+10%小牛血清;48 h后擦去Matrigel胶,多聚甲醛固定,结晶紫染色,显微镜拍照后对穿膜细胞进行计数。
1.7 细胞中circRIP2、RIP2及TGF-β2mRNA检测采用qRT-PCR法。采用TRIzol试剂提取各组细胞总RNA,测定RNA浓度和纯度,逆转录合成cDNA。cir⁃cRIP2、RIP2、TGF-β2及内参β-actin的PCR引物设计、合成由大连宝生物公司完成,引物序列见表1。PCR反应体系:2×Super Real PreMix Plus 10 μL,上下游引物各0.5 μL,cDNA 1 μL,用ddH2O补充至20 μL。PCR反应条件:95℃预变性15 min,1个循环;95℃变性10 s,60℃退火20 s,40个循环;72℃延伸20 s。熔解曲线:95℃15 s,60℃60 s,95℃15 s。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。

表1 circRIP2、RIP2、TGF-β2及内参β-actin引物序列
1.8 细胞中RIPK2、TGF-β2蛋白检测采用West⁃ern blotting法。取各组细胞,提取细胞总蛋白,制备SDS-PAGE胶,电泳,转膜,封闭;加入RIPK2、TGF-β2及内参GAPDH一抗(稀释比例均为1∶1 000),4℃孵育过夜,洗膜;加入二抗(稀释比例为1∶40 000),室温下封闭1 h,洗膜后显色、曝光,Image J软件分析条带灰度值,计算目的蛋白相对表达量。
1.9 统计学方法采用SPSS18.0统计软件。计量资料采用Shapiro-Wilktest正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,组间比较采用t检验和SNK法,重复测量数据采用重复测量方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较培养24 h,消岩汤含药血清4、2组细胞增殖能力均低于普通牛血清组(P均<0.05);培养48 h,消岩汤含药血清4、2、1组细胞增殖能力均低于普通牛血清组,消岩汤含药血清4组细胞增殖能力均低于空白鼠血清组(P均<0.05)。其他两组间同时间点比较均无统计学差异(P均>0.05)。见表2。
表2 各组培养24、48 h的细胞增殖能力比较(±s)
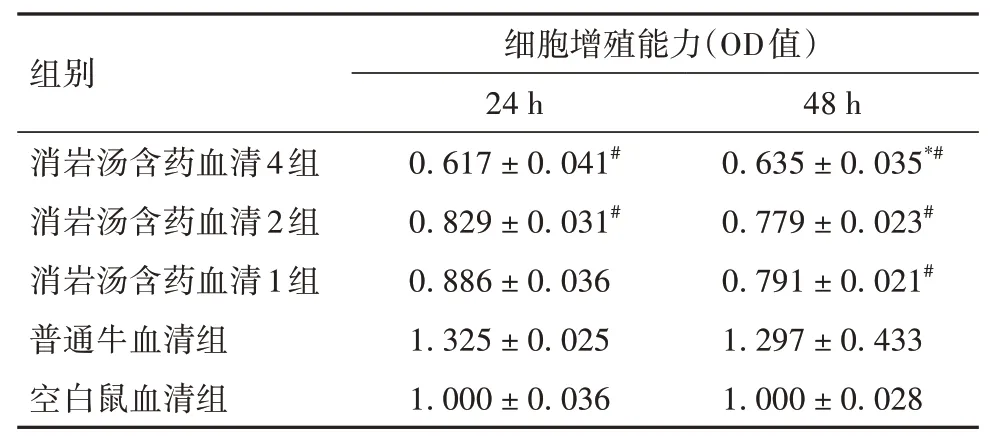
表2 各组培养24、48 h的细胞增殖能力比较(±s)
注:与空白鼠血清组比较,*P<0.05;与普通牛血清组比较,#P<0.05。
?
2.2 各组细胞迁移能力比较见表3及OSID码图1。
表3 各组培养24、48、72 h的细胞迁移率比较(±s)
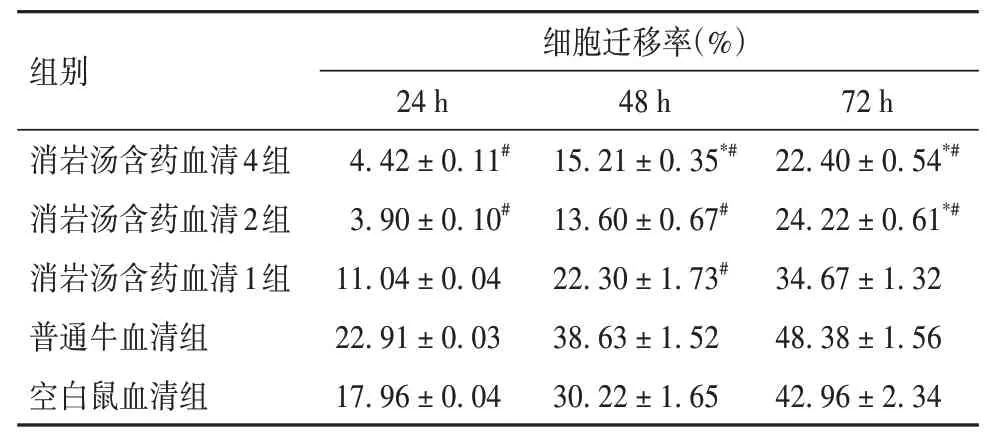
表3 各组培养24、48、72 h的细胞迁移率比较(±s)
注:与同组24 h比较,*P<0.05;与普通牛血清和空白血清组同时间点比较,#P<0.05。
?
2.3 各组细胞侵袭能力比较消岩汤含药血清4、2、1组及普通牛血清组、空白鼠血清组穿膜细胞数分别为(24±2)、(37±4)、(47±6)、(88±5)、(82±8)个,消岩汤含药血清4、2、1组穿膜细胞数均低于普通牛血清组、空白鼠血清组(P均<0.05),消岩汤含药血清4、2、1组穿膜细胞数比较无统计学差异(P>0.05)。见OSID码图2。
2.4 各组细胞circRIP2及RIP2、TGF-β2mRNA相对表达量比较见表4。
表4 各组细胞circRIP2及RIP2、TGF-β2 mRNA相对表达量比较(±s)
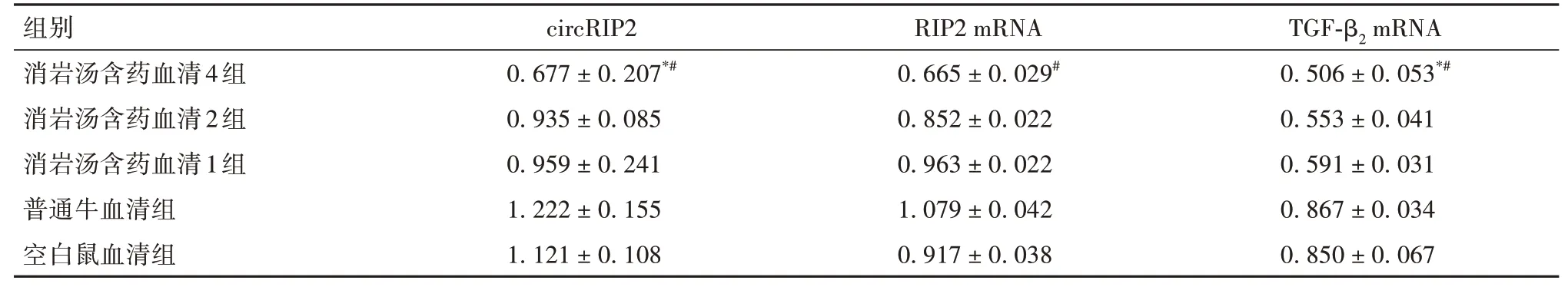
表4 各组细胞circRIP2及RIP2、TGF-β2 mRNA相对表达量比较(±s)
注:与空白鼠血清组比较,*P<0.05;与普通牛血清组比较,#P<0.05。
?
2.5 各组细胞RIPK2、TGF-β2蛋白表达比较消岩汤含药血清4组RIPK2蛋白相对表达量低于空白鼠血清组、消岩汤含药血清1组,TGF-β2蛋白相对表达量低于普通牛血清组(P均<0.05)。见表5及OSID码图3、4。
表5 各组细胞RIPK2、TGF-β2蛋白表达比较(±s)
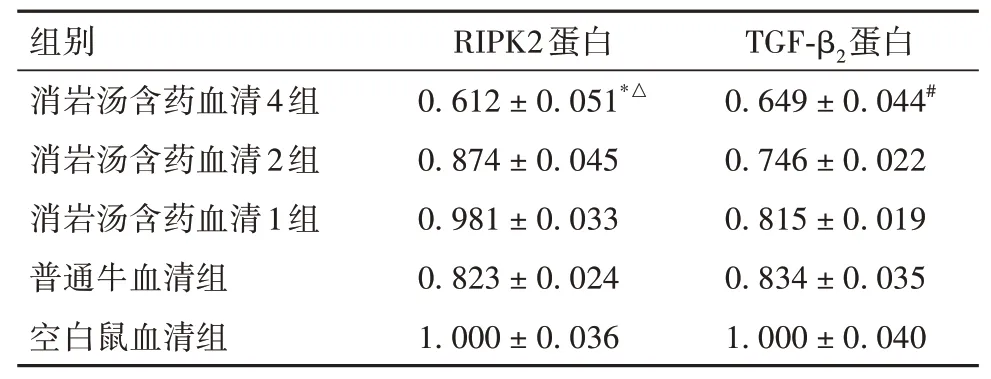
表5 各组细胞RIPK2、TGF-β2蛋白表达比较(±s)
注:与空白鼠血清组比较,*P<0.05;与普通牛血清组比较,#P<0.05;与消岩汤含药血清1组比较,△P<0.05;
?
3 讨论
消岩汤是天津中医药大学第一附属医院院内制剂,在临床应用数十年,对多种肿瘤包括乳腺癌[4]、非小细胞肺癌和甲状腺癌[6-7]等均有良好疗效。但是,消岩汤治疗各种肿瘤的分子机制尚不明确。研究证实,消岩汤含药血清经Survivin siRNA抑制人肺腺癌A549细胞增殖,并促进其凋亡[8]。此外,消岩汤能够增强毒性T淋巴细胞和自然杀伤(NK)细胞的活性而提高肿瘤患者免疫功能[9-10]。本研究结果显示,培养相同时间点消岩汤含药血清4、2组细胞增殖能力均低于普通牛血清组,消岩汤含药血清4、2、1组24 h细胞迁移率均低于普通牛血清组、空白鼠血清组,消岩汤含药血清4、2组48、72 h细胞迁移率均低于普通牛血清组、空白鼠血清组,消岩汤含药血清4、2、1组穿膜细胞数均低于普通牛血清组、空白鼠血清组;这提示消岩汤含药血清可有效抑制乳腺癌MCF-7细胞的增殖、迁移和侵袭能力,以中高浓度消岩汤含药血清效果更明显。
环状RNA可通过海绵样吸附miRNA对下游基因进行调控,产生后续的表观遗传特性。研究显示,miR-1305是影响乳腺癌患者预后的独立因素之一[11],而TGF-β2可通过激活Smad3参与调控乳腺癌转移[12]。尽管circRIP2首先是在膀胱癌相关研究中被人们认识,但是鉴于其“海绵样”吸附分子miR-1305以及下游调控蛋白TGF-β2均与乳腺癌进展关系密切。因此,本研究观察了消岩汤含药血清抑制乳腺癌MCF-7细胞增殖、迁移和侵袭能力的相关机制是否与circRIP2有关。cir⁃cRIP2是一个长度为282 bp的环状RNA,不能编码、翻译产生蛋白质,只有在解链状态才能够吸附miR-1305,并对下游调控通路产生作用,并且只有在线性RNA状态下才能够编码产生蛋白RIPK2。最近研究发现,RIPK2活性增加导致了NF-κB的活化,随后促进了乳腺癌的发生和侵袭[13]。本研究结果表明,消岩汤含药血清4组细胞circRIP2相对表达量均低于普通牛血清组、空白鼠血清组,RIP2相对表达量均低于普通牛血清组;消岩汤含药血清4组RIPK2蛋白相对表达量低于空白鼠血清组;这提示高浓度消岩汤含药血清对乳腺癌MCF-7细胞的circRIP2具有抑制作用,同时抑制线性RIP2 mRNA蛋白产物RIPK2表达,可能是其降低乳腺癌细胞增殖、迁移和侵袭能力的相关机制之一,为探索消岩汤通过调控circRIP2而影响乳腺癌进展的分子机制提供了重要线索。
此外,TGF-β2/Smad3通路激活对乳腺癌易感性的影响已被证实[14]。TGF-β2基因敲除可加速乳腺癌T淋巴细胞介导的肿瘤排斥反应,对于乳腺癌的进展具有重要的临床意义[15]。关于TGF-β2及其通路与放疗和化疗耐受的关系是目前研究的焦点[16],TGF-β2有可能成为突破肿瘤患者放疗、化疗耐药性的关键点[17-18]。本研究结果表明,消岩汤含药血清4组细胞TGF-β2mRNA相对表达量均低于普通牛血清组、空白鼠血清组,TGF-β2蛋白相对表达量低于普通牛血清组;这提示高浓度消岩汤含药血清可能通过抑制乳腺癌MCF-7细胞TGFβ2mRNA和蛋白表达而降低其细胞增殖、迁移和侵袭能力。
综上所述,高浓度消岩汤含药血清可通过降低cir⁃cRIP2、TGF-β2表达而参与抑制乳腺癌MCF-7细胞的增殖、迁移和侵袭。在未来研究中,我们将重点探索cir⁃cRIP2和TGF-β2之间的调控关系及下游蛋白与乳腺癌进展的相关性。

