miR-145-5p对多柔比星诱导小鼠心肌损伤的调控作用及其机制
周海佳,刘鹏云,秦超师,王芳芳,白宝宝,纪兆乐
空军军医大学第二附属医院心血管内科,西安 710038
多柔比星(DOX)在治疗癌症方面效果显著,但可导致危及生命的心脏毒性,因此在化疗中的应用受到很大限制[1]。DOX可导致左心室功能不全,甚至心力衰竭[2]。研究显示,活性氧(ROS)的过量产生和心肌细胞凋亡在DOX诱导的心肌损伤中具有重要作用。DOX诱发的氧化应激可通过外源性和内源性凋亡途径直接诱导大量心肌细胞凋亡,引起严重的心功能障碍,但是目前其相关机制并不明了[3]。微小RNA(miRNA)属于非编码小RNA家族,具有18~25个核苷酸,可通过阻断靶信使RNA(mRNA)的翻译或降解靶基因来调控多种靶基因的转录后效应。研究显示,miR-145-5p在心血管疾病的发生和氧化应激过程中均发挥重要的调控作用[4-5]。沉默调节蛋白5(sirt5)是位于线粒体的烟酰胺腺嘌呤二核苷酸依赖性组蛋白去乙酰酶的家族成员之一,其作为细胞内稳态的重要调节器,参与心肌能量代谢多个方面的调节,在细胞解毒、氧化应激和凋亡中具有重要作用[6]。已有研究发现,sirt5是miR-299-3p和miR-19b的靶基因[7-8],但miR-145-5p与sirt5之间是否有关尚未报道。2022年2月—7月,本研究观察了miR-145-5p和sirt5对DOX诱导小鼠心肌氧化应激和细胞凋亡的影响,并探讨miR-145-5p能否靶向sirt5,为DOX所致心脏毒性的治疗提供新思路。
1 材料与方法
1.1 材料实验动物:清洁级雄性C57BL/6小鼠90只,8周龄,购自空军军医大学实验动物中心,动物生产许可证号:SCXK(军)2007-007号。主要药物:DOX购自美国Sigma公司。主要试剂:乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽(GSH)检测试剂盒均购自南京建成生物工程研究所,超氧化物阴离子荧光探针(DHE)购自美国Invitrogen公司,TUNEL检测试剂盒购自美国Roche Biochemicals公司,sirt5、核因子E2相关因子2(Nrf2)、Kelch样ECH关 联 蛋 白1(keap1)、超 氧 化 物 歧 化 酶1(SOD1)、血红素加氧酶1(HO-1)、醌氧化还原酶1(NQO-1)及裂解半胱天冬酶3(cleaved Caspase-3)抗体均购自美国Abcam公司;sirt5-MUT和sirt5-WT荧光素酶报告质粒由广州力博生物科技有限公司构建,miRNA NC、miR-145-5p mimic和miR-145-5p in⁃hibitor载体均购自广州Ribo-Bio公司,miR-145-5p、sirt5、U6和GAPDH的引物均由上海生工生物工程科技有限公司构建,sirt5慢病毒载体购自上海和元生物技术股份有限公司。
1.2 miR-145-5p对DOX所致小鼠心肌损伤作用的观察
1.2.1 动物分组及miR-145-5p处理将50只C57BL/6小鼠随机分为Control组、DOX组、DOX+NC组、DOX+inhibitor组和DOX+mimic组,每组10只。除对照组外均腹腔注射DOX 15 mg/kg,Control组注射等体积生理盐水,DOX+NC组、DOX+inhibitor组和DOX+mimic组在注射DOX前3 d分别经尾静脉注射10 nmol/L的miRNA NC、miR-145-5p inhibitor和miR-145-5p mimic载体。miRNANC序列:5′-CAGUA⁃CUUUUGUGUAGUACAA-3′,miR-145-5p inhibitor序列:5′-AGGGAUUCCUGGGAAAACUGGAC-3′,miR-145-5p mimic序列:5′-GUCCAGUUUUCCCAGGAAUCC⁃CU-3′。
1.2.2 心功能采用M型标准二维超声心动图检查。各组注射DOX后14 d,异氟醚麻醉后置于操作平台上,经胸骨旁长轴位M型图像测量参数,并计算出左心室射血分数(LVEF)和左心室短轴缩短率(LVFS),以此评价左心室收缩功能。
1.2.3 心肌组织病理改变采用HE染色。各组心功能检查结束后处死,取出心脏,将部分心脏标本制备5 μm厚的石蜡切片,经脱蜡、水合操作后用生理盐水洗净。苏木素染色30 min,加入0.02%伊红,光镜下观察心肌组织病理变化。
1.2.4 血清心肌损伤标志物LDH、CK-MB采用酶学速率法。各组小鼠处死后留取静脉血,静置后取上清,检测血清LDH、CK-MB水平,严格按照试剂盒说明书进行操作。
1.2.5 心肌组织细胞凋亡采用TUNEL法。将各组心脏组织石蜡切片经脱蜡水合后,用蛋白酶K打孔30 min。按照TUNEL试剂盒说明书避光滴加TUNEL反应混合物,于水浴箱中孵育1 h。PBS溶液洗片后加入DAPI染液,复染细胞核。激光共聚焦显微镜下观察,凋亡细胞核显示为绿色,所有细胞核显示为蓝色,以发绿色荧光细胞数占蓝色荧光细胞数的百分比表示细胞凋亡率。
1.2.6 心肌组织凋亡蛋白cleaved Caspase-3采用Westen blotting法。取各组小鼠心脏组织,提取蛋白质样本,样品检测浓度后,采用SDS-PAGE凝胶分离,转移到PVDF膜上。5%脱脂牛奶封闭,加入cleaved Caspase-3一抗(1∶1 000),4℃孵育过夜;洗涤后加入辣根过氧化物酶标记的二抗(1∶2 000),室温孵育2 h。以β-actin作为内参,采用增强化学发光法和生物特征凝胶成像系统检测蛋白水平,计算cleaved Caspase-3蛋白相对表达量。
1.2.7 miR-145-5p与sirt5的靶向关系采用双荧光素酶报告基因实验。使用miRanda(http://www.microrna.org)和TargetScan(http://www.targetscan.org)筛选miR-145-5p的靶基因,结果显示sirt5 3'UTR包含一个miR-145-5p的结合位点,提示sirt5是miR-145-5p的潜在靶基因(图1)。将H9c2细胞分为四部分,分别共转染sirt5-WT、sirt5-MUT和miR-145-5p mimic、阴性对照NC质粒,采用LB960光度计测定荧光素酶活性。结果显示,共转染sirt5-WT和miR-145-5p mimic质粒的H9c2细胞荧光素酶活性明显低于其他细胞(P均<0.05,图2),提示sirt5是miR-145-5p的靶基因。

图1 sirt5 3'UTR与miR-145-5p的结合位点
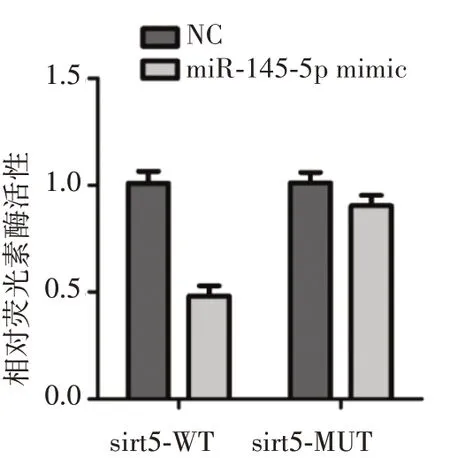
图2 双荧光素酶报告基因实验结果
1.2.8 心肌组织miR-145-5p和sirt5 mRNA采用实时荧光定量PCR法。取各组小鼠心脏组织,采用TRIzol试剂盒提取总RNA,使用逆转录试剂盒对总RNA进行反转录,并进行cDNA扩增。PCR反应过程:95℃预变性5 min,94℃变性30 s,60℃退火30 s,共40个循环。以U6为内参,采用2-ΔΔCt法计算心肌组织miR-145-5p和sirt5 mRNA相对表达量。
1.3 miR-145-5p、sirt5在DOX诱导小鼠心肌损伤中的调控作用及机制观察
1.3.1 sirt5慢病毒质粒的制备将sirt5插入pLVX-Puro慢病毒载体。将HEK293T细胞通过Li⁃pofactamine 2000转染pLVX-Puro DUSP6(1 000 ng)、psPAX2(100 ng)和pMD2G(900 ng),以制备慢病毒。转染后4~6 h,将细胞培养基改为生长培养基,48 h后收集病毒质粒。
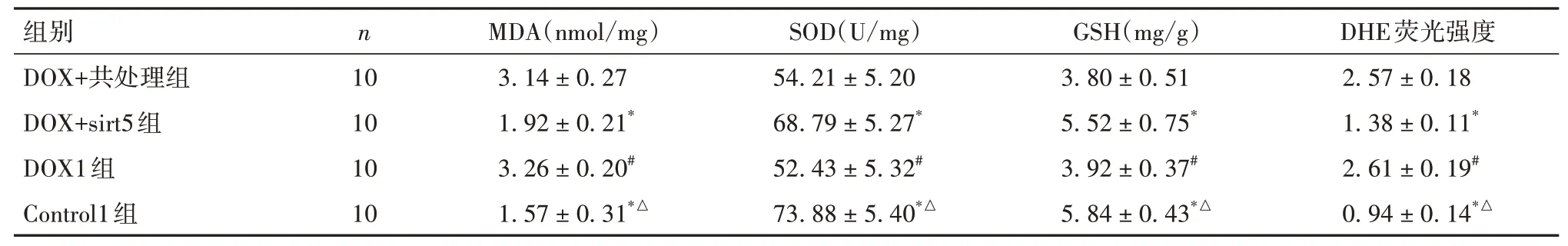
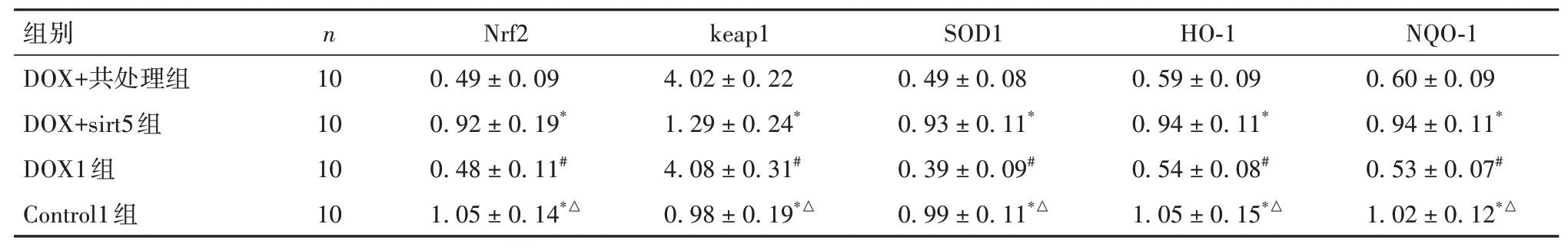
1.3.2 动物分组及miR-145-5p、sirt5处理将40只C57BL/6小鼠 随机 分为Control1组、DOX1组、DOX+sirt5组及DOX+共处理组,每组10只。除Con⁃trol1组外均腹腔注射DOX 15 mg/kg,Control1组注射等体积生理盐水。DOX+sirt5组及DOX+共处理组在注射DOX前3 d经尾静脉注射sirt5慢病毒质粒100 μL,DOX+共处理组同时经尾静脉注射miR-145-5p mimic 10 nmol/L。各组分组处理后14 d进行处死,取出心脏组织。
1.3.3 心肌组织MDA、SOD、GSH和DHE荧光强度将各组小鼠左心室新鲜心脏标本置于冷盐水中,匀浆机匀浆,离心取上清。采用酶学速率法检测MDA、SOD、GSH表达。将心肌标本经液氮速冻后制成冰冻切片,按照DHE试剂盒说明书避光滴加DHE反应液,于水浴箱中孵育30 min,PBS溶液洗片后用激光共聚焦显微镜观察;采用Image J软件分析DHE荧光强度,以此表示ROS生成情况。
1.3.4 心肌组织sirt5通路相关Nrf2、keap1、SOD1、HO-1及NQO-1蛋白参照“1.2.6”,以β-actin为内参,采用Westen blotting法检测心肌组织sirt5通路相关Nrf2、keap1、SOD1、HO-1及NQO-1蛋白表达。
1.4 统计学方法采用GraphPad Prism 6统计软件。计量资料采用Shapiro-Wilk正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 五组小鼠LVEF、LVFS比较DOX+inhibitor组、Control组>DOX组、DOX+NC组>DOX+mimic组(P均<0.05)。见表1。
表1 五组小鼠LVEF、LVFS比较(±s)

表1 五组小鼠LVEF、LVFS比较(±s)
注:与DOX+mimic组比较,*P<0.05;与DOX组和DOX+NC组比较,#P<0.05。
?
2.2 五组小鼠心肌组织病理学改变比较与Con⁃trol组相比较,DOX组和DOX+NC组小鼠心肌组织空泡化变性显著,且出现不同程度的肌纤维紊乱和断裂;与DOX组比较,DOX+inhibitor组小鼠心肌组织空泡化变性及肌纤维紊乱、断裂情况均减轻,而DOX+mimic组则均加剧。见OSID码图1。
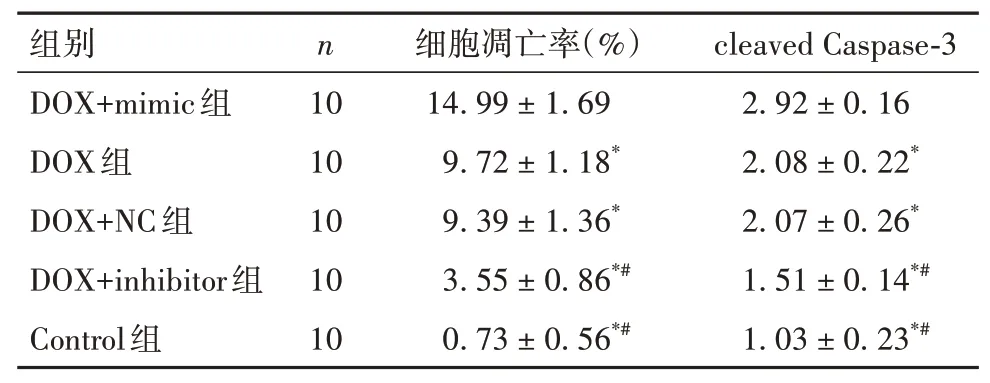
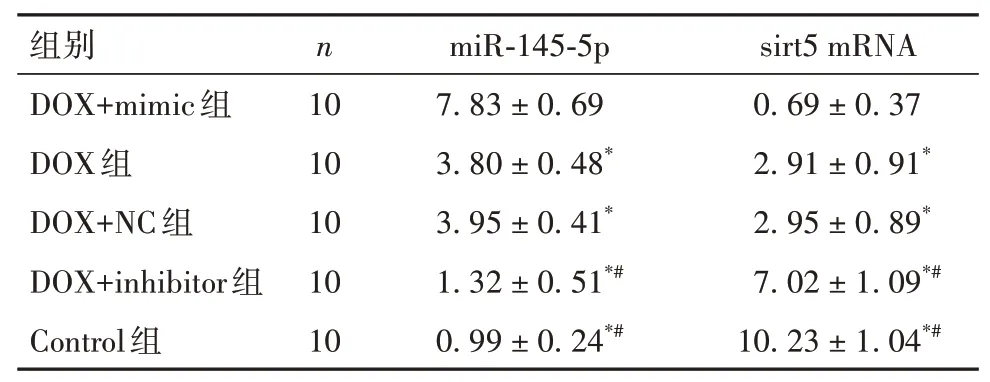
2.3 五组小鼠血清LDH及CK-MB水平比较DOX+inhibitor组、Control组 表2 五组小鼠血清LDH、CK-MB水平比较(±s) 表2 五组小鼠血清LDH、CK-MB水平比较(±s) 注:与DOX+mimic组比较,*P<0.05;与DOX组和DOX+NC组比较,#P<0.05。 ? 2.4 五组小鼠心肌组织细胞凋亡情况比较DOX+inhibitor组、Control组 表3 五组小鼠心肌组织细胞凋亡率及cleaved Caspase-3蛋白相对表达量比较(±s) 表3 五组小鼠心肌组织细胞凋亡率及cleaved Caspase-3蛋白相对表达量比较(±s) ? 2.5 五组小鼠心肌组织miR-145-5p、sirt5 mRNA相对表达量比较miR-145-5p:DOX+inhibitor组、Con⁃trol组 表4 五组小鼠心肌组织miR-145-5p、sirt5 mRNA相对表达量比较(±s) 表4 五组小鼠心肌组织miR-145-5p、sirt5 mRNA相对表达量比较(±s) 注:与DOX+mimic组比较,*P<0.05;与DOX组和DOX+NC组比较,#P<0.05。 ? 2.6 四组小鼠心肌组织MDA、SOD、GSH表达和DHE荧光强度比较MDA、DHE荧光强度:DOX+共处理组、DOX1组>DOX+sirt5组、Control组,SOD、GSH:DOX+共处理组、DOX1组 表5 四组小鼠心肌组织MDA、SOD、GSH表达和DHE荧光强度比较(±s) 表5 四组小鼠心肌组织MDA、SOD、GSH表达和DHE荧光强度比较(±s) 注:与DOX+共处理组比较,*P<0.05;与DOX+sirt5组比较,#P<0.05;与DOX1组比较,△P<0.05。 ? 2.7 四组小鼠心肌组织Nrf2、keap1、SOD1、HO-1及NQO-1蛋白相对表达量比较Nrf2、SOD1、HO-1及NQO-1:DOX+共处理组、DOX1组 表6 四组小鼠心肌组织Nrf2、keap1、SOD1、HO-1及NQO-1蛋白相对表达量比较(±s) 表6 四组小鼠心肌组织Nrf2、keap1、SOD1、HO-1及NQO-1蛋白相对表达量比较(±s) 注:与DOX+共处理组比较,*P<0.05;与DOX+sirt5组比较,#P<0.05;与DOX1组比较,△P<0.05。 ? DOX是一种从链霉菌中提取的蒽环类药物,其广谱的抗肿瘤作用以及长期使用后严重的不良反应均引起了人们的广泛关注[9]。DOX对各种器官特别是心脏有损伤作用,当DOX达到一定累积剂量时,可诱发充血性心力衰竭,并且DOX诱导的心肌损伤可出现在任何治疗阶段[3]。因此,有必要寻找有效的治疗措施,以对抗DOX诱导的心肌损伤。miR-145-5p在心血管疾病的发生发展中起重要调节作用。HUANGFU等[4]研 究 表 明,miR-145-5p通 过PI3K/AKT信号通路促进心肌梗死大鼠的心肌细胞凋亡。WU等[10]研究发现,miR-145-5p通过靶向调控DUSP6分子诱导缺血再灌注后的细胞凋亡。HE等[11]研究发现,西地那非通过抑制miR-145-5p表达,可减轻猪心脏骤停复苏后的心肌功能障碍。本研究结果显示,与Control组比较,DOX组小鼠心肌组织miR-145-5p表达升高,LVEF、LVFS均降低,血清LDH及CK-MB水平升高,心肌组织病理损伤及细胞凋亡增加;与DOX组比较,DOX+mimic组上述指标均升高,DOX+inhibitor组上述指标均降低;这提示DOX可引起小鼠心肌损伤,抑制miR-145-5p表达可以减轻DOX诱导的这种心肌损伤。因此,miR-145-5p可能是参与DOX诱导心肌损伤的关键因子。 DOX致心脏毒性的发病机制是近年来研究的热点,许多研究表明DOX诱导的心肌损伤可能与氧化应激、钙超载、心肌细胞凋亡和自噬有关,其中氧化应激在DOX诱导的心肌损伤发病机制中起着重要作用[12]。DOX在代谢过程中产生的半醌型状态能迅速将其不成对的电子转移到氧分子上,产生大量的超氧阴离子自由基,从而导致细胞损伤、线粒体功能障碍和DNA损伤[13]。同时,DOX还可以与铁结合破坏铁的稳态,进而产生大量的ROS。ROS与细胞线粒体膜上的磷脂相互作用也可导致线粒体功能障碍,继而影响能量代谢[14]。更重要的是,DOX诱发的氧化应激可通过内、外源性凋亡途径诱导大量心肌细胞凋亡,引起严重的心功能障碍[13]。因此,抑制氧化应激可能是预防和治疗DOX致心脏毒性的有效方法之一。 研究证明,多种分子机制和信号通路可以调节氧化应激,miR-145在参与调控氧化应激过程中也发挥了关键作用。HUI等[15]研究表明,miR-145可以调节高糖诱导的视网膜内皮细胞的氧化应激和炎症反应。XIN等[5]研究显示,miR-145-5p可促进舌鳞状细胞癌细胞凋亡和氧化应激反应。LI等[16]研究显示,薯蓣皂苷可通过调节miR-145-5p介导的氧化应激,而改善甲氨蝶呤诱导的肝、肾损伤。本研究通过双荧光素酶报告基因检测结果证实,miR-145-5p可以直接靶向调控sirt5基因,Westen blotting法结果显示二者的表达是负调控关系,因此为进一步探讨miR-145-5p能否通过调节sirt5信号通路而促进DOX诱导的心肌氧化应激损伤提供了依据。 sirt5广泛分布于细胞核、细胞质和线粒体中,被认为在维持细胞正常代谢中扮演重要角色。sirt5可通过其N端过氧化物酶体定位信号,进入过氧化物酶体,减少细胞内H2O2的产生,从而在细胞氧化中起主要作用[6]。此外,研究证实sirt5可通过调控Nrf2表达来调节氧化应激[17]。激活后的Nrf2能负向调控其与keap1的聚合或解离,转位到核区并与抗氧化反应元件结合,从而控制各种抗氧化基因和酶的表达,以对抗氧化应激[18]。本研究结果显示,与Control1组、DOX+sirt5组比较,DOX1组、DOX+共处理组小鼠心肌组织SOD、GSH表达均降低,MDA表达及DHE荧光强度升高,sirt5下游通路分子Nrf2、SOD1、HO-1和NQO-1表达均降低,keap1表达升高;提示sirt5高表达可减轻DOX诱导的小鼠心肌组织氧化应激损伤,但是可以被miR-145-5p高表达显著逆转,以上结果进一步提示miR-145-5p可靶向负调控sirt5表达,并进一步抑制sirt5下游通路分子Nrf2、SOD1、HO-1和NQO-1的表达,以促进DOX诱导的心肌氧化应激损伤。 综上所述,miR-145-5p参与了DOX诱导的小鼠心肌损伤,其机制可能与靶向负调控sirt5表达,并进一步抑制sirt5下游通路分子Nrf2、SOD1、HO-1和NQO-1表达,从而促进心肌氧化应激反应有关。因此,通过抑制miR-145-5p或促进sirt5表达可能成为未来DOX治疗患者发生心肌损伤时进行干预的关键分子靶点。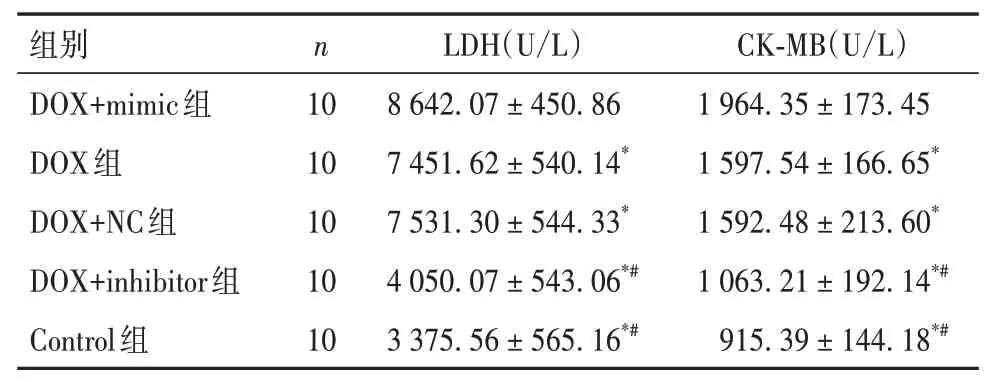
3 讨论

