小麦麸皮膳食纤维的改性研究
周宇朦, 孙洪浩, 吕福军
(辽宁波尔莱特农牧实业有限公司,辽宁沈阳 110122)
小麦麸皮是小麦制粉过程中的副产物,其产量丰富,价格便宜(陆明红等,2018),含有大量脂肪、蛋白质、维生素等营养物质,以及较多的膳食纤维(Gunenc等,2013;Bonnand等,2010;Nancy等,2005)。超过85%的小麦麸皮都用于发酵和饲料行业(宋硕,2020),是猪日粮中应用最广泛的纤维原料(肖真明等,2017)。因为家禽缺乏分解这些膳食纤维成分的内源酶,导致小麦麸皮纤维难以被降解,综合利用率低,因此促进小麦麸皮纤维改性的研究有重要现实意义。
膳食纤维(DF)根据水溶性的不同,被分为可溶性膳食纤维(SDF)和不溶性膳食纤维(IDF)两种(康琪等,2007)。IDF主要作用于肠道产生机械蠕动作用,而SDF则更多发挥代谢功能,如影响可利用碳水化合物和脂类代谢,降低血脂胆固醇等(王岸娜等,2009;黄才欢等,2006)。常用的DF降解处理有化学处理、生物酶处理法、微生物发酵法和物理法等(向琴,2015)。生物酶法降解主要是使用各种纤维素酶、半纤维素酶、蛋白酶等控制一定的反应条件,对纤维进行酶解,破坏纤维和其他营养物质的交联结构,提高其可溶性纤维含量和蛋白质等其他营养成分的溶出,从而改变其物理性质(张思耀,2009)。
本研究采用酶解法来实现小麦麸皮DF的改性研究,通过单因素和正交试验优化酶解的工艺条件,同时考察酶解试验对小麦麸皮DF功能性质的影响,综合考虑生产成本、时间成本等,为高附加值开发猪用纤维原料提供试验数据。
1 材料与方法
1.1 试验材料与试剂 麦麸,市售;3种木聚糖酶、1种纤维素酶、2种果胶酶,购自多个厂家;热稳定α-淀粉酶溶液、蛋白酶、淀粉葡糖苷酶溶液、酸洗硅藻土,均来自Sigma公司;氢氧化钠、浓硫酸、乙醇、丙酮、重铬酸钾洗液、甲醛等均为分析纯,购自国药集团化学试剂有限公司。
1.2 试验仪器 CP2102电子天平,奥豪斯仪器(常州)有限公司;HJ-6A数显恒温磁力加热搅拌器,常州金坛良友仪器有限公司;FiveEasy Plus pH计,梅特勒-托力多仪器(上海)有限公司;GSP-9080MBE隔水式恒温培养箱,上海博迅实业有限公司医疗设备厂;101-2AB型电热鼓风干燥箱,天津市泰斯特仪器有限公司;TGL-16C离心机,上海安亭科学仪器厂;HH-4数显恒温水浴锅,常州智博瑞仪器制造有限公司;752紫外可见分光光度计,上海佑科仪器仪表有限公司。
1.3 单因素试验
1.3.1 酶解时间对小麦麸皮DF的影响 取原料,每份加60%水,0.6%的复合酶(木聚糖酶:纤维素酶:果胶酶=1:1:1),在45℃培养箱中分别酶解8、15、20 h和24 h。酶解结束后高温灭酶,85℃烘干粉碎。测定总膳食纤维(TDF)、IDF、SDF、还原糖、持水力和膨胀力。
1.3.2 酶添加种类对小麦麸皮DF的影响 取原料,每份加60%水,0.6%的单酶(3种木聚糖酶,1种纤维素酶,2种果胶酶),在45℃培养箱中酶解20 h。酶解结束后高温灭酶,85℃烘干粉碎。其余同上。
1.3.3 酶配比对小麦麸皮DF的影响 取原料,每份加60%水,0.6%不同配比的酶,在45℃培养箱中酶解20 h。酶解结束后高温灭酶,85℃烘干粉碎。其余同上。
1.3.4 酶用量对小麦麸皮DF的影响 取原料,每份加60%水,0%~0.7%的酶,在45℃培养箱中酶解20 h。酶解结束后高温灭酶,85℃烘干粉碎。其余同上。
1.4 正交试验设计 在获得最佳作用条件(还原糖得率最高)的基础上,进行正交试验设计,以酶解时间、酶配比和酶用量为试验因素,以还原糖含量为判断指标,优化得到适宜的麸皮酶解试验条件。
1.5 指标测定及方法
1.5.1 膳食纤维 膳食纤维测定参照GB/T5009.88-2014进行。
1.5.2 还原糖 还原糖测定采用DNS比色法。
1.5.3 持水力 持水力的测定参照Esposito等(2005)的方法。称取1.0 g样品于烘至恒重的50 mL离心管中,加入30 mL蒸馏水,室温下摇晃30 min,4000 r/min离心20 min,弃去上清液并用滤纸吸干离心管壁残留的水分,80℃烘干10 min,略除去表面多余水分,称重。持水力计算公式如下:

1.5.4 膨胀力 准确称取1.0 g样品置于25 mL量筒中,测定干粉体积,加入蒸馏水使总体积至15 mL处,振荡均匀,使其充分吸收水分,室温下静置24 h,读取量筒中样品体积数(曹树稳等,1997)。膨胀力计算公式如下:1.6 数据处理 试验数据使用Microsoft Excel进行记录和统计,使用Origin 75软件进行做图。

2 结果与分析
2.1 单因素试验
2.1.1 酶解时间对小麦麸皮膳食纤维的影响 由图1可见,其他条件相同,酶解0~20 h时,随着酶解时间的延长,酶解后样品的TDF、IDF、SDF、持水力和膨胀力下降,还原糖增加。20~24 h时,还原糖开始下降,故确定最佳酶解时间为20 h。使用最佳酶解时间酶解时,TDF减少了5.46%,IDF减少了5.26%,SDF增加了0.99%,持水力减小了1.46%,膨胀力减少了0.9%,还原糖增加了14.05%。
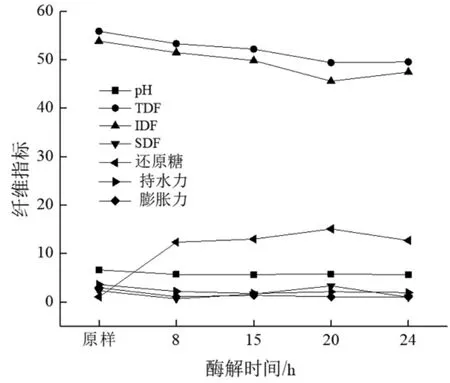
图1 酶解时间对小麦麸皮膳食纤维的影响
2.1.2 酶添加种类对小麦麸皮膳食纤维的影响由图2可见,其他条件相同,添加不同的酶进行酶解(木1、木2、木3、纤1、果1、果2)时,酶解后样品的TDF、IDF、SDF、持水力和膨胀力下降,还原糖增加。从图中可以看出,在相同酶用量的情况下,酶解效果是纤维素酶>木聚糖酶>果胶酶。使用效果最好的酶酶解时,TDF减少了10%,IDF减少了9%,持水力减小了0.62%,膨胀力减少了0.6%,还原糖增加了11.55%。

图2 酶添加种类对小麦麸皮膳食纤维的影响
2.1.3 酶配比对小麦麸皮膳食纤维的影响 预试验时发现,复合酶中是否添加果胶酶对酶解效果无明显影响,接下来的试验不再添加果胶酶。由图3可见,在其他条件相同时,添加不同配比的复合酶进行酶解(木聚糖酶:纤维素酶=7:1、5:1、3:1、1:1、1:3、1:5、1:7)。当木聚糖酶和纤维素酶的比例变化时,纤维指标的变化趋势相似,都是TDF、IDF、SDF、持水力和膨胀力先下降再上升,还原糖先上升再下降。拐点发生在5:1和1:5处,因为5:1时还原糖含量更高,故确定5:1为最佳酶配比。使用最佳酶配比酶解时,TDF减少了11%,IDF减少了10%,SDF减少了1.1%,持水力减小了0.4%,膨胀力减少了1.2%,还原糖增加了13.39%。

图3 酶配比对小麦麸皮膳食纤维的影响
2.1.4 酶用量对小麦麸皮膳食纤维的影响 由图4可见,在其他条件相同时,随着酶制剂的不断添加(0、0.3%、0.4%、0.5%、0.6%、0.7%),酶解后的样品TDF、IDF、SDF、持水力和膨胀力下降越来越明显,还原糖增加越来越多。综合考虑,最后确定最佳酶用量为0.6%。 使用最佳酶用量酶解时,TDF减少了4%,IDF减少了7%,SDF减少了2%,持水力减小了0.7%,膨胀力减少了0.8%,还原糖增加了12.72%。

图4 酶用量对小麦麸皮膳食纤维的影响
2.2 正交试验结果与分析 根据单因素试验结果,选取L9(34)正交试验设计探讨麸皮复合酶酶解的最优工艺参数(李云雁等,2006),正交试验因素水平见表1,结果分析见表2,方差分析见表3。

表1 试验处理与设计
由表2可见,在9个试验结果中,试验4的还原糖含量最高,为14.62%,其水平组合为A2B1C2,即酶解时间20 h、酶配比1:3、酶用量0.6%。由表2和表3的R值、F值可知,本试验因素存在显著性顺序,其主要关系为A>C>B,即酶解时间>酶用量>酶配比。

表2 正交试验结果与分析

表3 正交试验的方差分析
3 讨论
商品饲料禁止添加具有促生长作用的药物饲料添加剂后,DF对畜禽肠道健康的重要性成为热点话题。麸皮加入酶制剂改性后,可以提高DF的消化率,提高其他营养素的利用率,并增加肠道微生物的可发酵资源,改善肠道健康(徐运杰等,2021)。在酶解时间的探究试验中,监测样品pH的变化,是为了避免酶解时间过长,开始发酵,产生酸和其他有害物质影响品质(刘豪等,2019)。本试验中,酶解后还原糖含量逐渐上升,20 h后开始下降,可能是因为杂菌生长,发酵消耗了酶解产物(刘豪等,2019)。麸皮中含有高比例的DF,包括非淀粉多糖、木质素和其他不易消化的碳水化合物(郭娜,2013)。非淀粉多糖中有21.9%阿拉伯木聚糖,1.9%果胶,10.7%纤维素,0.4%葡聚糖,0.4%甘露聚糖(苗字叶等,2020)。本试验中,用多种木聚糖酶、纤维素酶和果胶酶分别酶解,发现对麸皮的酶解效果从大到小是纤维素酶、木聚糖酶、果胶酶。在酶配比试验中,发现是否添加果胶酶对酶解效果影响甚微,考虑到麸皮只含有1.9%的果胶,并且纤维素酶与木聚糖酶对DF的改性有重要作用(张玉倩,2011),故复合酶中不再添加果胶酶,重点研究木聚糖酶和纤维素酶的添加比例,最大化的发挥酶制剂的作用。在酶解过程中,酶用量也不是越多越好,因为纤维素酶虽然能有效地降解细胞壁,但是当酶浓度增加后,会增加酶的竞争抑制作用(张玉倩,2011),纤维素酶对细胞壁纤维素的降解是有限的。
在酶解试验的过程中,要尽量使用新鲜麸皮。因为麸皮通气性差,不易长期保存,易酸败、发酵等,会造成酶解效果的差异。DF在具有积极营养特性的同时,还会造成饲料的表观代谢能(AME)值降低和生长缓慢,并不是IDF越低越好,SDF越高越好,要注意配方中DF的设置水平(徐运杰等,2021)。酶解过程中,非淀粉多糖被降解成还原糖,TDF下降,还原糖增加。IDF水解得到可溶性成分,IDF下降,同时一部分可溶性大分子也被降解成为不溶的小分子物质,导致SDF下降(陶颜娟,2005)。麸皮的化学组成特性是含有很多亲水基团,具有良好的持水性和膨胀性(陶颜娟,2005)。酶解过程中,膳食纤维的纤维素及半纤维素的长链断裂,微晶纤维素结构破坏,胶效应消失,持水力和膨胀力下降。样品酶解结束后会经过烘干和粉碎,粉碎后更细的DF溶解度较好,有一部分会溶于水而对持水力、膨胀力没有贡献(张玉倩,2011)。同时过度粉碎,会破坏膳食纤维的物理结构,使原先可以吸收自由水的空间减少,从而减少膨胀力和持水力(刘倍毓,2011)。
4 结论
本试验结果表明,麸皮经过酶解处理后,其TDF、IDF、SDF、持水力和膨胀力都发生下降,还原糖大幅度增加。麸皮最佳酶解条件为酶添加量0.6%,加木聚糖酶:纤维素酶=1:3,酶解时间20 h。

