半滑舌鳎肠道中抗氧化活性乳酸杆菌的筛选与鉴定
郭 东, 包瑞璇, 王 逸, 卢 静, 吕明生*, 王淑军
(1.江苏海洋大学海洋生物资源与环境重点实验室/海洋生物技术重点实验室,江苏海洋大学,江苏连云港 225005;2.江苏省海洋生物产业技术协同创新中心,江苏连云港 222000)
半滑舌鳎鱼(Cynoglossus semilaevis)属于舌鳎属,经中国水产研究院黄海研究所成功训化后,是我国重要水产养殖品种之一(张馨馨,2021)。鱼体内脂肪中含有丰富的不饱和脂肪酸,具有防止动脉粥样硬化、防治心血管疾病、增强记忆力和防止视力衰退等功效(张永真等,2016;王娜,2010)。该种鱼多产于我国渤海湾、胶州湾和海州湾等海域(孙中之等,2005),近年来随着养殖数量的增加,腹水病、烂鳍病、肠炎病等疾病经常发生(苏兆军,2015)。水产养殖中急需有效的病害防控措施。
乳酸菌是水产养殖中重要的微生态菌种之一,通过产生有机酸、乳酸菌素等提高养殖动物抵抗力(巩华等,2018)。研究发现,乳酸菌和发酵产物还具有抗氧化作用。通过在饲料中添加具有抗菌和抗氧化作用的乳酸菌,可以实现健康养殖(曹卫华,2017)。本研究从半滑舌鳎鱼肠道中筛选乳酸菌,并对其生长特性、抑菌作用、抗氧化活性以及其对饲料脂质抗氧化作用进行了研究,拟为获得的乳酸菌的应用奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 原材料 健康的半滑舌鳎鱼:水产品养殖场;高脂半滑舌鳎鱼饲料:通威股份;创伤弧菌、大肠杆菌、副溶血弧菌、维氏气单胞菌、霍乱弧菌、金黄色葡萄球菌、枯草芽孢杆菌、库氏链霉菌、拟杆菌、嗜水气单胞菌等指示菌株:江苏海洋大学海洋资源与环境重点实验室。
1.1.2 试剂与培养基 胰蛋白酶、胃蛋白酶、木瓜蛋白酶、蛋白酶K:购于南京都莱生物技术有限公司;过氧化氢酶:购于上海阿拉丁试剂;革兰氏染色试剂盒:购于北京索莱宝科技有限公司;DNA marker2000、DNA marker5000:购自Takara-宝日医生物技术(北京)有限公司;电泳用琼脂糖:购于BIOWEST公司;细菌DNA基因组提取试剂盒:购于生工生物工程(上海)股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):Sigma公司;MRS肉汤:北京陆桥技术股份有限公司。
1.1.3 仪器设备 1510酶标仪:美国Thermo公司;SPX-150B-Z生化培养箱:上海博讯实业有限公司;XN-26高速冷冻离心机:美国Beckman Coulter公司。
1.2 试验方法
1.2.1 乳酸菌鉴定
1.2.1.1 革兰氏染色 将培养10 h的菌株进行革兰氏染色鉴定。
1.2.1.2 16SrDNA鉴定 将革兰氏染色阳性的菌株提取基因组,选用细菌鉴定通用引物,经提取菌株基因组,PCR扩增,琼脂糖凝胶电泳检测后寄上海生工生物公司检测,测序结果与GenBank数据库比对后绘制系统进化树(高鹏,2016;吕爱军等,2010)。
1.2.2 乳酸菌对病原菌的抑制 采用牛津杯法。将分离菌株接种MRS液体培养基,37℃,48 h,取部分发酵液7300×g,4℃离心30 min(郭凤茹,2019;Komora等,2017)。选取创伤弧菌、大肠杆菌、副溶血性弧菌、哈维氏菌、霍乱弧菌、金黄色葡萄球菌、枯草芽孢杆菌、库氏链霉菌、拟杆菌和嗜水气单胞菌活化后,稀释涂布于LB培养基,灭菌牛津杯放置涂菌培养基表面加入200μL发酵上清液,37℃,24 h,测定抑菌圈直径。
1.2.3 乳酸菌生长特性
1.2.3.1 耐酸性 将菌株接种于用1 mol NaOH和1 mol的HCl调节pH至2.0和3.0的MRS液体培养基中,37℃培养,分别于0、2、4、6 h取样测定发酵液OD600(杜金城等,2016;Pakarian等,2016),不调节pH的MRS培养基为对照。
1.2.3.2 耐胆盐 在MRS液体培养基添加0、0.1%、0.3%、0.5%的胆盐(杜金城等,2016;郝志明等,2006)。接种菌株,37℃培养,分别于0、2、4、6 h取样测定发酵液OD600。
1.2.4 抗生素对乳酸菌生长的影响 采用药敏纸片扩散法。菌株100μL菌液涂布MRS培养基,放置数分钟,选用硫酸卡那霉素、氨苄青霉素、硫酸链霉素和氯霉素四种抗生素,药敏试纸含抗生素量为10μg/mL。将药敏试纸分别放置于培养基,37℃培养24 h(任士菊等,2014;Newaj-Fyzul等,2014),测定抑菌圈直径。
1.2.5 抑菌物质的鉴定 分别检测过氧化氢酶、蛋白酶、pH、加热处理和超滤对抑菌物质活性的影响,采用牛津杯法,测定上清液抑菌圈的大小(马迎涛,2016;Ngo,2015)。
1.2.5.1 过氧化氢酶 调节菌株发酵上清液至过氧化氢酶的最适pH 7.0,加入浓度为5 mg/mL的过氧化氢酶,37℃处理2 h,处理后调节pH与对照上清液相同。
1.2.5.2 蛋白酶 菌株发酵上清液分别加入胰蛋白酶、木瓜蛋白酶、蛋白酶K、胃蛋白酶,使其终浓度为5 mg/mL,分别在酶的最适温度和pH条件下2 h,将上清液pH调至与对照组相同(Papagianni,2015)。
1.2.5.3 pH 菌株发酵上清液的pH调节至3.0、5.0、7.0、9.0,对照为未调节pH。
1.2.5.4 加热处理 菌株发酵上清液置于60、80、100℃条件下处理15 min,未处理的上清液为对照(迟海等,2020)。
1.2.5.5 超滤 检测活性物质的分子量。选用3、10、30、50 K和100 K超滤管,取5 mL发酵上清液超滤,4℃,2400×g离心后,取200μL,采用牛津杯法检测。指示菌为副溶血弧菌、嗜水气单胞菌。
1.2.6 乳酸菌发酵液的抗氧化活性 菌株发酵上清液、菌悬液及无细胞提取物(CFE)的制备(Li等,2013;Chen等2008)。菌株以1%接种MRS液体培养基,于37℃培养16 h。(1)发酵液4℃条件下,7300×g离心30 min,收集上清液和菌体;(2)菌体经PBS缓冲液洗3次,调整浓度为1.0×1010cfu/mL菌悬液;(3)取部分菌体超声(1500 W,10 min)破碎,4℃,7300×g离心30 min,上清液为CFE。
1.2.6.1 超氧阴离子自由基的清除能力 在含有0.05 mol的Tris-HCl缓冲液(pH 8.0,4.5 mL)和2.5mol的邻苯三酚0.4 mL溶液中加入样品100μL,置于25℃恒温水浴中放置8 min,立即滴加一滴8 mol HCl终 止反应 (余芳等,2017;Box等,2014)。在325 nm波长测定吸光度。样品的吸光度:A1,生理盐水代替样品:空白对照A0。
超氧阴离子自由基清除率/%=(A0-A1)/A0×100。
1.2.6.2 羟自由基(·OH)的清除能力 在试管中加入的FeSO4溶液(5 mol)2 mL,C7H6O3-C2H5OH(5 mol)2 mL,H2O2溶液(3 mol)2 mL,混合均匀,加入3 mL样品,37℃保温20 min,在4℃,7300×g离心10 min,上清液测定OD510数值为Aβ。以无菌生理盐水代替H2O2为空白,测定的吸光度数值为Aα;生理盐水代替样品为对照,测定的吸光度数值为Aε(Das等,2015)。
·OH自由基的清除率/%=[1-(Aβ-Aα)]/Aε×100。
1.2.6.3 DPPH自由基的清除能力 试管中加入样品和含有0.2 mol DPPH的无水乙醇溶液各2 mL,混均后避光静置30 min,4℃,7300×g离心10 min,取上清液测定OD517数值为Aγ。空白不含DPPH,记为Aθ,对照为无菌水,记为AΩ(黄玉军,2013)。
DPPH自 由 基 清 除 率/%=[1-(Aγ-Aθ)]/AΩ×100。
1.2.6.4 还原能力 玻璃试管加入样品、K3[Fe(CN)6](1%)、pH 6.6的PBS缓冲液各1 mL,混合均匀后(姚杰玢等,2015),50℃保温15 min,降至室温后加入1 mL的10%体积的C2HCl3O2,混匀,于4℃,7300×g离心10 min。取上清液、纯水和三氯乙酸试剂(0.1%)各2 mL,充分混匀,静置5min后 测 定OD700(Mikulski等,2020;Wang,2020)。样品的吸光度值为Aa,以PBS缓冲液代替样品的吸光度值为Ab。
还原能力/%=(Aa-Ab)/Ab×100。
1.2.7 抗脂质过氧化 取250 g高脂质半滑舌鳎鱼饲料样品碾碎成粉末,加入50 mL培养16 h的菌悬液或发酵上清液,拌匀,空白对照不加。于60℃条件下放置24 h后取出放入500 mL锥形瓶中,加入适量石油醚浸没样品,静置24 h后过滤,置于45℃烘箱内干燥2 h,参考伍立锋等(2011)的方法测OD572并绘制标准曲线计算过氧化值。
1.3 数据分析 采用三组平行试验设计,利用Origin 2021进行作图,应用IBM SPSS Statistics 26进行数据处理与统计,MEGA 7.0绘制系统发育树。
2 结果与分析
2.1 乳酸菌鉴定
2.1.1 革兰氏染色结果 经过多轮筛选,共获得有透明圈的菌株32株。经革兰氏染色、芽孢染色和鞭毛染色观察。其中,菌株CS1、CS2、CS4为革兰氏阳性,杆菌、无芽孢、无鞭毛、菌端钝圆。结果见图1。

图1 菌株CS1、CS2、CS4革兰氏染色结果
2.1.2 菌株16SrDNA的序列分析 三株菌16S rDNA的PCR产物的琼脂糖电泳见图2,产物大小约为1500 bp。经上海生工进行测序、比对,构建的系统进化树见图3、图4、图5。

图2 16S rDNA PCR产物的琼脂糖凝胶电泳结果

图3 菌株CS1系统进化树

图4 菌株CS2系统进化树

图5 菌株CS4系统进化树
菌株CS1和CS2与发酵乳杆菌(Lactobacillus fermentum)的同源性为99%;CS4与植物乳杆菌(Lactobacillus plantarum)的同源性为98%,确定三菌株分另为Lactobacillus sp.CS1,Lactobacillus sp.CS2,Lactobacillus sp.CS4。
2.2 菌株对病原菌生长的影响 菌株发酵上清对病原菌生长的影响见表1。菌株CS1对大肠杆菌、维氏气单胞菌、副溶血弧菌、枯草芽孢杆菌抑菌能力最强,对库氏链霉菌、拟杆菌、嗜水气单胞菌和金黄色葡萄球菌抑制能力次之,对霍乱弧菌以及创伤弧菌则无明显的抑制作用。菌株CS2和CS4对维氏气单胞菌的抑菌能力最强,对创伤弧菌、霍乱弧菌以及幽门螺旋杆菌则无抑制作用,对其余菌株均有不同程度的抑制作用。结果表明,菌株的上清液可抑制病原菌生长,具有广谱抑菌效果。

表1 菌株上清液的抑菌圈直径结果
2.3 菌株的生长特性
2.3.1 耐酸性研究结果 菌株CS1、CS2、CS4在pH 2~3条件下均可生长,生长速率略有降低(图6)。该特性有利于菌株在肠道中的定植。

图6 菌株CS1、CS2、CS4在不同pH条件下的生长曲线
2.3.2 耐胆盐研究结果 从图7可以看出,在0.1%胆盐浓度条件下,菌株CS1、CS2、CS4均可正常生长。随着胆盐浓度的增加,对菌株CS1、CS2、CS4的生长有一定影响。在0.5%胆盐条件下,菌株的生长速率较正常条件降低40%左右。肠道中胆盐可以抑制微生物的生长,菌株在不同胆盐条件下的生长特性有利于其成为肠道优势菌。

图7 菌株CS1、CS2、CS4在不同浓度胆盐下的生长曲线
2.4 药敏试验 由表2可知,氨苄青霉素钠、氯霉素对乳酸菌的生长有显著的抑制性,显示出清晰的抑菌圈,而菌株CS1、CS2、CS4对硫酸链霉素和硫酸盐卡那霉素则不敏感。

表2 乳酸菌对抗生素的耐药性
2.5 抑菌物质活性研究
2.5.1 排除过氧化氢试验结果 由表3可以看出,经过氧化氢酶处理后的上清液,菌株CS1、CS2、CS4的抑菌圈略有下降,但差异不显著。结果表明,乳酸菌不是通过产生H2O2抗菌的。
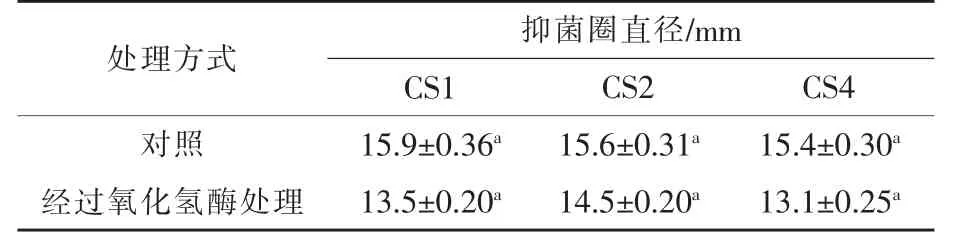
表3 乳酸菌上清液排除过氧化氢试验结果
2.5.2 蛋白酶对抑菌物质活性影响的试验结果由表4可知,经蛋白酶K处理后,没有抑菌活性,经胰蛋白酶处理后,抑菌活性显著降低。木瓜蛋白酶和胃蛋白酶对上清液的抑菌作用没有影响。推测上清液中抑菌成分为蛋白质,这与王腾腾(2017)从许氏平鲉肠道中分离的乳酸菌的结果相似。

表4 乳酸菌上清液验证蛋白性试验结果
2.5.3 pH对抑菌物质活性的影响 由表5可见,在酸性条件下,菌株CS1、CS2、CS4的发酵上清液对指示菌株的抑制能力没有显著差异;在中性条件下,抑菌能力下降;碱性条件时,抑菌能力丧失。

表5 pH对乳酸菌上清液抑菌的影响
2.5.4 抑菌物质热稳定性研究试验结果 菌株CS1、CS2、CS4发酵上清液经不同温度处理后,其抑菌能力均未有显著变化(表6),表明抑菌物质具有较强的耐高温能力,短时间在高温条件下处理,其抑菌能力不受影响。

表6 乳酸菌上清液热稳定性影响的试验结果
2.6 抑菌物质的抗氧化活性
2.6.1 对超氧阴离子自由基(O2-)的清除能力 由图8可见,三株试验菌株的上清液对超氧阴离子的清除能力最强,其中,菌株CS1最强达到(29.8±2.41)%,高于菌株CS2与CS4。三株菌株的无细胞提取物的清除能力弱,表明抗氧化物主要为菌株发酵的胞外产物。与刘洋等(2012)的研究结果相同。

图8 对超氧阴离子的清除结果
2.6.2 对羟自由基(·OH)的清除能力 由图9可知,菌株CS1、CS2、CS4的发酵上清液对羟基自由基的清除能力最强,菌悬液次之,无细胞提取物对羟基自由基的清除能力最弱;不同菌株间,CS2的上清液较其他菌株清除能力较强,达 (35.0±1.54)%;对羟基自由的的清除能力强弱则体现了该物质抗氧化能力的大小。

图9 对羟基自由基的清除结果
2.6.3 对DPPH自由基的清除能力 菌株的发酵上清液对DPPH清除能力最强,其中,菌株CS1达到(52.6±4.10)%,最弱的是菌株CS2,清除能力为(41.7±1.55)%。菌悬液的DPPH清除能力次之,无细胞提取物清除能力最弱。

图10 对DPPH自由基的清除结果
2.6.4 菌株发酵液的还原能力 从图11可以看出,菌株发酵上清液的还原能力最强,其中,菌株CS2为(27.5±3.12)%,明显高于其他两株菌株。从菌悬液的角度,菌株CS4的还原能力最强,为(20.3±2.35)%,甚至高于其自身上清液。

图11 菌株发酵液还原性试验结果
2.7 活性物质分子量估算 选取嗜水气单胞菌和副溶血弧菌作为指示菌,利用超滤管能将不同分子量物质分离开来的特性,表7和表8显示,菌株CS1、CS2、CS4的上清液中的抑菌物质主要存在于3~10 kDa,且对于不同病原菌,抑菌物质存在一定差异。结果表明,不同乳酸菌的产物和作用机制有较大的差异,与王伟(2018)试验结果相同。
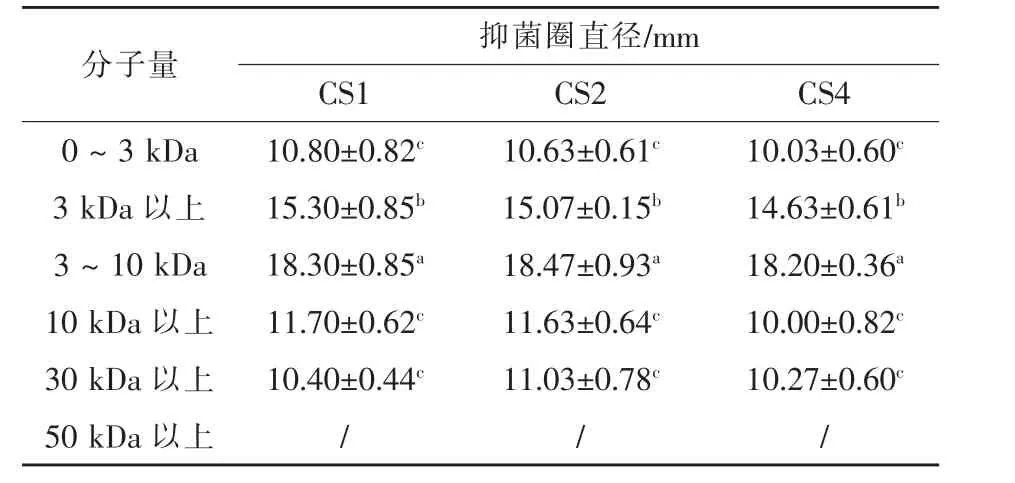
表7 不同分子量范围的上清液对嗜水气单胞菌的抑制能力

表8 不同分子量范围的上清液对副溶血弧菌的抑制能力
2.8 抗脂质过氧化 由图12可见,与空白相比,加入乳酸菌或其发酵上清的饲料,其抗脂质氧化作用显著提高,单纯加入发酵上清的效果最好。其中,菌株CS4的作用最强。
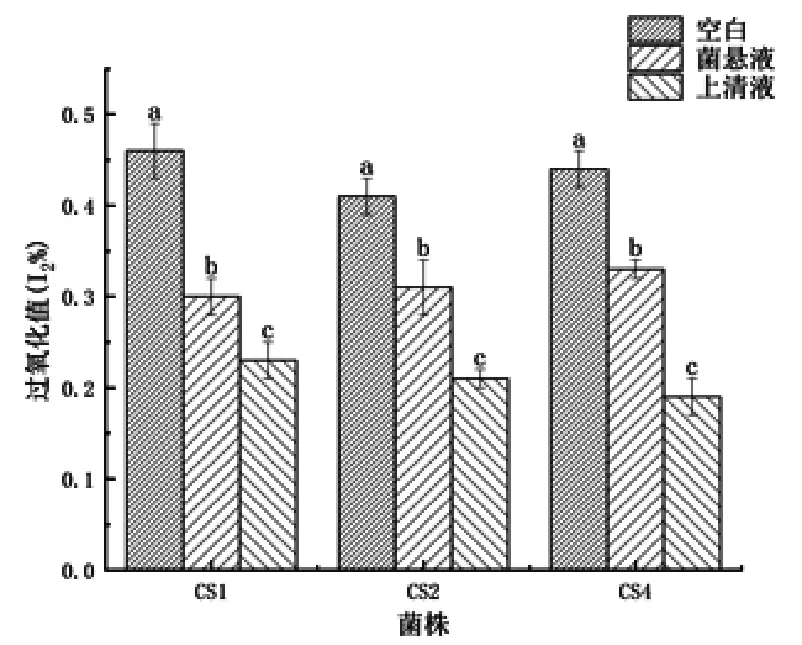
图12 乳酸菌菌株的抗脂质过氧化作用
从半滑舌鳎肠道中筛选获得的乳酸杆菌菌株CS1、CS2和CS4,具有一定的抵抗病害菌的能力,还可以提高饲料的抗脂质过氧化能力,在水产饲料加工中具有一定的应用潜力。
3 结论
从半滑舌鳎肠道中筛选并鉴定了三株乳酸杆菌菌株CS1、CS2和CS4,对病害菌具有一定的抑制能力,其中,对维氏气单胞菌的作用最强。氨苄青霉素钠和氯霉素对乳酸菌的生长有显著的抑制性;相反,菌株对硫酸链霉素和硫酸盐卡那霉素不敏感。通过排除试验,推测抑菌物质为一种耐热的蛋白质,分子量在3~10 kDa。菌株在低pH和胆盐存在条件下可以生长。菌株发酵液具有抗氧化活性,其在饲料中添加可以显著提高饲料的抗脂质过氧化能力。乳酸杆菌CS1、CS2和CS4在水产养殖以及水产饲料加工中具有一定的应用潜力。

