牛呼吸道疾病病原BVDV、IBRV、BPIV3和牛支原体的分离鉴定
吴志强,石悦萌,寇曌婷,王 鑫,黄素文,段跃强
(内蒙古华希生物科技有限公司,内蒙古 呼和浩特 010111)
近几年,畜牧业发展进入新阶段,牛繁育规模化程度显著提高,加上牛不断被调入转出,牛病也更加复杂化。牛病流行原因在于多种病毒、细菌混合感染。呼吸道疾病综合征(bovine respiratory disease complex,BRDC)是全球对养牛业损害最严重的疾病之一。该病的病原多数为牛病毒性腹泻病毒(BVDV)、牛传染性鼻气管炎病毒(IBRV)及牛副流感3型病毒(BPIV3)等。除此之外,牛支原体(Mycoplasma bovis)也可以引起牛呼吸道感染。
BVDV可感染多种偶蹄目动物,如猪、牛等[1]。BVDV感染牛后可出现流产、腹泻等症状和呼吸道相关疾病[2]。在欧洲,奶牛BVDV阳性抗体超过50%[3-4]。我国大多数省份都存在较高的发病率[1]。IBRV呈世界性流行,其主要临床表现为呼吸困难、多量黏液性鼻漏、阴道炎、高热、乳房炎和母畜流产等[5-7]。在全国范围内对IBRV进行流行病学调查发现,我国奶牛平均阳性率为35.8%,个别省份为70%[8]。BPIV在自然状态下只感染牛,且多见于集约化饲养的奶牛和肉牛[9]。BPIV3单一感染时不会引起严重的临床症状,只是引起轻微的呼吸道症状,但是病牛如果混合感染或继发感染IBRV、牛支原体等则会使病情急剧恶化。牛支原体能够引起关节炎、犊牛肺炎及乳房炎等疾病,统称为牛支原体相关疾病,并可协同其他病原体导致病情加重[10]。2008年,我国大规模暴发了牛支原体肺炎,发病率高于50%,病死率也在20%左右[11]。
本试验通过从内蒙古自治区、山西省某肉牛场采集的疑似感染呼吸道疾病牛的血液、鼻拭子中分离得到BVDV、IBRV、BPIV3和牛支原体病原,并对其进行全面系统的鉴定,为研制牛呼吸道疾病综合征疫苗提供数据支持。
1 材料与方法
1.1 试剂
病毒基因组DNA/RNA提取试剂盒,购于天根生化科技(北京)有限公司;cDNA反转录试剂盒,购于全式金;DMEM培养基,购于Gibco公司;其他试剂为常见试剂。
1.2 病料采集
内蒙古自治区、山西省某规模化牛场送检感染呼吸道疾病的15份血液和32份鼻拭子样本。
1.3 细胞
MDBK细胞,由本项目组制备并保存。
1.4 BVDV的分离鉴定
1.4.1 病毒分离与培养。将送检的疑似BVDV血液样本于37℃静置1 h,4℃、5 000 r/min离心15 min分离血清,标上序号和采样日期。待MDBK传代细胞长成单层后,用PBS(0.01 mol/L,pH值为7.2)清洗1次,将牛血清样品接种于MDBK细胞,每个样品接种4孔,另设2孔作为阴性对照。每孔0.5 mL,在37℃培养箱内吸附1 h后弃上清液,用PBS清洗后加2 mL含2%胎牛血清的DMEM细胞维持液,置37℃、含5% CO2培养箱中培养,每日镜检观察细胞病变(CPE),5 d 后收获培养液。
1.4.2 BVDV的RT-PCR鉴定。依据BVDV标准毒株公开基因序列,在其最保守的5′端非编码区序列设计合成1对特异性引物,引物序列见表1。提取病毒cDNA进行RT-PCR鉴定,PCR产物于1%琼脂糖凝胶电泳检测。

表1 BVDV引物序列
1.4.3 免疫荧光试验。将病毒液接种于长满单层的MDBK细胞,并设正常细胞对照和Oregon C24V病毒阳性对照,置37℃、含5% CO2培养箱中过夜,弃培养液,用PBS(0.01 mol/L,pH值为7.2)清洗 3次后,用80%丙酮和20%甲醇混合液-20℃固定30 min。PBS清洗后,分别加入工作浓度荧光标记的BVDV单克隆抗体0.1 mL,在37℃湿盒中作用40 min,PBS清洗后每孔再加50 μL PBS,置荧光显微镜下观察。
1.5 IBRV的分离鉴定
1.5.1 病毒分离与培养。送检的疑似感染IBRV的牛鼻拭子液经冻融3次后将棉签拧干取出,4℃2 000 r/min 离心 10 min,取上清液,用 0.22 μm微孔滤膜过滤后,接种于24孔单层MDBK细胞的培养板,每孔接种0.5 mL,设细胞阴性孔,37℃吸附1 h。吸掉孔内液体,PBS清洗2~3次,加入1 mL含2%胎牛血清的DMEM细胞培养液,置37℃、含5% CO2培养箱中培养4日,收获出现细胞病变的培养液并传代。
1.5.2 IBRV的PCR鉴定。根据GenBank参考序列,利用Primer 5.0软件设计针对gB基因的引物,引物序列见表2。提取病毒液DNA,进行PCR扩增,PCR产物用1%琼脂糖凝胶电泳检测。
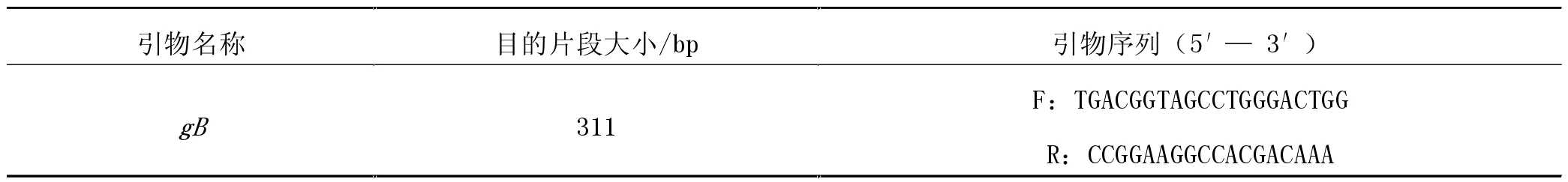
表2 IBRV gB基因扩增引物序列引物名称
1.5.3 病毒形态观察。取第3代分离毒株细胞培养物送军事医学科学院微生物流行病研究所进行负染制样,在透射电镜下观察病毒形态。
1.6 BPIV3的分离鉴定
1.6.1 病毒分离与培养。将疑似感染BPIV3的牛的鼻拭子液冻融3次后,按照1.5.1方法进行,收获出现细胞病变的培养液并传代。
1.6.2 BPIV3的RT-PCR鉴定。参考GenBank中登录的BPIV3船运热毒株全基因组序列(AF178655),设计并合成1对特异性引物进行RT-PCR扩增,于1%琼脂糖凝胶电泳检测,应扩增出425 bp目的片段。引物序列见表3。
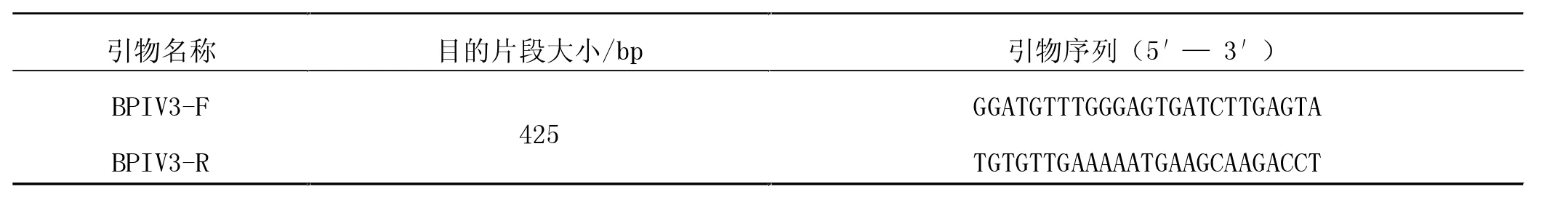
表3 BPIV3引物序列
1.6.3 病毒形态观察。取分离毒株细胞培养物送军事医学科学院微生物流行病研究所进行负染制样,在透射电镜下观察病毒形态。
1.7 牛支原体的分离鉴定
1.7.1 分离与培养。将鼻拭子接种于Hayflick液体培养基,置于37℃恒温培养箱中培养,当培养基颜色由红色变为黄色时,将滤液接种到固体培养基内培养传代,置于37℃培养4~5 d,观察固体培养基上有无菌落生长,进行吉姆萨染色、Dienes染色,并观察菌体形态。
1.7.2 PCR鉴定。提取纯化得到的培养液菌液DNA进行PCR鉴定,扩增产物于1%琼脂糖凝胶电泳检测,引物序列见表4。

表4 牛支原体引物序列
1.7.3 生化鉴定。取分离菌株分别进行生化鉴定。鉴定项目包括:红细胞吸附试验、分解葡萄糖试验、分解麦芽糖试验、分解尿素试验、分解精氨酸试验、氯化四氮唑还原试验、胆固醇需要试验、亚甲蓝着色试验和溶血试验。
2 结果与分析
2.1 BVDV分离鉴定
2.1.1 细胞试验。经MDBK细胞盲传至第2代,样品接种后第2天可见有少量细胞聚堆的细胞病变(CPE),至第3天主要表现为细胞聚堆、拉网等。对照组细胞正常(图1)。

图1 样品感染MDBK细胞产生的细胞病变(10×)
2.1.2 PCR试验。经RT-PCR扩增可得到约288 bp的特异性目的片段,阴性对照无条带(图2)。
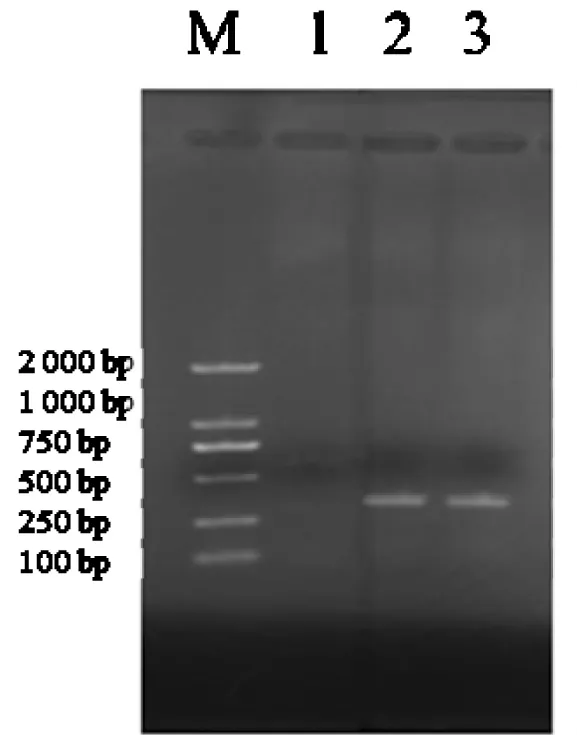
图2 BVDV PCR扩增结果
2.1.3 免疫荧光试验。在荧光显微镜下,将病毒液接种于MDBK细胞,加入BVDV特异性荧光抗体可见特异荧光。对照组细胞无可见荧光(图3)。
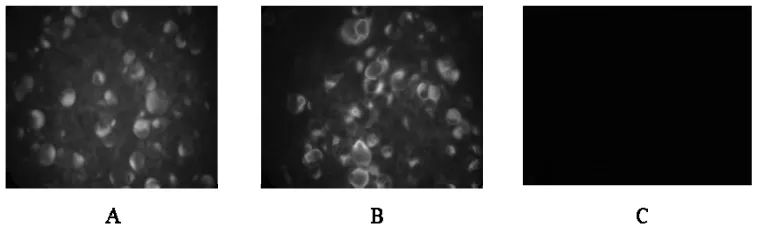
图3 免疫荧光检测
2.2 IBRV分离鉴定
2.2.1 病毒分离。将无菌处理后的鼻拭子液接种于MDBK细胞,第1代即出现细胞病变(CPE),表现为细胞圆缩、拉网、聚集成葡萄串样。随着培养时间的延长,细胞脱落、死亡。而对照孔无细胞病变(图4)。

图4 接种病料后的MDBK细胞(10×)
2.2.2 PCR试验。经PCR反应,可扩增出一条大小为311 bp的特异性条带,该条带与预期片段大小相符合,如图5所示。
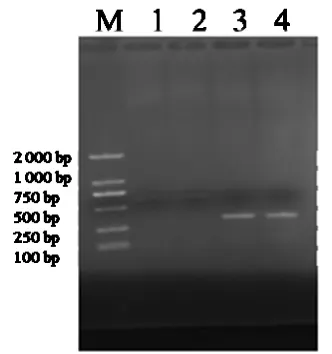
图5 IBRV PCR扩增结果
2.2.3 病毒形态。电镜下观察可见散在典型病毒颗粒及裸露的病毒粒子,见图6。表面壳微体排列有序并呈放射状,囊膜厚薄不匀称,形态大小不一,且呈波浪状,具有疱疹病毒独有的形态特征即囊膜与衣壳间有一层不定形的物质。

图6 分离毒株电镜负染形态学观察
2.3 BPIV3分离鉴定
2.3.1 病毒分离。将无菌处理后的鼻拭子液接种于MDBK细胞,第1代即出现细胞病变(CPE),表现为细胞圆缩、补丁状病变。随着培养时间的延长,细胞崩解,培养液中有大量细胞碎片,为牛副流感病毒3型特征性CPE。而对照孔无细胞病变,见图7。

图7 接种病料后的MDBK细胞(10×)
2.3.2 PCR试验。经PCR反应,可扩增出一条大小为425 bp的特异性条带,该条带与预期片段大小相符合。阴性对照未扩增出目的片段,如图8所示。
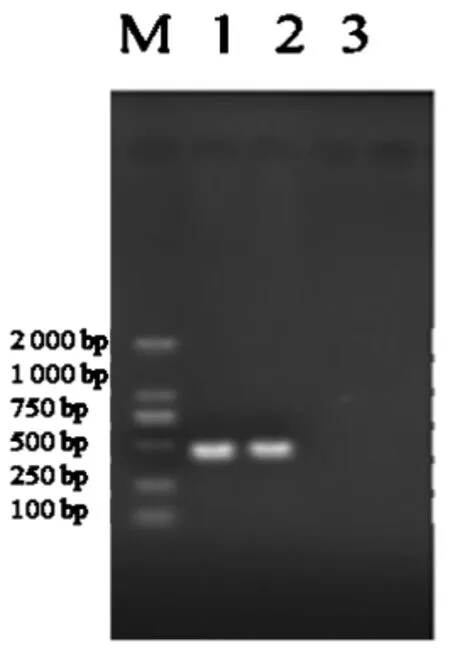
图8 BPIV3 PCR扩增结果
2.3.3 病毒形态。对分离毒株进行电镜观察,结果观察到有包膜的病毒离子,大小约为200 nm,与副黏病毒相符,结果见图9。
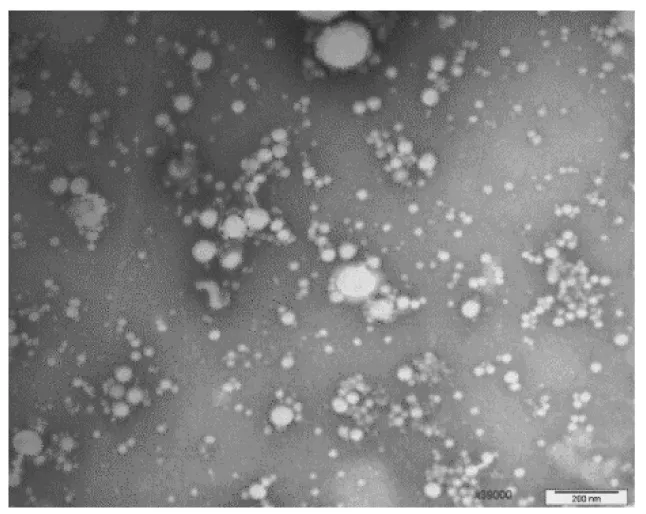
图9 分离毒株电镜负染形态学观察
2.4 牛支原体分离鉴定
2.4.1 形态特性。体视显微镜下观察可见典型的“煎蛋状”菌落,菌落中间厚且聚集、周边为表面光滑的薄透明颗粒区,边缘整齐,呈圆形,嵌入培养基中生长,可见β-溶血环(图10A);采用吉姆萨染色法对菌株进行染色,100倍油镜下观察菌体形态,可见紫色球形颗粒,而且呈多种形态;采用Dienes染色法对菌株进行染色,显微镜下观察菌体形态,牛支原体呈蓝色,见图10。
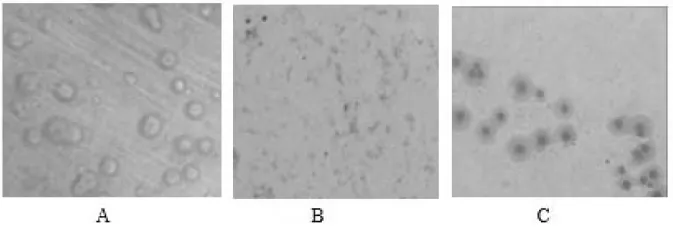
图10 分离株形态特征
2.4.2 牛支原体PCR的鉴定。由图11可见,在447 bp处出现了目的条带,该条带与预期片段大小相符合。阴性对照未扩增出目的片段。
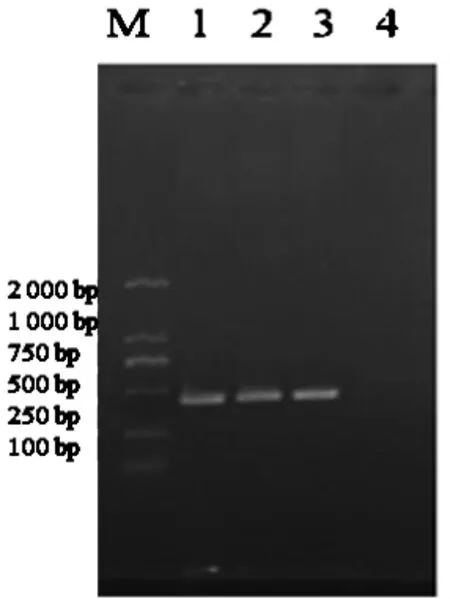
图11 牛支原体PCR结果
2.4.3 生化特征。鉴定结果见表5。由表5可见,分离菌株与牛支原体模式株PG45生化指标一致,分离株生化特性符合牛支原体的特性。

表5 分离牛支原体菌株的生化特征
3 结论
从内蒙古自治区、山西省某肉牛场分离得到BVDV、IBRV、BPIV3和牛支原体病原,经对其进行全面系统的鉴定,均符合质量要求。为了方便后续研究,笔者将其命名为 BVDV(HH03株)、IBRV(TY01株)、BPIV3(LH01 株)和牛支原体(CHF01 株)。
4 讨论
BRDC俗称运输热,是由于病原与自然界、动物相互作用导致的一种牛呼吸道疾病。BRDC严重威胁着牛群的健康,每年造成的经济损失不可估量。近年来,随着我国养牛规模的扩大和牛在不同省区来回调运,母牛、种公牛以及胚胎、精液等遗传物质的大量引进,使得一些疫病随着动物贸易而传入我国,造成疫病流行,BRDC就是其中之一[12]。运输应激造成的BRDC不断递增,死亡率呈上升趋势,给养牛业带来严重的危害。BRDC主要由包括支原体、牛疱疹病毒Ⅰ型等一种或数种病原单独或混合感染引起[13]。临床出现牛肺炎及支气管炎等症状,与应激、环境改变、牧场管理和疫苗免疫有关[14-15]。
近年来,随着内蒙古自治区、山西省养殖业结构调整和养牛业不断发展,奶牛和黄牛的养殖数量呈扩大趋势,牛传染性疾病也在不断增加,对内蒙古自治区、山西省养牛业的健康发展造成巨大威胁。本次调查发现,该二省区牧场均发生过由多种病因混合感染引起的疾病,近年也有一些相关报道。例如,2013年童钦等[16]报道,内蒙古自治区3个地区 BVDV 血清阳性率为58.35%。2011年,邹世颖等[17]调查IBRV的血清阳性率,河北省为28%、河南省为86%、内蒙古自治区为58%。2022年,姜晓霞等[12]报道,BVDV、BRSV、IBRV和BPIV感染引起的牛呼吸道疾病的临床症状相似,且有多种病毒共同感染现象。随着细菌对自然环境的适应能力逐渐增强,耐药性已经变得很普遍,不仅会降低药效,而且会导致耐药因子转移到人的病原菌中,给人类相关疾病带来“无药可治”的严重局面。因此,给分离得到的病原进行药敏试验,对指导临床规范用药、降低耐药菌株产生和传播速度具有深远意义。该试验病例由不同种病原混合感染所引起,因此制定合理的牛场免疫程序,按期进行疫苗接种非常关键。建议在牛呼吸道疾病高发期适当使用可提高牛机体抵抗力的药物,以降低牛呼吸道疾病综合征的发生率[18]。同时,控制牛呼吸道疾病综合征需要良好的环境作为基础保障,不仅需要温度适宜,还要保持通风。
由于病毒和支原体是导致BRDC最重要的因素,因此用于防治病毒和支原体感染的疫苗对BRDC发挥了重要的作用。活疫苗或灭活疫苗都能够减少因BRDC造成的临床感染,降低经济损失,有效避免牛场呼吸道疾病的发生,对养牛业的健康发展具有重要意义。

