红细胞比容水平与冠心病发展的相关性研究
曹洪帅 李佳松 谢佳宏 舒丽霞 蔺嫦燕,2
0 引言
心血管疾病是当前对人类健康的重要威胁之一,临床研究表明冠心病危险因素包括年龄、性别、吸烟史、高血压病、血脂异常、糖尿病、肥胖、家族史等。尽早识别并干预冠心病的可逆危险因素,可以降低中老年患冠心病的几率,因此有必要研究更多的指标作为冠心病的危险因素。已有研究证实血液黏度增加可以促进血管内壁血小板聚集、凝血酶产生[1],是心血管病的危险因素[2]。血液黏度随红细胞比容(hematocrit,HCT)的增加呈现非线性增加[3]。因此,近年来HCT引起诸多关注,其与冠心病之间的相关性及作用机制成为了探讨冠心病的全新切入点[4-5]。然而HCT和冠心病发展的相关性存在争议。有研究认为HCT与冠心病的发病、严重程度及预后均存在相关性,但有研究[6]却指出HCT与冠心病之间并无相关性。考虑原因可能是因为HCT和冠心病的相关临床研究仅通过临床回顾性分析进行讨论,选取样本可能存在偏倚,统计方法中未进行倾向评分匹配(propensity score matching,PSM)且缺乏影响机制的分析。目前,临床研究表明异常的力学因素可以通过影响冠状动脉内皮细胞和平滑肌细胞的生物学功能参与动脉粥样硬化的病理进程。壁面剪切应力(wall shear stress,WSS)与冠心病之间具有相关性,多项研究表明低WSS促进粥样硬化斑块的形成,导致冠心病的进一步发展;同时高WSS导致斑块破裂,是冠心病患者急性心梗发生的重要因素之一。因此探究WSS的改变可能会为探讨HCT和冠心病之间的相关性提供新的思路。
临床上HCT较易获得,但是很难直接测量体内病变动脉的血流动力学指标,而具有血流动力学分析功能的计算流体动力学(computational fluid dynamics,CFD)模拟方法可以评估狭窄冠脉内的三维脉动血流。Khader等[7]使用CFD方法研究了简单的狭窄血管模型中的血流,并证明随着狭窄严重程度的增加,血流速度和WSS随之增长。Sui等[8]利用CFD方法研究颈动脉斑块附近区域的WSS、速度和压力分布,分析不同狭窄程度下血流动力学参数的相对变化。尽管已经通过CFD 技术研究了许多动脉狭窄病例,但利用CFD方法结合临床资料分析HCT和冠心病相关性的研究很少。因此,本文拟通过体检人员的检验结果统计分析HCT和冠心病的相关性,并选取1例冠心病患者血管模型为例,采用CFD方法分析不同HCT水平(10%~60%)对狭窄冠状动脉WSS影响的差异,探究冠心病发展的血流动力学机制,为临床理解HCT与冠心病相关性提供理论依据。
1 研究方法
1.1 HCT与冠心病相关性的临床资料分析
选择首都医科大学附属北京安贞医院自2019年10月至2021年10月期间体检中心接受冠状动脉造影或者冠状动脉CTA的2 126例体检人员。排除标准:(1)合并脑血管疾病;(2)合并恶性肿瘤等疾病;(3)合并严重的肝、肾功能不全;(4)存在精神类疾病或痴呆;(5)患有瓣膜性心脏病、心力衰竭、心肌病的患者;(6)患有血液病(包括贫血)、慢性感染或炎症性疾病、自身免疫性疾病的患者;(7)患有其他神经或肌肉骨骼疾病的患者。该研究得到了首都医科大学附属北京安贞医院伦理委员会的批准,获得所有患者的知情同意。由两名主治医师共同阅读患者冠状动脉造影或者冠状动脉CTA影像结果,将冠状动脉狭窄小于50%定义为非冠心病组,大于50%定义为冠心病组,并根据Gensini评分评估冠状动脉负担。根据HCT分组进行PSM后分析HCT与冠心病的相关性。
1.2 机制探讨
1.2.1 冠状动脉模型
临床上如果冠状动脉狭窄大于50%,诊断为冠心病。狭窄大于80%,则建议行冠状动脉介入治疗。本文选取1例诊断为冠心病的男性患者,经临床冠状动脉造影检查根据Medina分型,该病例为(0.1.1)型病变,主支狭窄率为70%,分支狭窄率为87%,本病例两支血管包含了是否介入治疗的两种情况。将患者冠状动脉CTA影像原始DICOM数据导入Mimics中,根据流体域与周围组织灰度值差异自动分割重建,并导入至Wrap2017中进行平滑处理,完成三维重建。获得的模型使用Fluent内meshing模块划分网格,并进行网格无关性验证。网格类型为四面体网格,单元总数363 485,如图1。
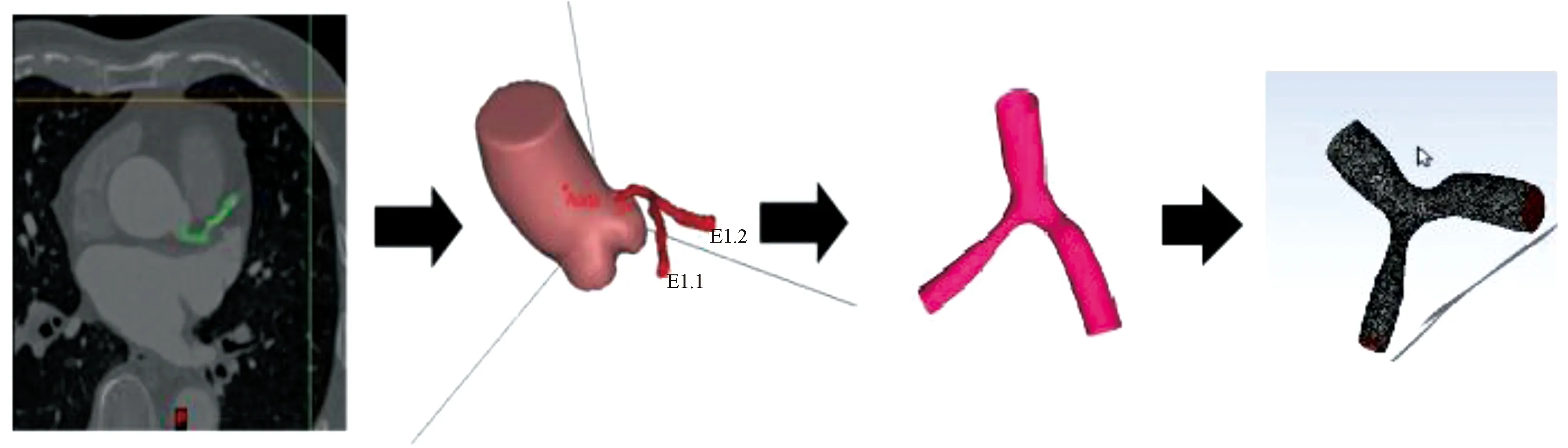
图1 狭窄冠状动脉建模过程及网格划分Figure 1 Stenosis coronary artery modeling process and grid division
1.2.2 HCT分组
流体模型中考虑血液的流变学特性,即血液的生物学特性和屈服应力的作用,采用 Casson 模型参数[9],见表1。

表1 各种血细胞比容的Casson模型参数Table 1 Casson model parameters for various hematocrits
1.2.3 边界条件与计算
脉动流用于冠状动脉的输入和输出。假设血管入口剖面的速度为均匀分布,入口速度随时间的变化曲线如图2(A),出口压强随时间变化的压强曲线如图2(B)。进出口边界条件通过UDS用户自定义函数进行编程载入。血管壁为无滑移、不可渗透的刚性壁。数值计算模型采用瞬态二阶后向欧拉算法,步长为0.005 s,收敛目标为最大残差值10-5,双精度计算。
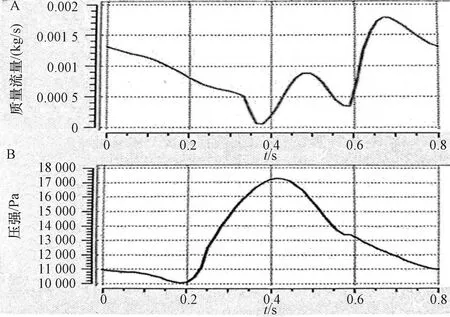
图2 进出口边界条件波形Figure 2 Waveform of inlet and outlet boundary conditions
1.2.4 HCT对冠心病发展的血流动力学机制分析
在本研究中,为了消除初始时刻边界条件的影响,仿真计算执行3个心动周期,一个计算周期为心动周期0.8 s,数据分析采用第3个周期的计算结果。低WSS促进粥样硬化斑块的形成,导致冠心病的进一步发展;同时高WSS导致斑块破裂,可能造成冠心病患者急性心肌梗死的发生。病变部位的WSS变化可能会导致血管动脉粥样硬化的进一步发展,从而使血管狭窄加重。以HCT为自变量,计算获得整个冠状动脉WSS的变量,探究HCT对冠心病发展的血流动力学机制。
2 结果与分析
2.1 临床资料统计分析结果
PSM前后两组的基线临床参数和实验室统计分析结果见图3。Logistic回归结果显示HCT与冠心病存在线性关系。ROC分析结果显示HCT的临界值为≥49.35,敏感性为83.8%,特异性为95.2%(AUC 0.875 7,P<0.001),见图4。图5临床数据结果结果证实了HCT和冠心病发生发展存在的相关性。值得注意的是经过PSM匹配后的冠心病组高密度脂蛋白比非冠心病组高,而低密度脂蛋白比非冠心病组低,这可能是冠心病组的患者长期口服他汀类降血脂药物所致。
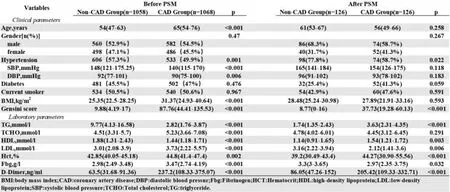
图3 研究组的基线特征和实验室参数Figure 3 Baseline characteristics and laboratory parameters of the study groups

图4 HCT预测冠心病的ROC曲线Figure 4 ROC curve of HCT in predicting coronary heart disease
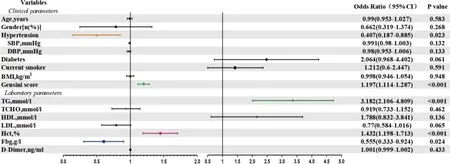
图5 危险因素在冠心病中的影响Figure 5 Impact of risk factors in coronary heart disease
2.2 HCT水平对WSS的影响
对不同水平HCT进行计算对比,结果显示等容舒张期末(如图6—图7),HCT=10%时具有最低的剪切应力,HCT大小与WSS呈正相关;HCT一定时,狭窄处WSS大,且与狭窄程度呈正相关。当HCT>50%时狭窄部位WSS为42 Pa,进一步分析狭窄部位的WSS过大可能损伤血管导致斑块破裂。
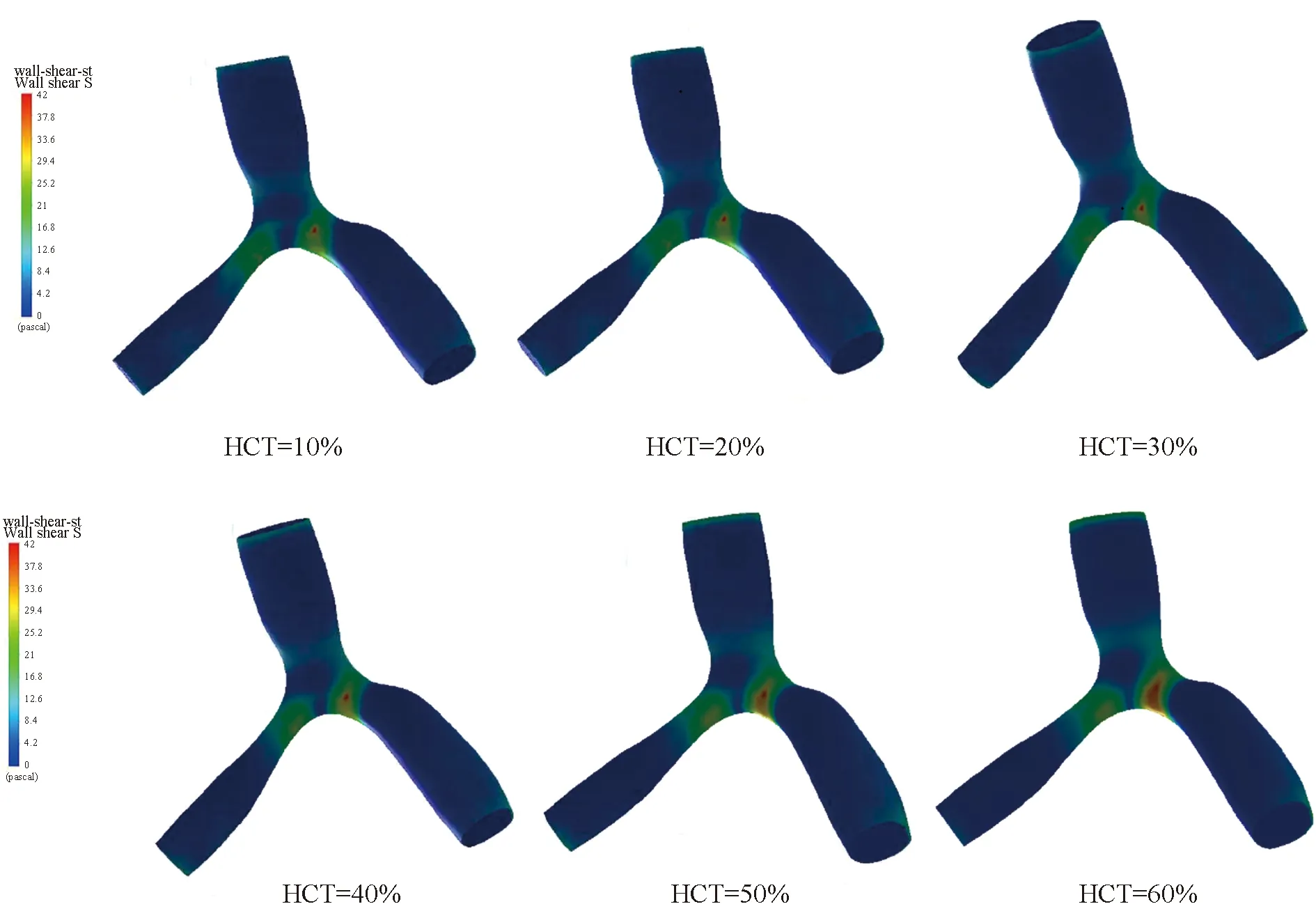
图6 不同HCT水平(10%~60%)的WSS分布图Figure 6 WSS distribution at different HCT levels (10%-60%)
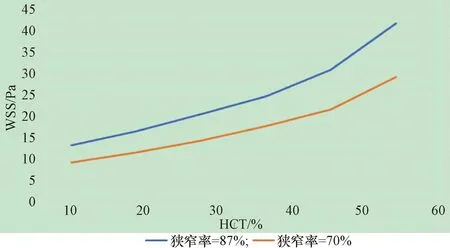
图7 不同HCT水平狭窄部位的最大WSS值Figure 7 Maximum WSS value of stenosis site at different HCT levels
3 讨论
本研究旨在评估不同HCT水平的血流动力学差异,探究HCT与冠心病的相关性及其作用机制。临床资料统计分析发现冠心病患者的HCT显著升高,且logistic回归分析表明HCT与冠心病相关。HCT增加与血液表观黏度增加之间存在直接关系,是影响血流动力学的重要因素[10]。动脉狭窄形成后血流模式和WSS会发生很大变化[11],HCT可能通过影响WSS分布参与冠心病的发展过程。为进一步探究WSS分布的影响,本文进行了不同HCT水平的数值模拟分析。
目前大多数数值模拟研究都将血液看做是牛顿流体进行模拟研究,具有生理变量的边界条件可能会导致狭窄后血流发生更多变化结果[12-13],本研究根据血液的生物学特性和屈服应力的作用参考前人的Casson 模型参数进行研究,目的是使模拟结果更贴近临床实际。Owen等[14]的动物实验研究报道:当WSS>37.9 Pa时,可能会损伤和剥蚀内皮细胞损伤血管;WSS<0.6 Pa时,延长的颗粒保留时间和增加的内膜脂质积累导致动脉粥样硬化。本研究发现HCT>50%时狭窄部位WSS为42 Pa,可能损伤血管导致斑块破裂,最终导致急性心梗的发生。本研究的结论与Sico等[15]的临床观察结果具有一致性,提示临床对于狭窄病变严重的患者,不仅要关注患者的血脂、血压,还应对其HCT提高重视。另一方面,研究报道输注生理盐水导致的HCT急剧下降也可以损伤患者的血管功能,影响氧气输送导致缺氧。慢性缺氧通过炎症反应和氧化应激影响内皮功能障碍,最终导致心血管事件的发生。然而冠心病患者HCT的最佳范围有待商榷。本研究发现HCT<40%的组别分叉近端和狭窄远端WSS均小于0.6 Pa,促进了动脉粥样硬化斑块的形成,因此认为HCT 40%~50%,可能是维持血管功能和血管结构的最佳目标水平,与Kishimoto等[16]临床观察认为HCT 42%~49%为最佳水平的结果基本一致。
那么HCT水平与动脉粥样硬化之间关联的可能机制是什么呢?目前有研究提出HCT与高血压风险密切相关[17-19],另有研究表明HCT与增加的胰岛素抵抗显著相关,其进一步导致患者肥胖[20-21],增加了患病风险。然而这些研究都是从HCT影响了冠心病高危因素解释的,结合研究,本课题组认为血液黏度是解释这一现象的核心,HCT主要影响了血液流变学特性从而参与了冠心病发生发展进程。
综上所述,HCT在一定程度上可反映冠心病患者冠状动脉病变的严重性,可作为冠心病风险的预测因子,而且临床上HCT来源于血常规检查,获取方式简单且成本低。本研究分析冠状动脉模型中不同HCT水平的血流动力学差异,不仅可以提高临床医生鉴别冠心病高危患者的能力,而且可以更详细地了解HCT重要性,以便在日常实践中帮助临床医生诊断和评估心血管疾病的预后。
本研究存在以下不足:(1)数值模拟仅考虑了流体力学的影响,未考虑血管壁的变形带来的差异,下一步的研究应采用流固耦合方法模拟血流和动脉壁变形的共同影响,进一步探讨HCT与冠心病的相关性。(2)数值模拟未考虑分叉角度的影响,同时临床统计分析入组人员受到地域局限的影响,本研究结果具有一定的局限性。
4 结论
本研究计算模拟的HCT水平对WSS的影响结果表明,HCT通过影响狭窄冠状动脉的血流动力学机制参与冠心病的进展,对于重度冠状动脉狭窄的患者,HCT高可能会导致狭窄部位内皮剥脱,损伤血管。因此,临床医生应提高对HCT的理解与重视程度,优化不同冠心病患者的个性化治疗方案,改善患者愈后。

