长期发酵大头菜差异代谢物及其关联代谢通路分析
张钰麟,陈泓帆,赵志平,,*,王 卫,聂 鑫,程 杰,张 崟,刘达玉,徐跃成,罗淮良
(1.成都大学 肉类加工四川省重点实验室,四川 成都 610106;2.成都大学食品与生物工程学院,四川 成都 610106;3.成都医学院基础医学院,四川 成都 610500;4.四川省食品检验研究院,四川 成都 610100;5.自贡市泰福农副产品加工厂,四川 自贡 643101)
大头菜又名芥菜,是一种十字花科芸苔属草本植物,常用来制成酱腌菜,因其脆嫩爽口而深受消费者喜爱。大头菜含有丰富的蛋白质、糖类、维生素以及膳食纤维[1-2]。食用大头菜可降低某些癌症、心血管和退行性疾病、免疫功能障碍以及老年黄斑变性的发生率[3]。新鲜大头菜因含有辛辣味的异硫氰酸酯而不能直接食用,发酵后香而微辣。不同工艺条件及不同地区生产的大头菜风味具有明显差异,曾凡坤等[4]利用蒸馏萃取-气相色谱-质谱联用分析了新工艺大头菜、传统腌制大头菜和脱盐大头菜,分别检测出68、56种和28种挥发性香气物质。郭壮等[5]利用电子舌分析了四川成都、湖北襄阳和山东菏泽大头菜的滋味品质,发现山东菏泽大头菜的酸味显著高于其他两种大头菜,而咸味、苦味、鲜味和后味-B显著低于其他两种大头菜。大头菜代谢物与其后续产品开发密切,而目前关于代谢物的研究主要以短期发酵3~4个月大头菜为对象,且聚焦于差异代谢物,涉及代谢通路的研究偏少。
通常,大头菜经过3~4个月短期发酵即可成熟[6-7],作为佐餐菜食用。自贡市某大头菜加工企业采用传统工艺工业化生产了3种不同发酵年限的大头菜;超长周期发酵大头菜主要用于制作菜肴,革新了其作为佐餐菜的传统食用方式。长期发酵大头菜的代谢物组成与其后续产品开发密切相关,目前缺乏关于长期发酵大头菜代谢物及关联代谢通路的研究报道。代谢组学常用的技术手段包括气相色谱-质谱联用、超高效液相色谱-质谱联用、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)、核磁共振,通过多元统计分析如主成分分析(principal component analysis,PCA)、正交偏最小二乘-判别分析(orthogonal partial least squaresdiscriminant analysis,OPLS-DA)可进一步筛选出差异代谢物,最后将差异代谢物注释到京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库中获得受到扰动的相关代谢通路[8]。
为了研究不同超长周期发酵大头菜代谢物差异和主要差异代谢物及其关联代谢通路,本研究从自贡市某大头菜加工企业采集了工业化生产的3种不同发酵年限的大头菜,利用LC-MS/MS技术分析其差异代谢物,以期为定向调控大头菜特征代谢物的生物合成提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
传统发酵0、5、10 a大头菜由自贡市泰福农副产品加工厂提供。
甲醇(≥99.90%)、乙腈(≥99.90%) 赛默飞世尔科技(中国)有限公司;2-氯苯丙氨酸(98.50%)上海阿拉丁生化科技股份有限公司;甲酸(色谱纯)、甲酸铵(≥99.90%) 北京伊诺凯科技有限公司;Milli-Q超纯水 上海摩速科学器材有限公司。
1.2 仪器与设备
H1850R台式高速冷冻离心机 湘仪离心机仪器有限公司;QL-866旋涡混合器 拓赫机电科技(上海)有限公司;Scientz-48高通量组织研磨器 宁波新芝生物科技股份有限公司;KW-100TDV高频超声波清洗器昆山舒美超声仪器有限公司;UltiMate 3000基础液相色谱系统、Q Exactive Plus LC-MS系统 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 大头菜加工工艺
大头菜采收后用清水洗净,去除泥沙和杂质,自然风干20~40 d。风干结束后,添加6%~10%(底层、中层和上层占比分别为10%、30%、60%)食盐腌制2~6 d后;翻缸添加2%~5%食盐(每层占比同上)腌制2~5 d后起缸;再次添加2%~15%的黄糖拌匀,入坛密封发酵5 a以及10 a。
1.3.2 代谢物的提取
将样本按照等比例冻干处理;移取1 000 μL甲醇复溶冻干粉末于离心管中,涡旋振荡1 min后12 000 r/min离心10 min,取上清液450 μL至离心管中,用真空浓缩仪浓缩至尽干;加入150 μL 80%甲醇溶液配制的2-氯苯丙氨酸溶液复溶样品,经过0.22 μm膜过滤。自每个待测样本各取20 μL混合成质量控制(quality control,QC)样本,用剩余待测样本进行后续检测。
1.3.3 色谱条件
ACQUITY UPLC®HSS T3(2.1 mm×150 mm,1.8 µm)色谱柱,自动进样器温度设为8 ℃,流速0.25 mL/min,柱温40 ℃,进样2 μL进行梯度洗脱。流动相:A相为5 mmol/L甲酸铵溶液,B相为乙腈,C相为0.1%甲酸溶液,D相为0.1%甲酸-乙腈;正离子模式C-D,负离子模式A-B。洗脱程序:0~1 min,98% A/C,2% B/D;1~9 min,98%~50% A/C,2%~50% B/D;9~12 min,50%~2% A/C,50%~98% B/D;12~13.5 min,2% A/C,98% B/D;13.5~14 min,2%~98% A/C,98%~2% B/D;14~17 min,负离子模式98% A相,2% B相,14~20 min,正离子模式98% C相,2% D相。
1.3.4 质谱条件
采用电喷雾离子源,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气压力30 arb,辅助气压力10 arb。毛细管温度325 ℃,在m/z81~1 000范围内以70 000的分辨率进行全扫描,并采用高能诱导裂解技术进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除不必要的MS/MS信息。
1.4 数据处理以及统计
通过Proteowizard软件(v3.0.8789)将获得的原始数据转换成mzXML格式。利用R(v3.3.2)的XCMS程序包进行峰识别、峰过滤、峰对齐,得到包括m/z、保留时间以及峰面积等信息的矩阵,将矩阵进行缺失值填补、归一化等处理后导入至SIMCA(14.1)进行PCA以及OPLS-DA。根据代谢物的分子质量(分子质量误差<3×10-5)对差异代谢物定性,然后根据MS/MS模式下获得的碎片信息在HMDB、Metlin、Massbank、LipMaps、mzclound以及帕诺米克自建标准品数据库中进一步匹配注释获得代谢物准确信息。将筛选到的差异代谢物映射到MetaboAnalyst 5.0数据库中(https://www.metaboanalyst.ca/),进行相关代谢通路分析,并用超几何检验的P值确定其显著性。利用R的pheatmap包进行层次聚类分析。
2 结果与分析
2.1 大头菜代谢物的PCA
基于LC-MS/MS结合多元变量统计方法,以探究3种大头菜代谢物的差异。为得到高质量代谢组学数据,通常需要进行QC。QC样本的聚集程度良好,且分布在原点附近,说明本次实验数据可靠,如图1所示。0 a组、5 a组与10 a组均分布在不同的区域内,说明3种不同发酵周期大头菜代谢物之间存在显著差异,因此基于PCA得分图确定3个处理组[9]:0 a与5 a为A1,5 a与10 a为A2,0 a与10 a为A3。和Q2是评判PCA模型的主要参数,其中、Q2=0.64表明所建立的PCA模型具有较好的可解释度。
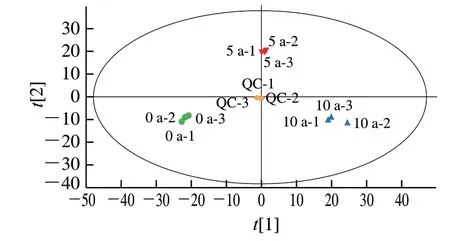
图1 发酵大头菜样本的PCA模型得分散点图Fig. 1 PCA score scatter plot of fermented kohlrabi samples
2.2 大头菜代谢物的OPLS-DA
对3个处理组,采用OPLS-DA进一步分析均得到了较好的分离,如图2A1~C1所示。每个处理组中两两组别均显著分离,说明发酵周期的不同导致大头菜代谢物种类及含量产生显著差异,这可能与长期发酵大头菜中耐盐微生物活力一直处于较高水平有关,如乳酸菌可产生多种氨基酸,通过厌氧发酵产生丙酸、乳酸;酵母菌可产生有机醇,基于利用还原糖能力强的特点,使其更能适应发酵过程的高盐、高酸环境[10],加之代谢物之间的相互作用使得组别间差异较明显。OPLS-DA模型参数为均大于0.5,且=0.988说明该模型可以解释和预测两种大头菜代谢物之间的差异。
为了进一步验证模型是否出现过拟合现象,采用200次循环迭代置换检验,结果如图2A2~C2所示。Q2回归线与Y轴交点都在负半轴,表明OPLS-DA模型稳定可靠,不存在过拟合现象。
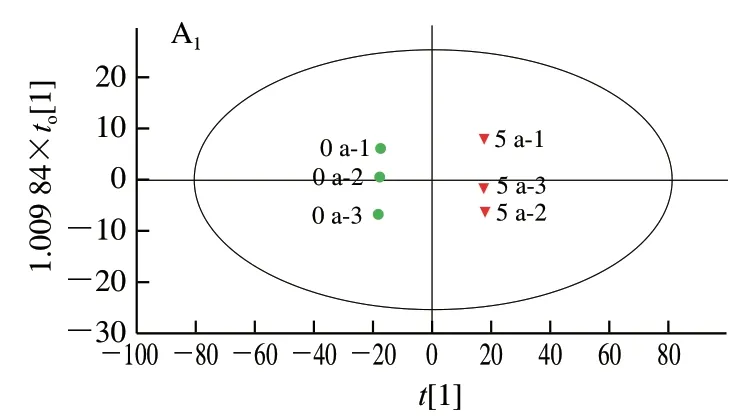
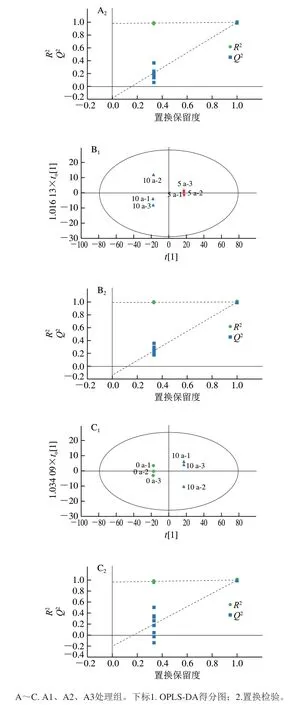
图2 发酵大头菜OPLS-DA模型得分散点图与置换检验结果Fig. 2 Scatter plots and permutation test of OPLS-DA model for fermented kohlrabi samples
2.3 大头菜差异代谢物的筛选与鉴定
差异代谢物的筛选往往依托于OPLS-DA模型变量投影重要性(variable importance in projection,VIP)值大于1且学生式t检验的P值小于0.05[11],本研究以VIP>1.3且P<0.05为筛选标准。如图3A所示,3个处理组差异代谢物主要以有机酸及其衍生物、氨基酸及其衍生物和核酸及其衍生物为主,发酵时间的延长使得微生物通过酶促反应利用大头菜中底物能力增强。研究显示,随着发酵的进行,盐厌氧菌属、盐单胞菌属和色盐杆菌属逐渐成为相对丰度较高的优势菌群[12];在高盐的环境下,优势耐盐菌群充分利用能源物质,使得大分子营养物质被降解成小分子物质,如氨基酸、脂肪酸等[13],这体现在A3较A2及A1组差异代谢物种类及个数均更加丰富。利用Venn图对各处理组的差异代谢物分析表明,A1、A2、A3共鉴定到53、113种和174种差异代谢物,如图3B所示。取3个处理组共有的19种差异代谢物定义为主要差异代谢物,包括3种氨基酸及其衍生物(L-苯丙氨酸、N-乙酰亮氨酸、4-乙酰氨基丁酸),5种有机酸(6-羟基烟酸、3-(2-羟基苯基)丙酸、2-氨基苯磺酸、L-3-苯乳酸、烟酸),3种核酸及其衍生物(N-D-核糖嘌呤、鸟嘌呤、7-甲基腺嘌呤),2种脂肪酸(辛酸、癸二酸),2种酮糖(β-D-果糖-6-磷酸、D-核酮糖),1种黄酮类物质(根皮苷),1种酚类物质(苯酚),1种酚酸(水杨酸),1种生物碱(β-咔啉)。
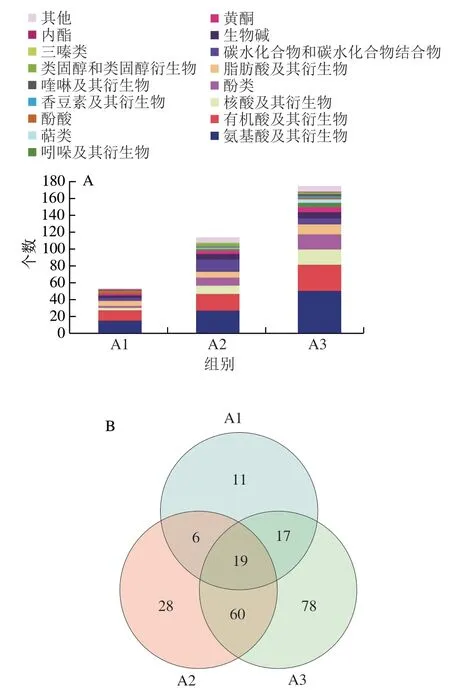
图3 大头菜差异代谢物分类信息(A)及Venn图(B)Fig. 3 Classification information (A) and Venn diagram (B) for differential metabolites of fermented kohlrabi
氨基酸及其衍生物在植物中发挥各种功能,除了参与合成蛋白质外,还与能量代谢、植物的胁迫反应等有关。发酵周期的不同使得微生物代谢功能基因表达程度不同,尤其是氨基酸的相关代谢活动[14]。氨基酸的种类直接决定发酵蔬菜的滋味,Xiao Yangsheng等[15]通过对四川泡菜、江西盐菜和东北酸菜研究发现,发酵蔬菜都富含谷氨酸、苯丙氨酸、丙氨酸、天冬氨酸等氨基酸,均在本研究中被检出。徐亚洲等[16]研究证实,泡菜发酵过程中氨基酸含量变化趋势并非一致,这在本研究中体现在天冬氨酸为上调的差异代谢物,而丝氨酸与丙氨酸为下调的差异代谢物。多种氨基酸共同作用有助于大头菜滋味的形成,赋予大头菜鲜辣等味觉特征。
有机酸是植物光合及呼吸作用的中间产物,其含量直接反映植物的代谢活性[17]。本研究鉴定的大部分有机酸含量随着发酵周期延长而增加。研究显示,发酵蔬菜中有机酸主要来源于蔬菜原料及发酵过程中微生物的代谢作用。随着发酵周期的增加,乳酸及乙酸等有机酸由于糖代谢作用逐渐积累增加[18-19],郝懿[20]研究发现自然发酵香椿泡菜乳酸及乙酸含量变化也有着相同结果,且加盐量4%香椿泡菜乳酸杆菌随发酵周期延长逐步成为优势菌群;肖阳生[14]通过监测四川泡菜发酵过程中有机酸,发现有机酸含量逐渐升高,且与乳杆菌属呈正相关。烟酸也被称为VB3,存在于各种植物组织中,其是一种水溶性的维生素,具有舒张血管的作用。L-3-苯乳酸被认为是一种可逆的混合型多酚氧化酶抑制剂[21],其在大头菜发酵过程中起抗褐变作用,为后续有关产品护色以及延长货架期提供一定理论支持。
次生代谢物以产量较大的初生代谢物为前体,通过糖代谢、莽草酸延伸、氨基酸延伸、乙酸延伸途径所合成的结构复杂的化合物。次生代谢物种类很多,包括生物碱、色素、抗生素等。由于色素含量的不同,0、5 a和10 a大头菜的色泽表现出显著差异,如图4所示。酚酸及其衍生物广泛分布在植物中[22],发酵过程中酚酸的积累有助于大头菜口感、酸度、风味的形成[23],如在芥菜和客家擦菜中可检测出40余种酚酸[24],与本研究检出的大多数酚酸变化趋势一致,但主要差异代谢物水杨酸与传统发酵的芥菜变化趋势不一致。传统芥菜水杨酸含量随发酵周期延长含量逐渐下降,而本研究水杨酸含量呈上升趋势。与水杨酸代谢有关的酶为苯丙氨酸解氨酶,其通过介导肉桂酸途径从而合成水杨酸。邹同雷等[25]发现龙须菜中苯丙氨酸解氨酶在高盐浓度下活性增加,而5 a和10 a大头菜的食盐含量高于0 a,因此5 a和10 a大头菜水杨酸含量显著高于0 a。生物碱主要为植物中的一类含氮的碱性有机化合物,其种类很多,主要包括有机胺类、异喹啉类、吡啶类等,通常具有抗肿瘤[26]、镇痛[27]的作用。本研究鉴定到的主要差异生物碱为β-咔啉,其含量呈先上升后下降的趋势,β-咔啉生物碱在新药开发上具有广阔的前景,基于其在长期发酵大头菜中的含量变化规律,后续可针对5 a大头菜进行相关功能性代谢物的生物合成调控。
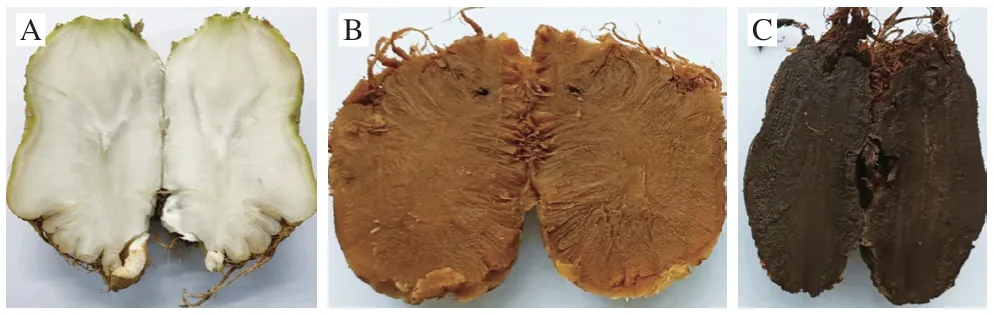
图4 发酵0(A)、5 a(B)及10 a(C)大头菜剖面图Fig. 4 Cross-sectional views of kohlrabi samples fermented for 0 (A),5 (B) and 10 years (C)
2.4 大头菜主要差异代谢物热图分析
为了更好地判断主要差异代谢物在发酵大头菜中的代谢模式,以大头菜主要差异代谢物的相对含量做层次聚类分析,结果以热图的形式展示,如图5所示,主要差异代谢物在各个组别中含量分布具有一定的规律特征。0 a中3种下调的主要差异代谢物与其他两组差别明显,其中以3-(2-羟基苯基)丙酸和β-D-果糖-6-磷酸变化最为显著。5 a组中含量较高的有β-咔啉、癸二酸、辛酸、苯酚,它们多为脂肪酸、生物碱和酚类物质,可能对大头菜发酵前期褐色的形成起重要作用。10 a中含量较高的有根皮苷、L-苯丙氨酸、2-氨基苯磺酸、L-3-苯乳酸、烟酸、6-羟基烟酸、N-D-核糖嘌呤。

图5 发酵大头菜中主要差异代谢物层级聚类分析热图Fig. 5 Heatmap for hierarchical clustering analysis of major differential metabolites in fermented kohlrabi samples
2.5 主要差异代谢物通路分析
植物的生长过程是一个复杂的代谢过程,不能仅仅从单一物质表达量的高低进行整体判断[28],因此需要对主要差异代谢物所富集的代谢通路进行分析。将主要差异代谢物映射到KEGG数据库中,主要富集到苯丙氨酸代谢(Impact=0.47)、磷酸戊糖途径(Impact=0.13)、果糖和甘露糖代谢(Impact=0.21)3 条代谢通路上,如图6所示。芳香族氨基酸除了作为蛋白质的组成成分外,还是许多次生代谢物生物合成的前体[29],通过莽草酸途径在质体内部合成。由于缺乏完整的糖酵解过程,使其只能通过磷酸烯醇式丙酮酸特异性的磷酸转运体从胞浆导入。L-苯丙氨酸是许多酚类化合物的前体物质,包括木质素、缩合单宁以及苯丙烷类物质。在一些植物中,苯丙氨酸生物合成的主要途径是芳香酸途径[30]。β-D-果糖-6-磷酸作为连接磷酸戊糖途径与果糖和甘露糖代谢的主要代谢产物,其含量随着发酵周期的延长而下降,可能是由于6-磷酸葡萄糖异构酶活性减弱,使来源于糖酵解过程的α-D-葡萄糖-6-磷酸向其转化能力减弱;作为呼吸作用的底物,通过三羧酸循环、磷酸戊糖途径及果糖和甘露糖代谢途径转化为三磷酸腺苷以维持正常的生命活动[31]。
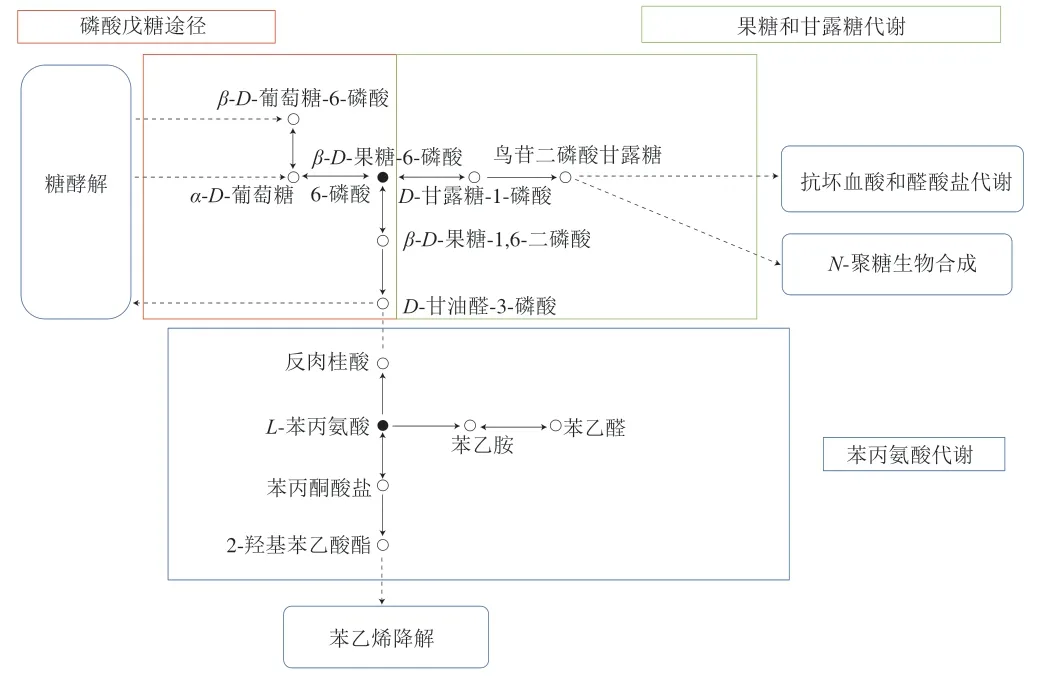
图6 主要代谢通路整合分析图Fig. 6 Integrated analysis of major metabolic pathways
3 结 论
基于LC-MS/MS探究了工业化生产的发酵0、5 a和10 a的传统大头菜代谢物的差异,差异代谢物主要以有机酸、氨基酸和核苷酸衍生物为主。基于Venn图得到3个处理组共有的19种主要差异代谢物,将主要差异代谢物通过KEGG数据库检索出3 条最显著的代谢通路,为基于代谢通路定向调控大头菜代谢物合成提供一定的理论基础。
大头菜在发酵过程中发生复杂的生物化学反应,代谢物种类繁多。深入解析长期发酵大头菜代谢物组成及变化规律是大头菜后续产品开发的前提,也是未来的主要研究方向之一。此外,微生物是影响发酵大头菜代谢物组成最为关键的因素之一,利用宏基因组学、宏转录组学、蛋白质组学及代谢组学等多组学技术深度揭示工业化生产长期发酵大头菜的微生物多样性及群落结构,明确功能微生物及活性基因,阐明微生物调控长期发酵大头菜代谢物合成的机理是未来的研究方向。同时,基于代谢通路利用定向调控技术加速特征代谢产物生物合成进程也是工业化生产亟需解决的技术问题。

