雪腐镰刀菌和酱油曲霉转化橙皮苷生成橙皮素单葡萄糖苷效果
张风亭,胡 坦,潘思轶
(华中农业大学食品科学与技术学院,湖北 武汉 430070)
橙皮苷是存在于柑橘类水果中的一种黄烷酮化合物,具有抗炎、抗氧化、促进成骨细胞分化等多种药理活性[1],除此之外,还可用作食品添加剂、果蔬保鲜剂等[2]。但由于橙皮苷的水溶性较差(2 mg/100 g)[3],生物利用度较低,因此,必须对其进行改性,增加水溶性,从而扩大橙皮苷在医药、食品以及化妆品等领域的应用。
目前国内外对橙皮苷改性方法研究较多的是生物转化法[4]。生物法避免了化学法存在的反应不易控制、反应条件剧烈以及环境污染严重等缺陷,凭借其反应效率高、特异性强、反应条件温和等优势在一定程度上取代了化学法[5]。生物转化包括酶法和微生物发酵法。近年来,微生物发酵法因其易于培养、菌种资源丰富、产生的酶系强大等特点,在生物转化领域备受关注。李小莉[6]在筛选高产且传代稳定的橙皮苷酶生产菌株时发现,雪腐镰刀菌(Fusarium nivale)是最佳的发酵菌株。刘晓晶[7]利用雪腐镰刀菌发酵产橙皮苷酶的特性研究并优化了橙皮苷改性的工艺条件。橙皮苷酶和柚皮苷酶都是含有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的复合酶,均可用于橙皮苷的转化,一般途径为橙皮苷在α-L-鼠李糖苷酶的作用下生成橙皮素单葡萄糖苷(hesperitin-7-O-glucoside,HMG),HMG在β-D-葡萄糖苷酶的作用下继续生成橙皮素[8-9]。郑美瑜等[10]研究发现,柚皮苷酶可以更快酶解橙皮苷。与此同时,国外研究报道指出[11-12],从韩国传统大豆发酵产物中分离得到的酱油曲霉(Aspergillus sojae)具有较强的柚皮苷酶活性,该酶作用于橙皮苷得到了溶解度较高的HMG。但迄今为止,鲜有关于该菌株发酵转化橙皮苷的研究报道。因此,本研究基于雪腐镰刀菌和酱油曲霉均可转化橙皮苷这一理论,以雪腐镰刀菌、酱油曲霉和混合菌(雪腐镰刀菌-酱油曲霉1∶1)这3种菌株作为出发菌株,比较其发酵转化橙皮苷的效果,旨在筛选出更为适合橙皮苷转化的菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌种
橙皮苷(纯度95%) 上海源叶生物科技有限公司;雪腐镰刀菌(14 mm试管斜面)、酱油曲霉(冻干粉) 北纳生物科技有限公司。
1.1.2 试剂
醋酸-醋酸钠缓冲液(pH 5.5)、橙皮苷、HMG及橙皮素标准品 上海源叶生物科技有限公司;甲醇(色谱纯)、88%甲酸(分析纯) 武汉飞扬生物科技有限公司;葡萄糖 国药集团化学试剂有限公司;酵母膏(微生物级)、三水合磷酸氢二钾(分子生物级)生工生物工程(上海)股份有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:葡萄糖20 g,马铃薯浸出粉5 g,琼脂14 g,蒸馏水1 000 mL,pH值自然,121 ℃灭菌15 min;液体种子培养基:葡萄糖40 g,酵母膏5 g,K2HPO4·3H2O 2 g,蒸馏水1 000 mL,pH值自然,121 ℃灭菌15 min。
1.2 仪器与设备
PHS-3C pH计 上海仪电科学仪器股份有限公司;LK50T显微镜 天津徕科光学仪器有限公司;LX-C35L高压灭菌锅 合肥华泰医疗设备有限公司;KQ-300DE超声波清洗器 昆山市超声仪器有限公司;AllegraX-30R高速冷冻离心机 贝克曼库尔特有限公司;THZ-98A恒温振荡器 上海一恒科学仪器有限公司;e2695高效液相色谱仪(配有可变波长紫外检测器及Empower数据处理系统)、MA 01757超高效液相色谱-质谱联用仪(配有电喷雾离子源及UNIFI科学信息系统)美国Waters公司。
1.3 方法
1.3.1 菌种活化
雪腐镰刀菌:试管斜面经表面消毒之后,在超净工作台中打开,用无菌接种锄和接种铲切0.5 cm×0.5 cm的小正方形块,然后将其平放至平板中心,28 ℃培养4 d,菌种长出即可使用。
酱油曲霉:将0.3~0.5 mL无菌水或液体培养基注入冻干管中,轻轻敲打,充分溶解成菌悬液。吸取菌悬液,均匀打入2个平板琼脂表面上(每个约200 μL),涂布均匀,然后放入培养箱中,28 ℃培养4 d,活化成功后即可进行下一步实验。
1.3.2 菌株的形态特征
取活化成功后的雪腐镰刀菌平板和酱油曲霉平板各一个,观察菌体在固体平板上的形状、颜色、黏稠度、透明度等特征,然后用无菌水制备菌悬液,在显微镜下观察菌体的形态[13]。
1.3.3 接种发酵
1.3.3.1 橙皮苷的预处理
将0.2%橙皮苷置于超净工作台中,紫外灯持续照射30 min。然后将其倒入灭菌冷却后的种子培养基中,充分摇匀,制备发酵培养基,用于后续实验。
1.3.3.2 单菌发酵
雪腐镰刀菌:选取长势较好的雪腐镰刀菌平板,加入无菌水制备菌悬液,然后取6%的菌悬液注入种子培养基中,于30 ℃、160 r/min培养24 h后,再按4%的比例接种于发酵培养基中,相同条件下继续培养一段时间。此后,每隔12 h取一次发酵液,发酵液经煮沸、离心之后进行检测。酱油曲霉操作同雪腐镰刀菌。
1.3.3.3 混菌发酵(雪腐镰刀菌-酱油曲霉1∶1)
参照单菌发酵方法,首先制备不同菌株的种子培养基,然后均按照4%的比例同时接种于同一发酵培养基中,并于30 ℃、160 r/min培养,每隔12 h取样一次,煮沸、离心后进行发酵液的检测。
1.3.4 发酵液pH值的测定
取不同菌株不同时间段的发酵液,采用室温、10 000 r/min离心5 min后测定其pH值。
1.3.5 酶活力的测定[14-15]
用pH 5.5的醋酸-醋酸钠缓冲液将橙皮苷配成0.1%的底物溶液,取底物溶液10 mL于30 ℃恒温水浴锅预热5 min,然后加入发酵液10 mL,充分摇匀,30 ℃保温10 min,立即用沸水灭活5 min,采用高效液相色谱法测得HMG生成量。将在30 ℃、pH 5.5条件下,每分钟生成1 μg HMG所需的酶量,定义为一个酶活力单位(U)。
1.3.6 发酵产物的鉴定
1.3.6.1 HMG的定性分析
称取HMG标准样品2 mg溶于10 mL甲醇中,采用反相高效液相色谱法测定其出峰时间。称取橙皮苷、HMG及橙皮素标准样品溶于10 mL甲醇中,测定混合标准品中三者各自的出峰时间。将取出的发酵液置于沸水浴5 min,离心、过滤,同样采用高效液相法进行检测。
高效液相色谱法的检测条件[16]:色谱柱:Amethyst C18-H(4.6 mm×250 mm,5 μm);流动相为甲醇-0.2%甲酸溶液,梯度洗脱;进样量20 μL;检测波长283 nm;柱温控制在30 ℃,一个梯度程序的跑样时间为30 min,具体的洗脱程序如表1所示。
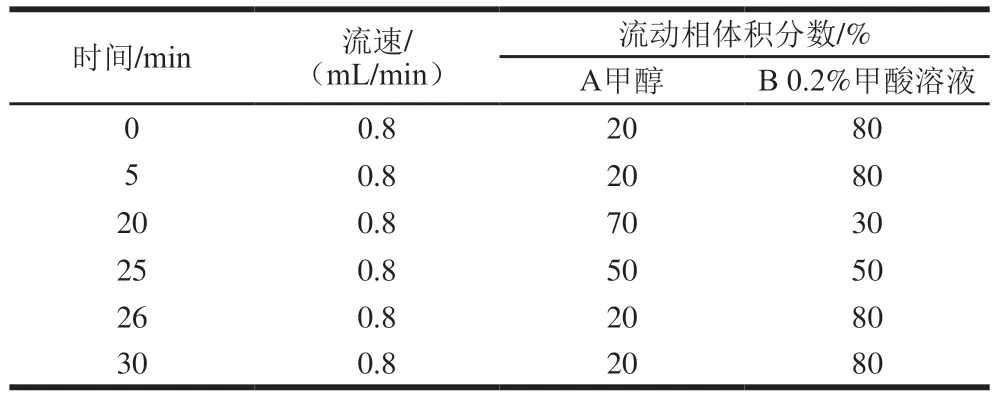
表1 高效液相色谱法梯度洗脱程序Table 1 Gradient elution program for high performance liquid chromatography
1.3.6.2 发酵液中HMG的结构验证
称取HMG标准样品2 mg溶于10 mL色谱级甲醇中,对其进行质谱检测。将取出的发酵液置于沸水浴5 min,离心、过滤,采用超高效液相色谱-质谱联用技术进行测定。
超高效液相色谱-质谱联用仪的洗脱条件如表2所示。质谱条件:电子电离源;毛细管电压4 kV;离子源温度135 ℃;脱溶剂温度350 ℃;脱溶剂气体流速600 L/h;扫描范围m/z50~1 000。
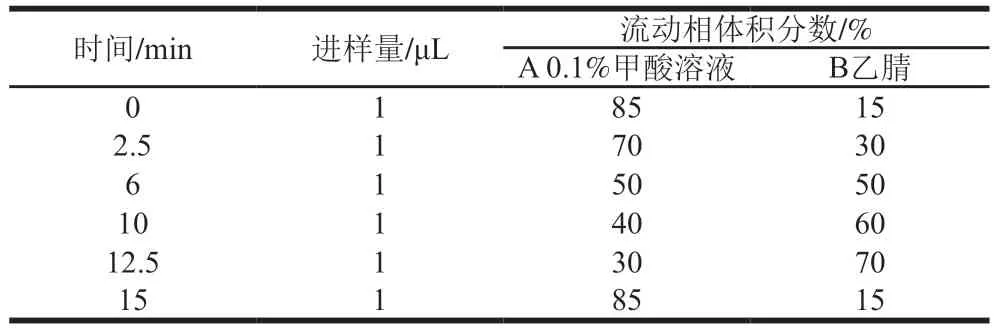
表2 超高效液相色谱-质谱法梯度洗脱程序Table 2 Gradient elution program for ultra-high performance liquid chromatography-mass spectrometry
1.3.6.3 发酵产物HMG的定量检测
橙皮苷、HMG及橙皮素标准原液的配制:准确称取橙皮苷2.5 mg、HMG 2 mg及橙皮素2 mg,分别用色谱级甲醇定容至10 mL,超声辅助溶解,即配成2.5 mg/mL的橙皮苷、2 mg/mL的HMG及2 mg/mL的橙皮素溶液,置于4 ℃的冰箱中贮藏备用。
橙皮苷、HMG及橙皮素标准曲线的制作[17]:用一定量的色谱级甲醇将橙皮苷、HMG及橙皮素标准原液进行稀释并混匀,分别配制5、10、20、60、80 μg/mL的橙皮苷标准溶液,1、5、10、25、100 μg/mL的HMG标准溶液,1、2、5、30、40 μg/mL的橙皮素标准溶液,将配好的所有样品溶液过0.22 μm滤膜后进行检测,且每种标准品的每个质量浓度均做3个平行,进样量为20 μL,用高效液相色谱法进行测定并记录峰面积,以各物质质量浓度为横坐标、峰面积为纵坐标分别绘制橙皮苷、HMG及橙皮素标准曲线,即橙皮苷的标准曲线为y=55 560x-69 549,R2=0.999 6;HMG的标准曲线为y=55 575x-40 577,R2=0.999 8;橙皮素的标准曲线为y=79 183x+248.88,R2=0.999 9。橙皮苷、HMG及橙皮素分别在5~80、1~100 μg/mL及1~40 μg/mL范围内有良好的线性关系,可以用于这3种物质的定量检测。
1.4 数据分析
应用Origin和Excel软件对数据进行分析,实验结果取3次平行测定的平均值。
2 结果与分析
2.1 菌株的形态特征
雪腐镰刀菌是一种减毒、弱毒或低致病性的小型丝状真菌,在综合PDA培养基上菌落明显,菌丝白色,密集低平,向平板边缘蔓延生长,培养基背面淡黄色(图1a);不产生小分生孢子,大分生孢子小,棒状,平直或略弯(图1b)。
酱油曲霉在综合PDA培养基中培养4 d之后,质地丝绒状,较薄,中央有气生菌丝,具辐射状沟纹,颜色为暗草绿色或黄绿色,培养基背面无色(图1c);分生孢子头幼时为球形,后成辐射形,分生孢子梗大多生自基质,壁近于光滑或有时在近顶囊处现粗糙,顶囊近球形(图1d)。
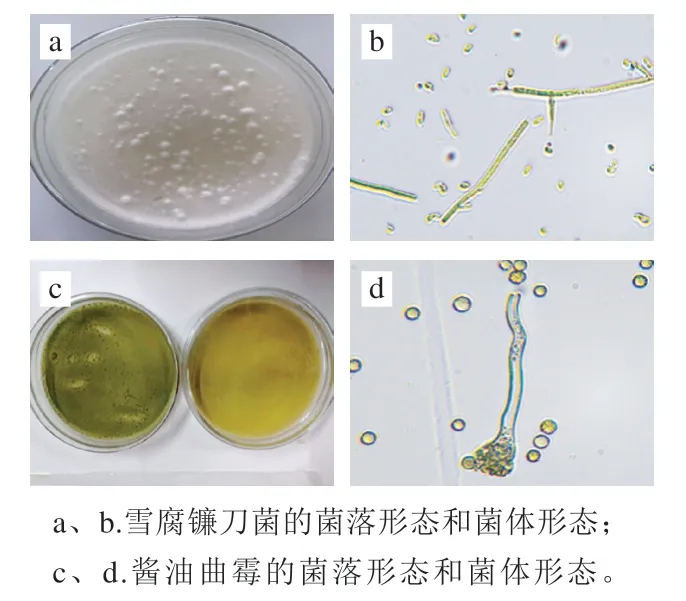
图1 菌株的形态特征(×400)Fig. 1 Morphological characteristics of F. nivale and A. sojae (× 400)
2.2 发酵液pH值的变化
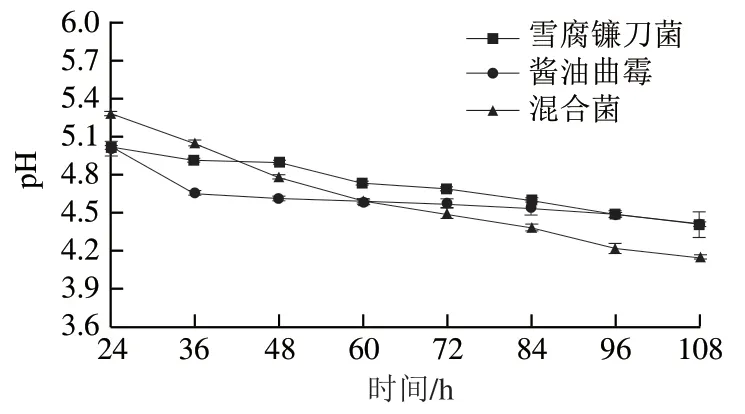
图2 发酵液pH值的变化Fig. 2 Changes in pH of the fermentation broth
由图2可知,无论是单一菌株还是混合菌株发酵,在整个发酵过程中发酵液均表现出pH值不断下降的趋势,而且混合菌株发酵pH值下降程度较单菌株更为明显。橙皮苷转化为HMG是通过微生物产生的酶实现,而pH值又对酶解反应过程尤为重要[18-19],只有当发酵液pH值始终处在该酶的最适pH值范围内,酶分子活性中心必需基团的解离程度才会处于较高水平,从而使得反应速率变快,达到目标产物转化率较高的最终目的。所以,通过探究发酵过程中发酵液pH值的变化以及各个阶段的酶活力变化,对于后期严格控制发酵环境、指导HMG的生成具有重要意义[20-21]。
2.3 酶活力测定结果
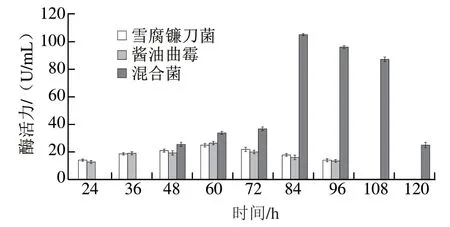
图3 各菌株产生α-L-鼠李糖苷酶的活力Fig. 3 Change in α-L-rhamnosidase activity during fermentation
由图3可见,三者的酶活力均呈现先上升后下降的趋势。通过单因素方差分析可知,雪腐镰刀菌与酱油曲霉差异并不显著,而雪腐镰刀菌与混合菌、酱油曲霉与混合菌分别呈显著差异(P<0.05)。雪腐镰刀菌和酱油曲霉发酵12 h无酶活力,随后酶活力逐步上升;而混合菌持续发酵36 h后仍检测不出酶活力,可能与菌株自身的适应期、繁殖以及彼此之间的竞争等密切相关[22-23]。雪腐镰刀菌和酱油曲霉发酵60 h达到了酶活力最高点,但混合菌发酵60 h后,酶活力仍在不断攀升,84 h获得最大酶活力(104.81 U/mL)。因此,就酶活力而言,混合菌的产酶能力完全高于雪腐镰刀菌和酱油曲霉[24-25],前者也极有可能在发酵84 h积累较多的HMG。
2.4 发酵产物的鉴定与分析
2.4.1 HMG出峰时间的确定
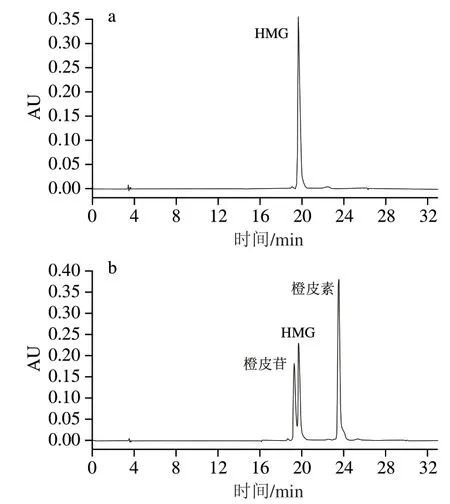
图4 HMG标准样品(a)和橙皮苷、HMG及橙皮素的混合标准样品(b)色谱图Fig. 4 Chromatograms of HMG standard (a) and mixed standard of hesperidin, HMG and hespcretin (b)
由图4a可知,HMG标准样品的出峰时间为19.668 min。橙皮苷经微生物发酵之后可能产生HMG及橙皮素物质,为了便于区分发酵液中可能同时存在的这3种物质,进行了橙皮苷、HMG及橙皮素混合标准品的检测,得到三者的出峰时间分别为19.229、19.655 min和23.485 min(图4b)。结合图4a、b看,HMG的出峰时间可能会发生微小偏移,而它与橙皮苷出峰时间又较为接近,因此,后续实验要特别注意发酵液中HMG的产生情况,必要时可以对其结构进行鉴定。
2.4.2 发酵液中HMG的生成情况
图5为雪腐镰刀菌、酱油曲霉、混合菌在发酵过程中同一时间点(84 h)取样进行高效液相色谱检测的结果。结果表明,3种发酵液中均含有HMG,虽然出峰时间略有不同,但始终维持在19.6 min左右,并且通过内标法进一步证实了HMG的存在。从峰高看,混合菌发酵液中HMG含量明显高于单菌,证实了上述对混合菌在发酵84 h可能积累较多HMG的推论。所以,就雪腐镰刀菌和酱油曲霉转化橙皮苷生成HMG效果而言,混合菌发酵84 h较为理想[26]。
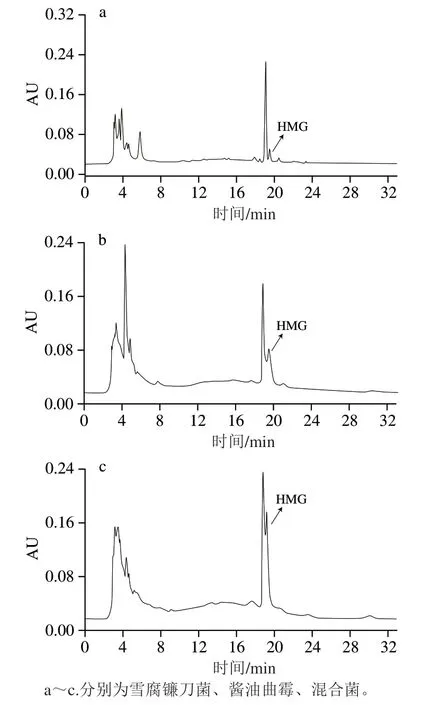
图5 菌种发酵液的色谱图Fig. 5 Chromatograms of HMG in fermentation broths
2.4.3 产物HMG的鉴定结果
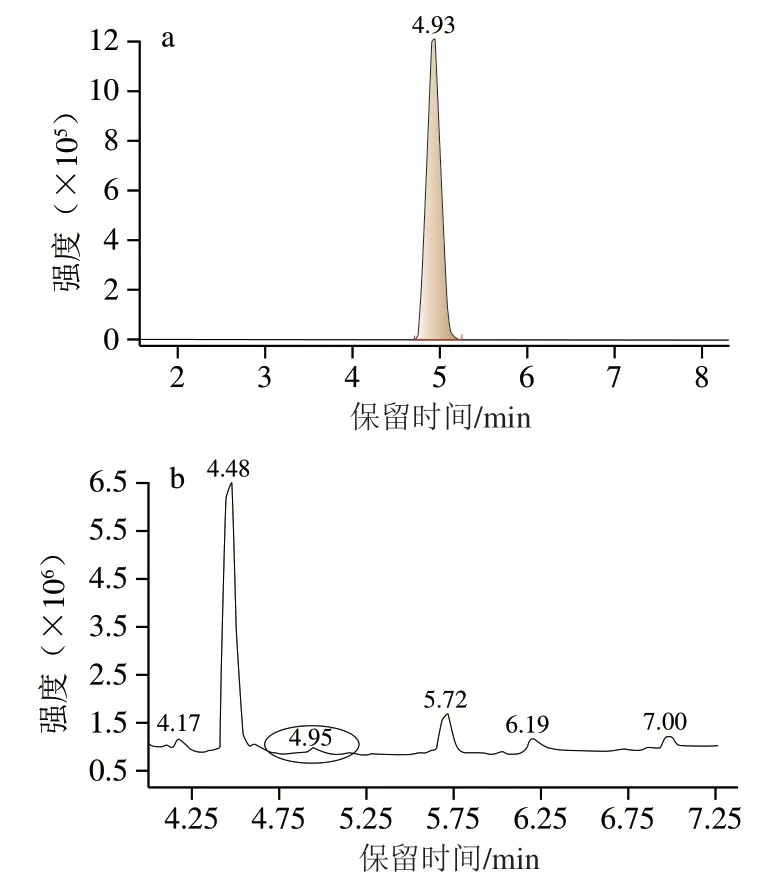
图6 HMG标准样品(a)及菌种发酵液(b)的超高效液相色谱-质谱图Fig. 6 UPLC-MS chromatograms of HMG standard (a) and mixedstrain fermentation broth (b)
已知HMG的相对分子质量为464[27-28],检测得出其保留时间为4.93 min(图6a)。在负离子作用下,一级质谱图中出现m/z463.12的碎片离子峰,说明HMG丢失一个H,形成了[M-H]-的碎片离子峰,而二级质谱图中孤立且强度较大m/z301.07的碎片离子峰,是HMG被打碎之后形成的新的碎片离子峰。图6b是混合菌某一时间点发酵液的检测结果,对比图6a看,其保留时间发生较小偏移,为4.95 min。根据相对分子质量和保留时间这两个条件寻找相对应的物质,该物质经分子拟合之后证实确为HMG。雪腐镰刀菌和酱油曲霉单独发酵的液相色谱-质谱检测结果也得到了同样的结论。总之,通过高效液相色谱的初步检测和超高效液相色谱-质谱技术的结构验证,证实了雪腐镰刀菌、酱油曲霉以及混合菌转化橙皮苷一定时间之后均可得到HMG[29-32]。
2.4.4 产物HMG质量浓度变化
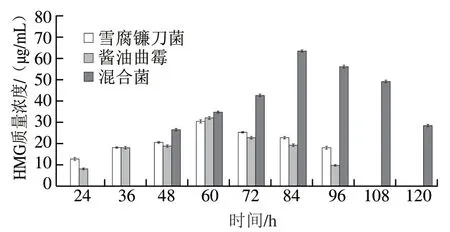
图7 菌种发酵液中HMG质量浓度的变化Fig. 7 Changes in HMG concentration of fermentation broths at different time points
图7为雪腐镰刀菌、酱油曲霉及混合菌某次发酵过程中HMG质量浓度变化情况。通过单因素方差分析可知,雪腐镰刀菌与酱油曲霉差异并不显著,而雪腐镰刀菌与混合菌、酱油曲霉与混合菌分别呈显著差异(P<0.05),该显著性分析与酶活力的分析结果保持一致。混合菌发酵84 h获得最大酶活力(104.81 U/mL)的同时,产生了最大质量浓度(63.52 μg/mL)HMG,若此时对其发酵液进行分离纯化,1 L发酵液可得63.52 mg HMG(不考虑损失),其他任一组合均无法达到该效果。HMG质量浓度可直观地表达发酵效果,是衡量发酵质量的关键因素和重要指标。
3 结 论
雪腐镰刀菌、酱油曲霉及混合菌均在酸性条件(pH 4~6)下完成摇瓶发酵,pH值对微生物的生长及发酵产酶至关重要,适宜pH值可以提高发酵效果。微生物转化橙皮苷生成HMG是通过其产生的α-L-鼠李糖苷酶水解橙皮苷完成,酶活力越高的时间点,该处积累的发酵产物可能就越多,混合菌发酵84 h达到最大酶活力(104.81 U/mL)的同时,也产生了最大质量浓度(63.52 μg/mL)的HMG,此时它的酶活力明显优于雪腐镰刀菌(24.73 U/mL)和酱油曲霉(26.17 U/mL),这表明多种微生物之间存在协同作用,混菌发酵可以弥补菌种之间的代谢差异性,相辅相成能起到单一菌株起不到的作用。发酵产物-HMG经高效液相色谱初步检测和超高效液相色谱-质谱结构验证证明确实存在,并成为衡量发酵效果的关键因素和重要指标。

