淀粉酶纳米花型时间-温度指示剂的制备及性能分析
胡晓波,王 麟,李小娟
(河南牧业经济学院,河南 郑州 450046)
民以食为天,食以安为先,食品安全是关乎人民健康的重大基本民生问题。在食品的整个流通过程中,除了自身影响因素外,食品的质量和安全与外部环境因素(如时间、温度、湿度、光照和机械应力等)密切相关[1],其中温度又是导致食物腐败最不可预测的因素,有效监测食品流通过程中的温度变化至关重要[2]。时间-温度指示剂(time-temperature indicator,TTI)作为一种具有显示作用的智能标签,能通过化学反应或者物理变化在时间和温度上的累积效应[3],监控和记录食品从生产、运输到销售各环节的温度历史,动态显示食品的剩余保质期,为食品生产者、物流管理者以及消费者提供准确检测和评估食品品质的方法[4-7]。
根据反应原理和指示方法的不同,TTI通常分为扩散型、聚合物型和酶型等[8-9]。其中,酶型TTI基于酶与底物之间的反应进行,通过改变酶的类型、起始pH值等就可以改变酶型TTI体系和活化能以适应不同的产品,易于控制且性能稳定、成本低廉,具有更高的准确性和适用性[10-12]。根据TTI中酶的存在形态不同,可将其分为液态酶型TTI和固态酶型TTI,液态酶型TTI中酶不稳定,易失活,限制了其商业化应用[13]。因此,基于固定化酶技术对酶进行固定化,再利用酶促反应构建而成的固态酶型TTI成为一个新的研究方向[3,10,14]。
本研究首先利用淀粉酶中氨基酸残基与铜离子之间的相互作用,对淀粉酶进行固定化,制备淀粉酶@Cu无机杂化纳米花[14-16],研究淀粉酶质量浓度对纳米花形貌结构的影响,筛选出花形最好纳米花[17],并测试纳米花中淀粉酶的生物活性及保存稳定性。然后以可溶性淀粉为底物,碘液为指示剂,改变淀粉酶@Cu纳米花的用量,制备出6种配方的淀粉酶纳米花型TTI[18-22],观察其在不同温度下的颜色变化过程,确定吸光度随时间变化的动力学参数,计算出TTI的活化能。根据TTI与食品匹配原则,确定该系列TTI活化能指示范围,以期为实时监控食品的质量变化提供参考。
1 材料与方法
1.1 材料与试剂
可溶性淀粉、淀粉酶 上海市阿拉丁生物技术有限公司;氯化钠、氯化钾、硫酸铜、盐酸、碘、碘化钾天津市永大化学试剂有限公司;十二水合磷酸氢二钠、磷酸二氢钾 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
BSA224S-CW电子天平 德国Sartorius公司;TG16-WS台式高速离心机 湖南湘仪实验仪器开发有限公司;Scientz-10N冷冻干燥机 宁波新芝科技股份有限公司;TU-1950紫外-可见分光光度计 北京普析通用仪器有限责任公司;Quanta 250 FEG场发射扫描电镜 美国FEI公司;D8 Advance X射线衍射仪 德国Bruker公司;Nicolet iS20傅里叶变换红外光谱仪 美国赛默飞世尔科技公司;STA 2500同步热分析仪 德国Netzsch公司。
1.3 方法
1.3.1 淀粉酶@Cu杂化纳米花的制备
称取10.64 g Na2HPO4·12 H2O、1.39 g KH2PO4、0.40 g氯化钾、16.01 g氯化钠,加水配制成2 L pH 7.4的磷酸缓冲溶液。将6.67 mL 120 mmol/L的硫酸铜溶液和500 mL淀粉酶缓冲溶液混合均匀,其中淀粉酶质量浓度分别为0.025、0.05、0.075、0.1、0.2 mg/mL和0.5 mg/mL。25 ℃水浴中静置3 d后进行离心,沉淀用高纯水进行洗涤,冷冻干燥得到淀粉酶@Cu无机杂化纳米花材料,分别标记为NF-1、NF-2、NF-3、NF-4、NF-5和NF-6。
1.3.2 淀粉酶@Cu杂化纳米花中淀粉酶含量计算
为了测定纳米花中淀粉酶的含量,对干燥的淀粉酶@Cu杂化纳米花进行煅烧,使用STA-2500同步热分析仪测定其热失重曲线,其中纳米花中淀粉酶的质量损失温度为100~800 ℃。淀粉酶在纳米花中的质量分数按式(1)计算:

式中:W为淀粉酶质量分数/%;G0为淀粉酶质量;GN为纳米花质量。
1.3.3 淀粉酶@Cu杂化纳米花活性测试
可溶性淀粉标准曲线的绘制方法:准确配制质量浓度为1.0~3.0 mg/mL的淀粉标准系列,分别将1.0 mL上述淀粉标准液与2.0 mL 1 g/L碘液混合,测试溶液在580 nm波长处的吸光度,以淀粉质量浓度为横坐标,对应的吸光度为纵坐标,拟合出标准线性回归方程。向1.2 mL 2 mg/mL可溶性淀粉溶液中加入干燥的淀粉酶@Cu纳米花,保证纳米花中淀粉酶的质量为1 mg,溶液在50 ℃反应30 min,加入0.3 mL 1 mol/L HCl溶液终止反应,再加入1.5 mL 1 g/L碘液,测定上清液在580 nm波长处吸光度。作为对比,用1 mg淀粉酶代替纳米花,用同样方法测定天然淀粉酶活性。在该实验条件下,每分钟降解1 mg淀粉所消耗的酶量定义为一个酶活力单位(U),每毫克淀粉酶中所含有的酶活力单位数定义为比活力(U/mg),由式(2)计算:

式中:S为酶的比活力/(U/mg);m0为初始淀粉质量(2.4 mg);mt为反应终止后溶液中剩余的淀粉质量(由淀粉标准曲线计算);me为纳米花中淀粉酶含量(1 mg);t为反应时间(30 min)。
1.3.4 淀粉酶@Cu杂化纳米花稳定性测试
将天然淀粉酶和淀粉酶@Cu纳米花分别溶于pH 7.4磷酸缓冲溶液中,溶液室温下长时间放置,利用紫外-可见分光光度计测定淀粉酶和淀粉酶@Cu纳米花生物活性随放置时间的变化情况。
1.3.5 淀粉酶纳米花型TTI的制备
1.3.5.1 可溶性淀粉溶液质量浓度的确定
分别配制质量浓度为10、20、30、40 g/L和50 g/L的可溶性淀粉溶液,各取15 mL与4.5 mL碘液(1 g/L)、40 mg淀粉酶@Cu纳米花混合,测体系在580 nm波长处的初始吸光度,在4 ℃下保存,每隔24 h测反应体系的吸光度。
1.3.5.2 碘液质量浓度的确定
分别配制质量浓度为0.5、0.75、1、1.25 g/L和1.5 g/L的碘液,各取4.5 mL与15 mL可溶性淀粉溶液(40 g/L)、40 mg淀粉酶@Cu纳米花混合,测体系在580 nm波长处的初始吸光度后4 ℃保存,每隔24 h测反应体系的吸光度。
1.3.5.3 TTI的制备
确定出淀粉溶液和碘液的最佳质量浓度后,将15 mL可溶性淀粉溶液和4.5 mL碘液混合均匀,分别加入10、20、30、40、50、60 mg的淀粉酶@Cu纳米花,制备出6种配方的TTI,分别标号为1#TTI、2#TTI、2#TTI、3#TTI、4#TTI、5#TTI和6#TTI。
1.3.6 TTI体系颜色变化及动力学参数的确定
将6种配方的TTI溶液分别放置在5、15、25、35 ℃的恒温培养箱中反应,每隔一段时间进行拍照,并测试溶液在580 nm波长处吸光度,绘制吸光度随时间变化的曲线。利用Origin软件对TTI的吸光度-时间曲线进行拟合,得到TTI在不同温度下的反应速率常数。根据Arrhenius方程[23],求得TTI反应体系的活化能,从而确定出淀粉酶纳米花型TTI的适用范围。
2 结果与分析
2.1 淀粉酶@Cu纳米花的制备
蛋白质-无机杂化纳米花是一种新型固定化酶材料,实验中利用淀粉酶和硫酸铜制备了淀粉酶-无机杂化纳米花NF-1、NF-2、NF-3、NF-4、NF-5和NF-6,用扫描电镜对其形貌进行表征。从图1可知,在制备纳米花过程中,溶液中淀粉酶质量浓度较低时,得到的纳米花NF-1、NF-2和NF-3花状结构不完整,存在大量碎片,这是因为淀粉酶质量浓度较低时,溶液中晶体成核位点较少,影响晶体生长;纳米花NF-4和NF-5出现完整的花状结构,但形貌不统一,仍有碎片存在;淀粉酶质量浓度增大到0.5 mg/mL时,溶液中存在大量成核位点,纳米花NF-6中没有碎片存在,只有完整的花状结构。以上结果说明在形成纳米花过程中,淀粉酶质量浓度直接影响纳米花的形貌结构,实验选用NF-6进行下步研究。
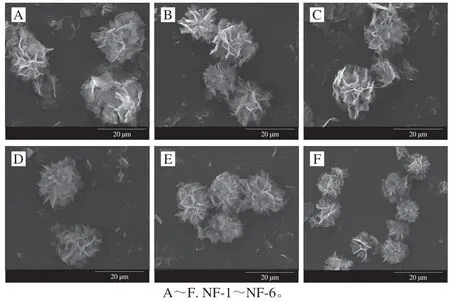
图1 淀粉酶与硫酸铜反应产物扫描电镜图(×5 000)Fig. 1 SEM of the reaction product between amylase and copper sulfate (× 5 000)
通过X射线衍射对纳米花NF-6的晶体结构进行表征,如图2a所示。NF-6分别在9.09°、12.89°、20.92°、29.45°、33.64°、37.21°、41.86°和53.52°处出现强的特征衍射峰,与Cu3(PO4)2·3H2O的标准卡片(JPSCD 00-022-0548,图2b)一致,说明纳米花NF-6具有高结晶度,且其结构中的无机组分是Cu3(PO4)2·3H2O。
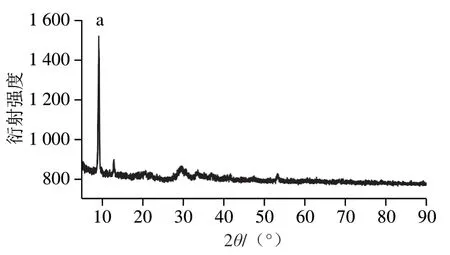
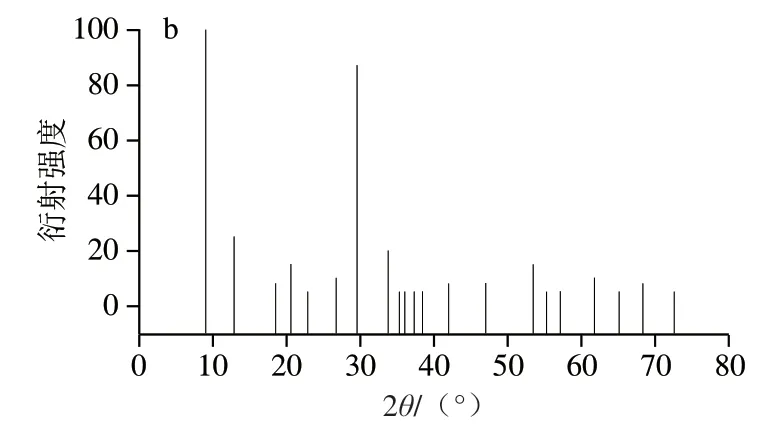
图2 纳米花NF-6(a)和Cu3(PO4)2·3H2O(b)的X射线衍射图Fig. 2 XRD pattern of NF-6 and Cu3(PO4)2·3H2O
利用红外光谱仪测定纳米花NF-6的红外吸收光谱,如图3所示。NF-6在600~500 cm-1和1 100~940 cm-1出现强吸收峰,这是P—O振动和O—P=O弯曲造成,证明纳米花中含有磷酸基团;在1 600~1 400 cm-1出现酰胺键的特征吸收峰,在3 000~2 800 cm-1出现—CH2—和—CH3伸缩振动吸收峰,在3 500 cm-1处出现O—H强的宽吸收峰,说明纳米花中含有淀粉酶。
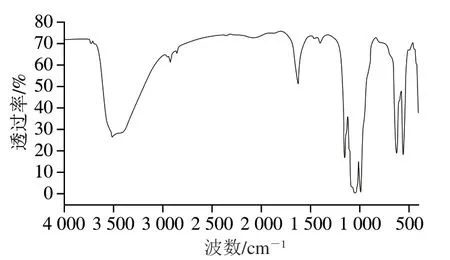
图3 NF-6的红外吸收光谱图Fig. 3 Infrared absorption spectrum of NF-6
2.2 淀粉酶@Cu纳米花活性分析
通过热重分析研究淀粉酶@Cu杂化纳米花中淀粉酶含量,如图4所示。从纳米花的热失重曲线可知,从室温到100 ℃质量损失6.06%,100~800 ℃范围内质量损失19.58%,即纳米花中结晶水质量分数为6.06%,淀粉酶质量分数为19.58%,而Cu3(PO4)2仍作为无机组分存在于纳米花中。
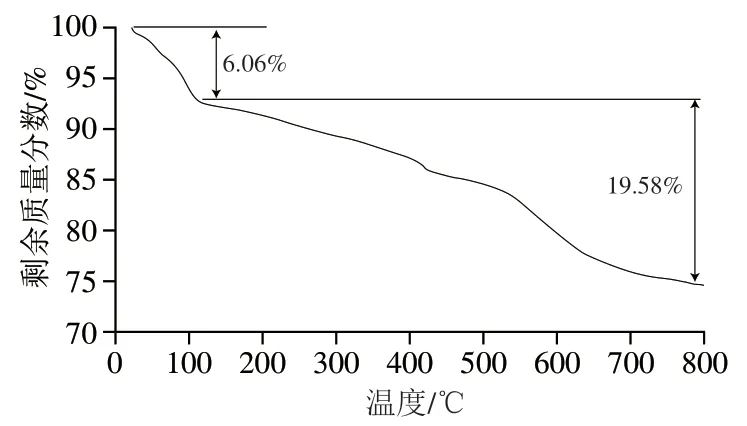
图4 纳米花NF-6的热重分析谱图Fig. 4 TGA spectrum of NF-6
将干燥的天然淀粉酶和淀粉酶@Cu纳米花NF-6分别加入到可溶性淀粉溶液中,反应结束后添加碘液并进行紫外-可见分光光度计测试。利用可溶性淀粉的标准曲线y=1.009 2x+0.012 6(R2=0.997 6),计算出天然淀粉酶比活力为18.24 U/mg,NF-6中淀粉酶比活力为62.36 U/mg。将天然淀粉酶的活性定义为100%,可计算出NF-6的相对活性为342%,说明淀粉酶固定化后其活性提高到3.42 倍,这主要是因为纳米花比表面积大,能增大酶与底物之间的传质,提高酶的生物活性。
实验配制相同淀粉酶质量浓度的天然淀粉酶和淀粉酶@Cu纳米花NF-6溶液,将溶液放置室温下,以起始天然淀粉酶活性作为参照,测定淀粉酶及纳米花中淀粉酶在不同时间下的相对活性。从图5可知,随着放置时间的延长,天然淀粉酶和纳米花中淀粉酶相对活性逐渐减低,但纳米花中淀粉酶相对活性降低速度较慢。7 d后,天然淀粉酶的相对活性为21.5%,而纳米花中淀粉酶相对活性为187%,明显高于天然淀粉酶活性。这是因为纳米花结构能够保护淀粉酶,使其保存稳定性提高,失活速度减慢。
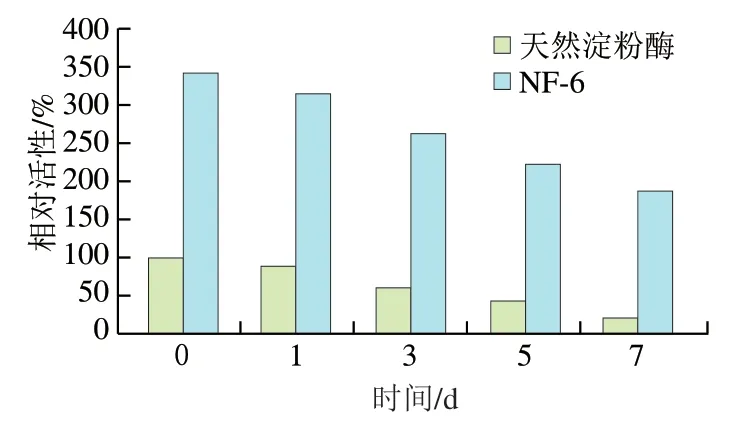
图5 天然淀粉酶和NF-6中淀粉酶不同时间下的相对活性Fig. 5 Relative activities of native amylase and NF-6 after different storage times
以上结果说明淀粉酶能与硫酸铜之间相互作用,形成淀粉酶@Cu纳米花材料,该材料能显著提高淀粉酶的生物活性及保存稳定性,使其更稳定,降低淀粉酶的使用成本。
2.3 淀粉酶纳米花型TTI底物质量浓度的确定
淀粉酶纳米花型TTI是基于淀粉酶与底物之间的酶促反应进行,研究底物质量浓度对TTI指示效果的影响。固定TTI中淀粉酶@Cu纳米花NF-6加入量40 mg、可溶性淀粉溶液加入量15 mL、碘液加入量4.5 mL,分别改变可溶性淀粉溶液和碘液质量浓度,讨论4 ℃条件下其质量浓度对TTI体系在580 nm波长处吸光度的影响。从图6a可知,淀粉质量浓度越大,起始吸光度就越大,但5个质量浓度下吸光度的降低速度基本一致,先快后慢慢趋于平稳。这是由于酶反应的速率与底物质量浓度有关,底物质量浓度越大,反应速率就越快。随着淀粉酶不断水解淀粉,溶液最终趋于无色透明,吸光度趋近于0。其中淀粉质量浓度为40 g/L时,其初始吸光度与50 g/L相差不大,但明显大于其他质量浓度,为后续的吸光度降低提供了空间,即整个过程中吸光度的变化幅度会比较大。从图6b可知,随着碘质量浓度的增加,起始吸光度明显增加,反应时间变长。当碘液质量浓度为0.5、0.75 g/L和1.0 g/L时,TTI体系吸光度降低到0时所需时间分别约为72、96 h和120 h;当碘液质量浓度达到1.25 g/L和1.5 g/L时,5 d后TTI体系仍有颜色,吸光度较高,不利于观察TTI颜色变化。时间已达到所需的6 d。综合考虑,将该TTI中的淀粉质量浓度确定为40 g/L,碘液质量浓度确定为1.0 g/L。
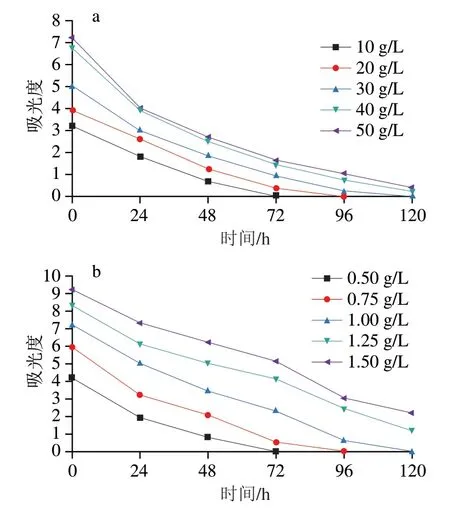
图6 可溶性淀粉质量浓度(a)和碘液质量浓度(b)对TTI体系在580 nm波长处吸光度的影响Fig. 6 Effect of concentration of soluble starch (a) and concentration of iodine (b) on A580 nm of the TTI system
2.4 淀粉酶纳米花型TTI颜色变化过程
在淀粉酶作用下,淀粉发生水解反应,聚合度或相对分子质量逐渐降低,导致其与碘作用形成的包合物发生褪色,由蓝色变成无色,且褪色速度与温度和时间有关[24]。实验观察5、15、25 ℃和35 ℃条件下淀粉酶纳米花型TTI的颜色随时间的变化过程。从图7可知,6种配方的TTI在放置过程中溶液颜色产生从深蓝色-蓝色-浅蓝色-无色的明显变化,且温度越高,变色速度越快。TTI的颜色与食品质量正相关[25],当TTI呈现深蓝色时,此时食品比较新鲜,可以放心食用;当TTI褪色成无色时,此时食品已发生腐败变质,不能再食用。

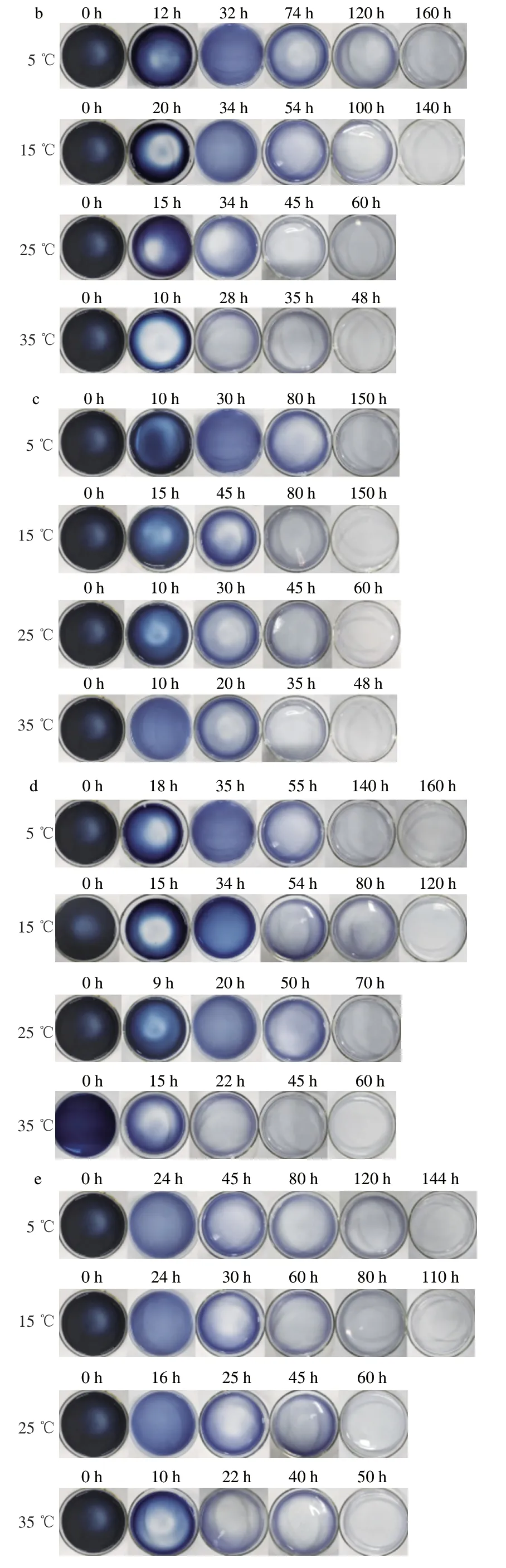

图7 不同温度下各TTI颜色随时间的变化过程Fig. 7 Color change of TTIs at different temperatures
2.5 淀粉酶纳米花型TTI动力学参数确定
反应过程中淀粉酶纳米花型TTI在580 nm波长处吸光度发生变化,实验中监测了6种配方的TTI在5、15、25 ℃和35 ℃条件下吸光度随时间的变化,并绘制出吸光度随时间变化的曲线,如图8所示。利用Origin软件采用式(3)对吸光度-时间曲线进行指数函数拟合。

式中:X为TTI体系的吸光度;t为反应时间/h;a、k及b为拟合函数参数。
由此得到淀粉酶纳米花型TTI在不同温度条件下的反应速率k,如表1所示。

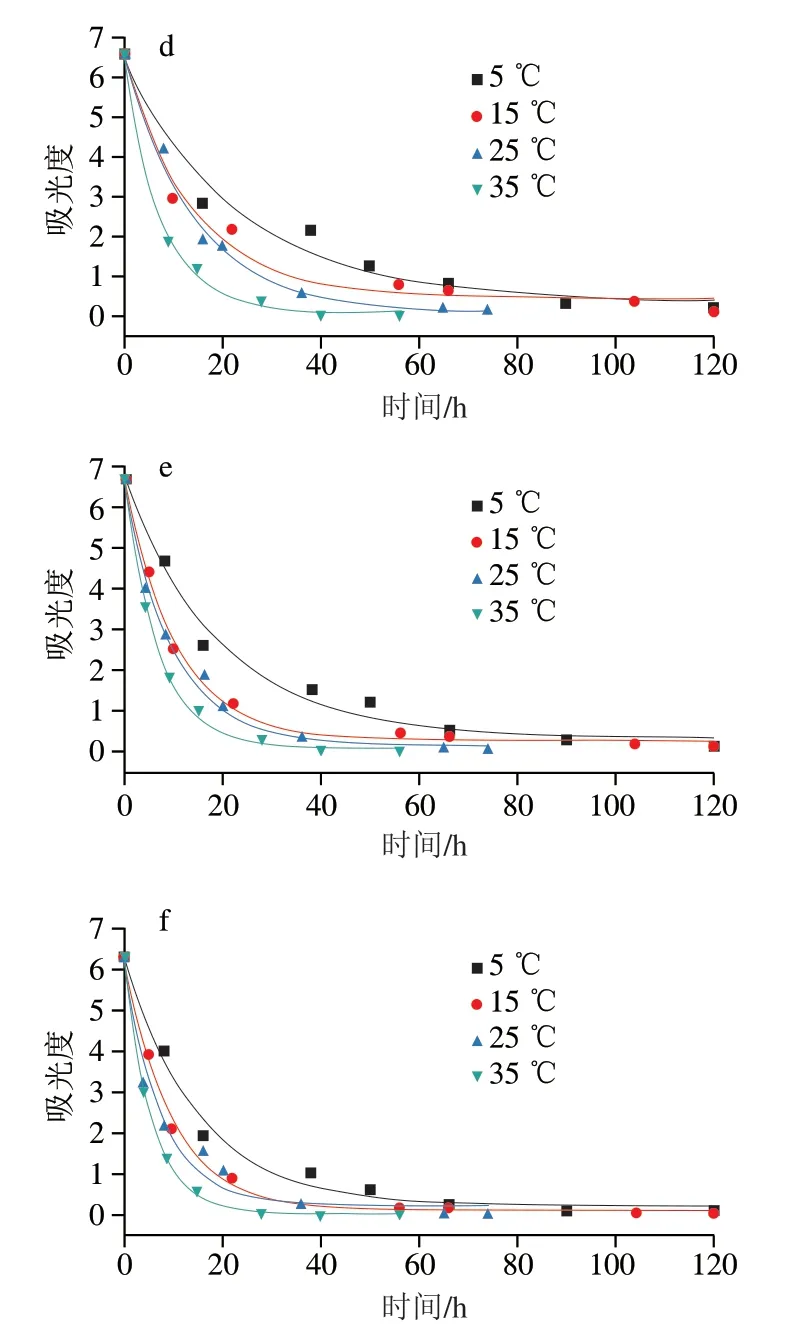
图8 不同温度下各TTI吸光度随时间的变化曲线Fig. 8 Absorbance versus time curves of TTIs at different temperatures
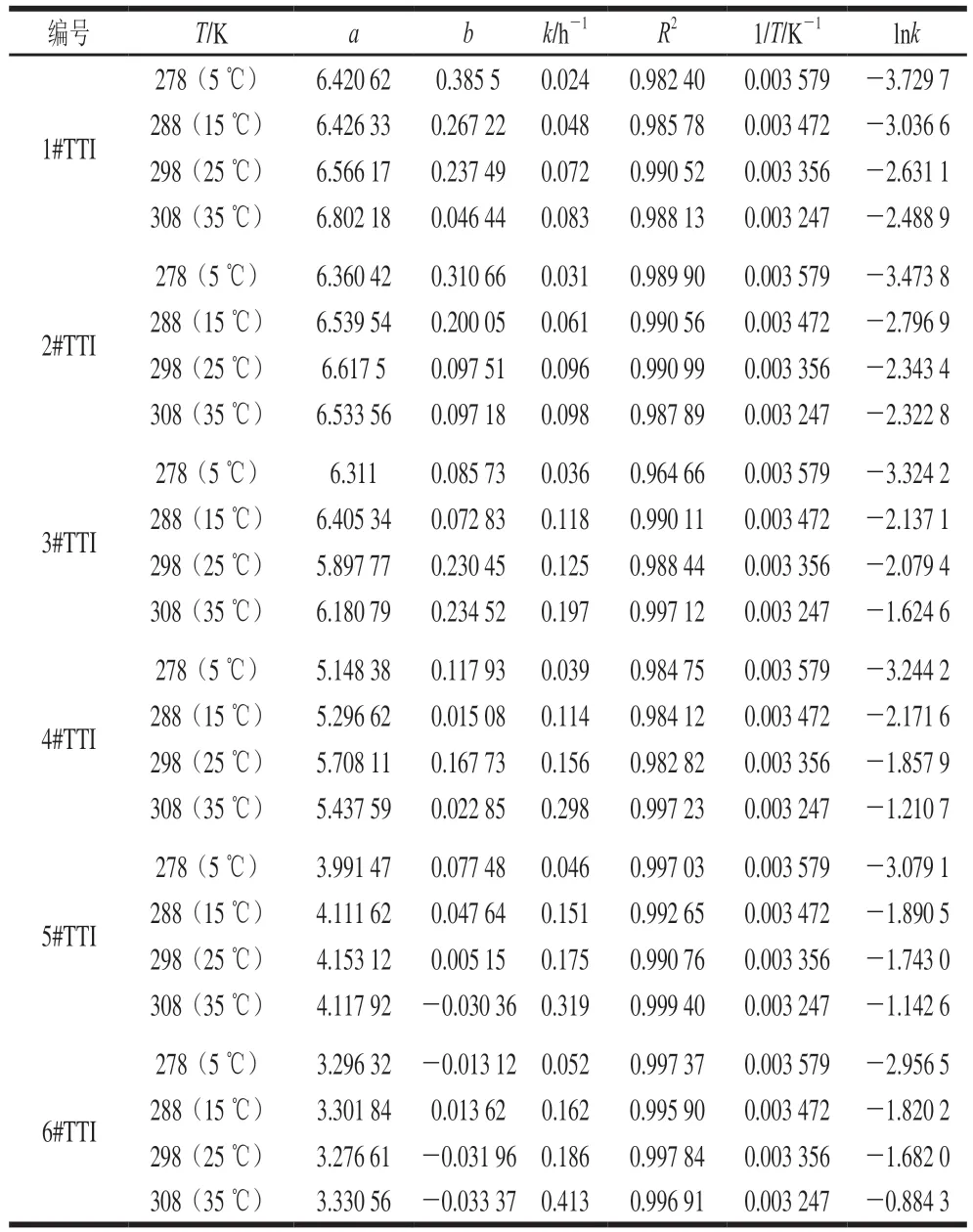
表1 各TTI拟合曲线参数及相应lnk值Table 1 Fitting parameters and lnk values for TTIs
从表1可以看出,不同温度条件下的拟合曲线方程相关系数R2都在0.96以上,说明6种TTI在不同温度条件下吸光度与时间的指数相关性显著。
2.6 淀粉酶纳米花型TTI活化能计算
酶促反应中反应温度对反应速率的影响遵循Arrhenius方程[23]:

式中:k为反应速率常数/h-1;k0为指前因子/h-1,对于指定反应是一个常数;Ea为活化能/(kJ/mol);T为热力学温度/K;R为摩尔气体常数(8.314 J/(mol·K))。
以lnk对1/T作图,若两者呈明显线性关系,则说明不同温度下的反应速率符合Arrhenius方程,可利用Arrhenius方程计算出反应的活化能。根据表1中不同温度条件下相应的lnk值,绘制lnk与1/T的关系曲线,如图9所示。利用Origin软件对各曲线进行线性拟合,得到拟合方程,根据Arrhenius方程可以求得各自的活化能Ea和指前因子k0,如表2所示。

图9 各TTI的lnk与1/T的拟合直线Fig. 9 Fitting curves of lnk against 1/T for TTIs

表2 各TTI的动力参数Table 2 Kinetic parameters for TTIs
由拟合参数可以看出,lnk和1/T的相关性R2在0.93以上,线性关系比较显著,6种配方的TTI活化能分别为14.84、21.00、28.85、33.03、32.55 kJ/mol和32.83 kJ/mol。根据TTI与食品匹配原则,当TTI活化能与食品腐败活化能相差25 kJ/mol时,该TTI便可应用于该产品[26-27]。因此6种配方的TTI可以指示的产品活化能范围分别为0~39、0~46、3~53、8~58、7~57 kJ/mol和7~57 kJ/mol,适用于监测由扩散控制、酶反应、脂肪氧化等原因[28-31]引起腐败变质的食品质量变化。
3 结 论
基于酶与金属离子间的相互作用,成功制备了淀粉酶@Cu纳米花,其中淀粉酶质量浓度为0.5 mg/L,纳米花的形貌结构最完整,该纳米花能显著提高淀粉酶的生物活性和保存稳定性。选用可溶性淀粉溶液为底物,碘液为指示剂,加入淀粉酶@Cu纳米花,制备出6种配方的淀粉酶纳米花型TTI,观察了TTI由深蓝色到无色的变化过程,研究了不同温度下TTI的吸光度随时间的变化曲线。通过动力学参数研究,计算出6种TTI的活化能分别是14.84、21.00、28.85、33.03、32.55 kJ/mol和32.83 kJ/mol,适用于监测由扩散控制、酶反应、脂肪氧化等原因引起腐败变质的食品质量变化。

