胃癌组织lncRNA MEG3、miR-7-5p表达水平变化及与患者临床分期和预后的关系*
贾旻蕾,刘瑞丽,李兰军
河北省邯郸市第一医院普外三科,河北邯郸 056002
胃癌(GC)是全球范围内最常见的肿瘤之一,研究数据显示,2018年全球有超过100万的GC新发病例,至2020年我国GC发病率约为24.30/10万,新发病例约为34.6万,总病死病例超过37万[1-2]。尽管随着诊疗技术的不断进步,GC患者生存期逐渐延长,但GC发生、发展的分子机制尚未完全明确,患者5年生存率仍处于较低水平[3-4]。长链非编码RNA(lncRNA)母系表达基因3(MEG3)是第一个被发现的具有抑癌基因活性的lncRNA家族成员,相关研究表明,肝细胞癌、前列腺癌组织中lncRNA MEG3表达缺失,而lncRNA MEG3表达缺失有利于肿瘤血管新生,促进肿瘤组织恶性演变[5-6]。微小RNA(miR)-7-5p是位于9q21染色体上的一种核糖核酸,研究证实,其在非小细胞肺癌等低放射敏感性的肿瘤细胞内表达上调,其表达水平可能与肿瘤治疗反应性有关[7]。本研究对GC组织中lncRNA MEG3、miR-7-5p表达水平变化及与患者临床分期及预后的关系进行了探讨,以期为临床诊疗提供参考,现报道如下。
1 资料与方法
1.1一般资料 选取2017年1月至2019年12月本院收治的104例GC患者为研究对象,将患者的GC组织标本作为GC组,对应的癌旁组织标本作为癌旁组织组,另选取同期52例行手术治疗的胃良性肿瘤患者的肿瘤组织标本作为良性肿瘤组。 104例GC患者中临床分期Ⅰ期28例,Ⅱ期36例,Ⅲ期26例,Ⅳ期14例。纳入标准:(1)GC组患者符合GC诊断标准[8],良性肿瘤组患者符合胃良性肿瘤的诊断标准[9];(2)患者均为首次确诊,入组前未经手术、放化疗等任何相关治疗;(3)原发性肿瘤;(4)GC患者病理检查诊断为腺癌;(5)GC患者经评估可实现R0切除或需行姑息性切除术;(6)预计生存期>3个月。排除标准:(1)合并其他类型肿瘤;(2)伴肝、肾、心等重要器官功能障碍;(3)卡氏评分(KPS评分)<70分,不耐受手术者;(4)有腹部手术史者。GC组与良性肿瘤组患者性别、年龄、体质量指数(BMI)、饮食习惯、吸烟史、饮酒史比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经本院医学伦理委员会审批通过,研究对象对研究内容知情同意,并签署知情同意书。

表1 GC组与良性肿瘤组患者一般资料比较
1.2方法 取手术收集的标本100 mg置于研磨器中,加Trizol试剂1 mL,研磨器置于液氮中研磨,静置5 min,提取总RNA,参照加拿大Fermentas公司生产的反转录试剂盒说明书合成cDNA,检测纯度后液氮保存待用。引物由金斯瑞生物科技有限公司提供。lncRNA MEG3上游引物5′-CTGCCCATCTACACCTCACG-3′,下游引物5′-CTCTCCGCCGTCTGCGCTAGGGGCT-3′;miR-7-5p上游引物5′-UGGAAGACUAGUGAUUUUGUUGUU-3′,下游引物5′-CAACAAAAUCACUAGUCUUCCAUU-3′。反应条件:95 ℃ 10 min预变性,95 ℃ 15 s,60 ℃ 1 min,40个循环,设置3个复孔。采用2-ΔΔCt法计算lncRNA MEG3、miR-7-5p表达水平。
1.3观察指标 (1)对比3组lncRNA MEG3、miR-7-5p表达水平。(2)对比不同临床分期GC患者GC组织lncRNA MEG3、miR-7-5p表达水平,并分析GC组织lncRNA MEG3、miR-7-5p表达水平与患者临床分期的相关性。(3)分析GC患者临床分期的影响因素。(4)随访24个月,比较GC组织不同lncRNA MEG3、miR-7-5p表达水平患者的生存情况。

2 结 果
2.1GC组、癌旁组织组、良性肿瘤组lncRNA MEG3、miR-7-5p表达水平比较 GC组lncRNA MEG3、miR-7-5p表达水平低于癌旁组织组、良性肿瘤组,癌旁组织组lncRNA MEG3、miR-7-5p表达水平高于良性肿瘤组,差异有统计学意义(P<0.05),见表2。
2.2GC组织lncRNA MEG3、miR-7-5p表达水平与患者临床分期的关系 不同临床分期患者GC组织lncRNA MEG3、miR-7-5p表达水平比较,差异有统计学意义(P<0.05),随着临床分期的进展,GC组织lncRNA MEG3、miR-7-5p表达水平呈降低趋势,差异有统计学意义(P<0.05),见表3。Spearman相关分析结果显示,GC组织lncRNA MEG3、miR-7-5p表达水平与患者临床分期均呈负相关(r=-0.527、-0.501,P<0.05)。
2.3影响GC患者临床分期的单因素分析 不同临床分期GC患者性别、年龄、BMI、饮食习惯、吸烟史、饮酒史、肿瘤最大径、肿瘤位置、脉管癌栓情况、神经浸润情况、肿瘤类型比较,差异无统计学意义(P>0.05);不同临床分期GC患者组织分化程度、合并胃溃疡情况、浸润深度比较,差异有统计学意义(P<0.05),见表4。

表2 GC组、癌旁组织组、良性肿瘤组lncRNA MEG3、miR-7-5p表达水平比较

表3 不同临床分期患者GC组织lncRNA MEG3、miR-7-5p表达水平比较
表4 影响GC患者临床分期的单因素分析结果[n(%)或
续表4 影响GC患者临床分期的单因素分析结果[n(%)或
2.4影响GC患者临床分期的多因素Logistic回归分析 以临床分期作为因变量,以表3、表4中差异有统计学意义的指标作为自变量进行多因素Logistic回归分析,变量赋值情况见表5。结果显示,GC组织lncRNA MEG3、miR-7-5p表达水平为GC患者临床分期的影响因素(P<0.05)。见表6。

表5 变量赋值情况
2.5GC组织不同lncRNA MEG3、miR-7-5p表达水平患者生存情况比较 对GC患者随访24个月,期间失访3例,死亡21例,生存80例。分别以GC组织lncRNA MEG3、miR-7-5p表达水平均值为界分组,>均值为高表达,≤均值为低表达。Kaplan-Meier生存分析结果显示,lncRNA MEG3高表达患者生存率高于lncRNA MEG3低表达患者(χ2=5.344,P=0.021);miR-7-5p高表达患者生存率高于miR-7-5p低表达患者(χ2=5.208,P=0.023)。生存曲线见图1、图2。

表6 影响GC患者临床分期的多因素Logistic回归分析结果
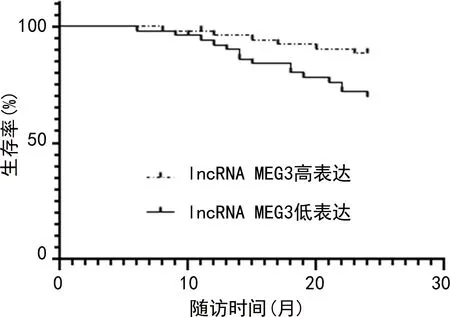
图1 GC组织不同lncRNA MEG3表达水平患者生存情况

图2 GC组织不同miR-7-5p表达水平患者生存情况
3 讨 论
GC发病机制复杂,病因也尚未完全明确,超过90%的GC病理类型为腺癌,GC早期缺乏典型症状,多数患者就诊时已是中、晚期[10-11]。积极探明GC发生、发展相关分子机制是指导临床完善治疗方案、提升患者治疗效果的关键。
近年来有关GC预后的研究主要集中在血清学指标,有研究发现,糖类抗原19-9、癌胚抗原等肿瘤标志物对评估GC患者病情转归具有一定临床参考价值,但限于GC发生、发展机制复杂的特征,总体评估效果并不理想[10]。随着对基因组学研究的不断深入,发现基因组序列中仅2%可被翻译为蛋白质,其余大部分转录成非编码RAN,lncRNA是转录本长度超过200个核苷酸的一类RNA分子的总称,其与转录、表观遗传等的调控有关,且与肿瘤发生、发展也有一定关系。lncRNA MEG3是定位在染色体14q32.3上的长度为1.6 kb的一种小鼠母系印记基因GTL2人类同系物,生理状态下其在卵巢、脑等组织内高表达[12-13]。有研究证实,敲除lncRNA MEG3可强化胰腺癌细胞增殖活力及侵袭、迁移能力,且lncRNA MEG3低表达会增加中年人群结直肠癌的发生风险[14]。本研究结果显示,GC组织中lncRNA MEG3表达水平明显低于癌旁组织及胃良性肿瘤组织(P<0.05),分析出现该结果的原因如下:(1)lncRNA MEG3可与蛋白编码基因上游启动子区域结合而影响下游基因表达;(2)lncRNA MEG3能抑制RNA聚合酶Ⅱ或调节染色质重构、组蛋白修饰,调控下游基因表达;(3)lncRNA MEG3与蛋白基因转录本结合形成互补双链,影响mRNA剪切;(4)lncRNA MEG3与蛋白基因转录本结合形成互补双链后在Dicer酶作用下生成内源性siRNA,继而调节基因表达[15-16]。lncRNA MEG3通过上述转录调控、蛋白修饰及染色质重塑等多个层面调控靶基因表达,发挥生物学效应,当其表达水平降低时可直接造成对应基因表达调控机制失衡,甚至引起细胞无序增殖、生长。因此,GC发生、发展可能与lncRNA MEG3表达水平异常有关。进一步经Spearman相关分析结果显示,GC组织lncRNA MEG3表达水平与患者临床分期呈负相关(P<0.05),提示lncRNA MEG3表达水平降低可增强肿瘤恶性生物学行为。本研究多因素Logistic回归分析结果显示,GC组织lncRNA MEG3表达水平是患者临床分期的影响因素,lncRNA MEG3可能在GC发生、发展中发挥抑癌基因活性。有研究发现,脉管癌栓情况、分化程度等均是GC患者临床分期的影响因素[17-18],但本研究未得出类似结论,可能与纳入研究的样本量、样本选择不同有关。
研究证实,miR-7-5p能通过靶向基因抑制结直肠癌、胰腺癌等多种恶性肿瘤细胞的增殖、侵袭、迁移,且能提高耐药肿瘤细胞的敏感性[19-21]。本研究发现,GC组织中miR-7-5p表达水平明显低于癌旁组织及胃良性肿瘤组织(P<0.05),提示miR-7-5p可能与lncRNA MEG3具有相同的生物学活性。相关研究显示,miR-7-5p可通过Kruppel样因子4/磷脂酰肌醇3-激酶/丝氨酸-苏氨酸激酶/p21通路扼制前列腺癌干细胞样特性[22]。推测miR-7-5p也可能通过调控GC细胞生物学功能而实现抗肿瘤作用。本研究相关性分析发现,GC组织miR-7-5p表达水平与患者临床分期呈负相关(P<0.05)。分析出现该结果可能与以下机制有关:miR-7-5p能抑制GC细胞内表皮生长因子受体表达,进而阻断GC细胞的侵袭及迁移,另外,miR-7-5p可通过靶向抑制REGγ表达阻断细胞周期,抑制肿瘤细胞增殖,而在GC细胞内REGγ同样是miR-7-5p的靶基因,其能高度特异性抑制GC细胞增殖,而肿瘤细胞增殖、侵袭及迁移是临床分期进展的主要特征。此外,本研究随访发现,GC组织lncRNA MEG3、miR-7-5p高表达患者生存率高于低表达患者,提示lncRNA MEG3、miR-7-5p与GC患者的预后有关,可作为判断患者生存情况的重要指标。
综上所述,GC组织中lncRNA MEG3、miR-7-5p水平呈异常低表达,且表达水平越低的患者临床分期越高,预后相对更差,lncRNA MEG3、miR-7-5p可作为GC病情及预后评估的参考指标。

