高中化学流程试题解答方法研究
彭富国
(甘肃省民乐县第一中学 734500)
近年来,由于高中化学流程类试题能够将化学变化和物质转化融合到实际的工业或实验情境中,契合新课程理念,能够对学生化学知识进行综合性考查,因此成了热点题型.探索高中化学流程类试题的解题方法有助于学生更好地理解化学规律,运用化学基础知识灵活地对待实际问题,提高学生的解题效率,培养学生学科素养.
1 矿石冶炼类流程试题
例1锂辉石是一种天然的矿物质,在工业生产中,一般会对其进行加热处理,成为不可逆的β-锂辉石,然后制备用于医药、陶瓷领域的碳酸锂.已知β-锂辉石主要由Li2O·Al2O3·4SiO2组成,通过β-锂辉石生产碳酸锂的流程如图1所示.

图1
已知:一些金属离子的氢氧化物完全沉淀时的pH见表1.

表1
一些物质在303K时的溶解度见表2.

表2
(1)在用硫酸浸取锂的时候,需要将β-锂辉石进一步处理,研磨成细小的颗粒,这样做有什么好处?____.
(2)流程图中,加入硫酸后,浸取液中还有大量的金属离子,诸如:Fe3+、Fe2+、Mg2+、Al3+、Na+、Ca2+等,为了除去浸取液中的杂质,需要加入____(填“稀硫酸”、“石灰石”或“氯化钙”)调节浸取液的pH为6左右,使得杂质离子沉淀,初步纯化浸取液.
(3)在Ⅱ的除杂过程中,需要依次加入过氧化钠溶液、石灰乳和碳酸钠溶液,这样做能够除去的金属离子有____.
解析第(1)问主要是考查学生基本化学原理,与题干本身信息联系不大,研磨粉碎是一般工业生产的第一步,主要是为了加快反应接触面积,提高反应速度.主要目的是增大β-锂辉石与硫酸的接触面积,提高反应效率;第(2)问是初步除去β-锂辉石浸出液里面的金属离子杂志,需要结合金属氢氧化物完全沉淀PH表进行判断,由于所选的物质中只有石灰石具有氢氧根,因此需要加入石灰石.第(3)问是对浸出液进一步除杂,通过添加石灰石主要除去了浸出液中的3价铁离子和3价铝离子,因此,加入双氧水主要是将2价铁离子氧化成3价铁离子,加入石灰乳,能够将Fe2+和Mg2+转化为沉淀除去,最后加入碳酸钠,能够将Ca2+转化为沉淀除去,因此,除杂过程中主要是除去Ca2+、Fe2+和Mg2+.
2 化工材料的提纯和综合利用流程试题
例2 随着科技的发展,石墨在工业中的应用也越来越多,从初级石墨到石墨还需要进行复杂的提纯工艺,初级石墨中石墨占比83.5%左右,二氧化硅占比7.8%左右、三氧化二铝占比5.1%左右、三氧化二铁占比3.1%左右、氧化镁占比0.5%左右,初级石墨的提纯工艺如图2所示.(已知金属氯化物沸点都高于150℃,SiCl4沸点为57.6℃)

图2
(1)初级石墨加热反应前,要先通入氮气,一段时间后再通入氯气,这样做主要是为了____.
(2)初级石墨在高温和通入氯气的情况下,其中的氧化物杂质和氯气反应生成氯化物,那么,气体Ⅰ中主要的含碳氧化物为____,气体Ⅱ中某物质与氢氧化钠反应生成水玻璃的化学反应方程式____.
(3)固体Ⅲ经过的操作步骤①主要是____、____,经过步骤①得到的溶液中还有的阴离子有____.

3 模拟化工生产实验类流程试题
例3侯德榜的侯氏制碱法为我国纯碱工业的发展奠定了基础,某个化学兴趣小组依据侯氏制碱法原理,通过实验的方法制备纯碱,并得到副产品氯化铵和碳酸氢钠,其主要实验流程如图3所示.
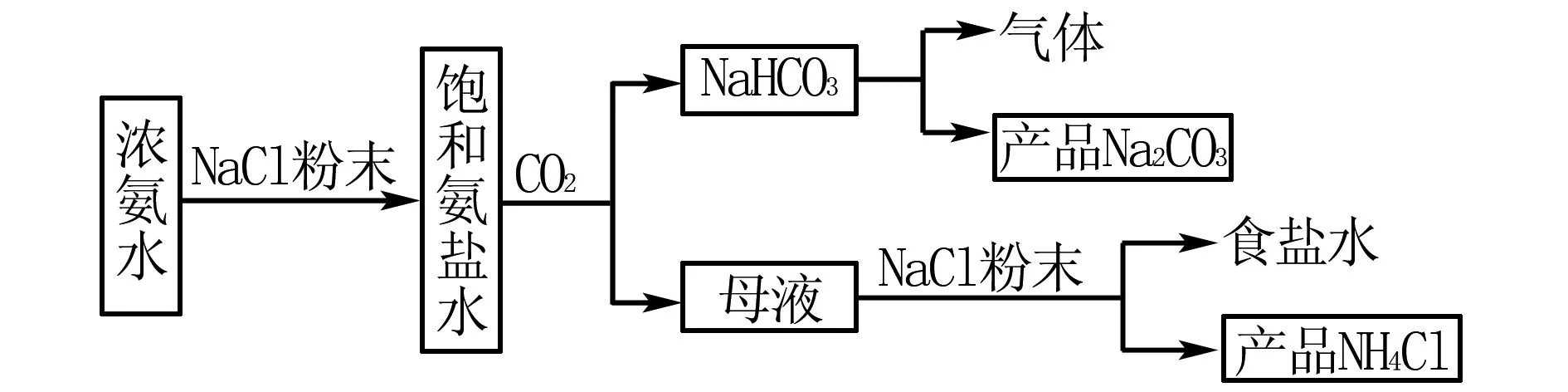
图3
(1)图4中给出了实验所需的设备,请从其中选择合适的设备,按照气流方向正确的连接顺序是____(填写仪器上的小写字母).A设备中的分液漏斗上部玻璃塞打开或____是可以让其中的稀盐酸顺利滴下.

图4
(2)B装置中通入饱和氨盐水需要通过雾化装置,其优点是____.
(3)该小组通过实验方式生产纯碱的总反应化学方程式是____.
(4)实验反应充分后,对装置B中的物质进行处理得到滤液和碳酸氢钠:
①将NaHCO3加热产生的气体依次通过足量的浓硫酸和过氧化钠,通过测量发现过氧化钠质量增加了0.14g,那么NaHCO3的质量为____.

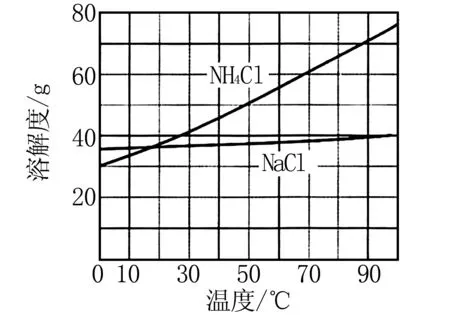
图5
(5)实验中常用无水NaHCO3作为标定盐酸浓度的基准物质,当其吸收了一定的水分后,在用它标定盐酸浓度将使得结果____(填“不变”、“偏低”、“偏高”).


